Các dạng bài toán cho H+ vào muối cacbonat và ngược lại hay nhất
Các dạng bài toán cho H+ vào muối cacbonat và ngược lại hay nhất
Với Các dạng bài toán cho H+ vào muối cacbonat và ngược lại hay nhất Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập toán cho H+ vào muối cacbonat và ngược lại từ đó đạt điểm cao trong bài thi môn Hoá 11.

I. Lý thuyết và phương pháp giải
1. Nhỏ từ từ dung dịch H+ vào dung dịch gồm CO32- và HCO3-
Đầu tiên CO32- sẽ phản ứng với H+ trước:
CO32- + H+ → HCO3- (1)
Hết CO32- thì HCO3- mới phản ứng với H+
HCO3- + H+ → CO2 + H2O (2)
Chú ý:
+ Nếu nCO32- < nH+ < 2nCO32- + nHCO3- thì phản ứng (1) xảy ra hoàn toàn, phản ứng (2) xảy ra một phần, ta có: nH+ = nCO32- + nCO2
+ Nếu nHCl < nCO32- thì phản ứng (1) xảy ra một phần, H+ hết và không thoát ra khí CO2.
+ Nếu nHCl < nCO32- + nHCO3- thì phản ứng (1) và (2) xảy ra hoàn toàn, H+ dư.
2. Nhỏ từ từ dung dịch gồm CO32- và HCO3- vào dung dịch H+
Khi nhỏ từ từ dung dịch gồm CO32- và HCO3- vào dung dịch H+ thì cả hai CO32- và HCO3- đồng thời phản ứng với H+ theo đúng tỉ lệ mol
H+ + HCO3- → CO2↑ + H2O
2H+ + CO32- → CO2↑ + H2O
Phương pháp giải
+ Đặt ẩn số mol HCO3- và CO32- phản ứng lần lượt là a, b.
+ Biểu diễn hai ẩn theo số mol H+ và số mol khí CO2 thoát ra
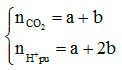
3. Hòa tan muối cacbonat hoặc muối hidrocacbonat bằng axit loãng
Phương trình:
H+ + HCO3- → CO2↑ + H2O
2H+ + CO32- → CO2↑ + H2O
Từ phương trình ta thấy:
nCO2 = nHCO3- = nCO32-
nH+ = nHCO3- = 2nCO32-
II. Ví dụ minh họa
Câu 1: Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch hỗn hợp gồm Na2CO3 0,2 M và NaHCO3 0,3M. Sau phản ứng thu được số mol CO2 là:
A. 0,01mol
B. 0,015 mol
C. 0,03 mol
D. 0,02 mol
Hướng dẫn
Ta có : nHCl = 0,03mol; nNa2CO3 = 0,02mol; nNaHCO3 = 0,03mol
Đầu tiên CO32- sẽ phản ứng với H+ trước:
CO32- + H+ → HCO3- (1)
Hết CO32- thì HCO3- mới phản ứng với H+
HCO3- + H+ → CO2 + H2O (2)
Nhận thấy: nNa2CO3 < nHCl < 2nNa2CO3 + nNaHCO3 nên phản ứng (1) xảy ra hoàn toàn, phản ứng (2) xảy ra một phần
Ta có: nH+ = nCO32- + nCO2
⇒ nCO2 = nHCl - nNa2CO3 = 0,03 - 0,02 = 0,01 mol
Đáp án A
Câu 2: Nhỏ từ từ 200ml dung dịch X ( K2CO3 1M và NaHCO3 0,5 M) vào 200ml dung dịch HCl 2M thì thể tích khí CO2 thu được (đktc) là:
A.4,48 lít
B. 8,96 lít
C. 5,376 lít
D. 4,48 lít
Hướng dẫn
Ta có: nK2CO3 = 0,2 mol; nNaHCO3 = 0,1 mol; nHCl = 0,4 mol
Phương trình phản ứng
H+ + HCO3- → CO2↑ + H2O
2H+ + CO32- → CO2↑ + H2O
Tỉ lệ 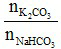 = 2 nên gọi nNaHCO3pu = a ⇒ nK2CO3 = 2a mol
= 2 nên gọi nNaHCO3pu = a ⇒ nK2CO3 = 2a mol
nH+ = nNaHCO3 + 2nK2CO3
⇒ 0,4 = a + 2.2a
⇒ a = 0,08 mol
⇒ nCO2 = nNaHCO3pu + nK2CO3 = 3a = 0,24 mol
⇒ VCO2 = 5,376 lít
Đáp án C
Câu 3: Cho 34,4 gam hỗn hợp Na2CO3, K2CO3, CaCO3 phản ứng với dung dịch HCl dư thu được dung dịch X và 6,72 lít CO2 (đktc). Cô cạn X thu được m gam muối khan. Giá trị của m là:
A.37,7 gam
B. 33,7 gam
C. 27,7 gam
D. 35,5 gam
Hướng dẫn
Phương trình hóa học
2H+ + CO32- → CO2 + H2O
nCO2 = 0,3 mol
⇒ nHCl = 2nCO2 = 0,06 mol; nH2O = nCO2 = 0,3 mol
Bảo toàn khối lượng cho phương trình ta được
mhh + mHCl = mm + mCO2 + mH2O
34,4 + 0,6.36,5 = mm + 0,3.44 + 0,13.18
⇒ mm = 37,7
Đáp án A
III. Bài tập tự luyện
Câu 1: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ 200 ml dung dịch HCl 1M vào 100 ml dung dịch X sinh ra V lít khí ở đktc. Giá trị của V là:
A. 4,48
B. 1,12
C. 2,24
D. 3,36
Câu 2: Nhỏ từ từ dd H2SO4 loãng vào dd X chứa 0,1 mol Na2CO3 và 0,2 mol NaHCO3 , thu được dd Y và 4,48 lít khí CO2 (đktc). Tính khối lượng kết tủa thu được khí cho dd Ba(OH)2 dư vào dd Y?
A. 54,65 gam
B. 46,60 gam
C. 19,70 gam
D. 66,30 gam
Câu 3: Hai cốc đựng dung dịch HCl đặt trên hai đĩa cân A, B . Cân ở trạng thái cân bằng. Cho 10 gam CaCO3 vào cốc A và 8,221 gam M2CO3 vào cốc B . Sau khi hai muối đã tan hết, cân trở lại vị trí cân bằng. Kim loại M là:
A. Li.
B. K.
C. Na.
D. Rb
Câu 4: Cho từ từ 150ml dung dịch HCl 1M vào 500ml dung dịch A gồm Na2CO3 và KHCO3 thì thu được 1,008 lít khí (đktc) và dung dịch Y. Cho dung dịch tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55g kết tủa. Nồng độ của Na2CO3 và KHCO3 trong dung dịch lần lượt là:
A. 0,2 và 0,4M
B. 0,18 và 0,26M
C. 0,21 và 0,37M
D. 0,21 và 0,18
Câu 5: Nhỏ từ từ từng giọt cho đến hết 550 ml dung dịch HCl 1M vào 100 ml dung dịch chứa hỗn hợp gồm Na2CO3 2M và KHCO3 2M sinh ra số mol CO2 là:
A. 0,12.
B. 0,35.
C. 0,20.
D. 0,18.
Câu 6: Nhỏ từ từ từng giọt dung dịch X chứa 0,3 mol K2CO3 và 0,6 mol NaHCO3 vào 500 ml dung dịch HC1 2M cho đến khi không còn khí thoát ra thì ngừng lại. Số mol khí CO2 sinh ra là:
A 0,750
B. 0,292.
C. 0,420.
D. 0,315.
Câu 7: Nhỏ từ từ từng giọt dung dịch X chứa 0,2 mol Na2CO3 và 0,6 mol KHCO3 vào 400 ml dung dịch HC1 2M cho đến khi không còn khí thoát ra thì ngừng lại. Thể tích khí CO2 (đktc) thoát ra là:
A. 14,336 lít
B. 10,08 lít
C. 9,408 lít
D. 7,84 lít
Câu 8: Cho 18,8 (g) hỗn hợp 2 muối cacbonat và hidrocacbonat của một kim loại kiềm , tác dụng với lượng dư dung dịch H2SO4 sau phản ứng thu được 3,36 lít khí (đktc). Xác định kim loại kiềm.
A. Li
B. Rb
C. K
D. Na
Câu 9: Thêm từ từ từng giọt 100 ml dung dịch chứa Na2CO3 1,2M và NaHCO3 0,6M vào 200 ml dung dịch HCl 1 M. Sau khi phản ứng hoàn toàn thu được dung dịch X. Cho dung dịch BaCl2 đến dư vào X thu được m gam kết tủa. Giá trị của m là:
A. 9,85
B. 7,88
C. 23,64
D.11,82
Câu 10: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt và khuấy đều cho đến hết 350 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí ( ở đktc). Giá trị của V là:
A. 3,36.
B. 1,12.
C. 4,48.
D. 2,24
Câu 11: Thêm từ từ 100 ml dung dịch HCl 0,5M vào 200 ml dung dịch Na2CO3 0,2M, thu được dung dịch X và V lít khí CO2 (đktc). Cho X tác dụng dung dịch Ba(OH)2 dư thu được m gam kết tủa. Giá trị của V và m lần lượt là:
A. 0,224 lít và 7,88 gam.
B. 0,560 lít và 7,88 gam.
C. 0,56 lít và 4,925 gam.
D. 0,224 lít và 5,91 gam.
Đáp án tham khảo
1.B |
2. A |
3. B |
4. D |
5. B |
6. A |
7. A |
8. C |
9. B |
10. C |
11. D |

