Lý thuyết Hóa 11 Bài 19 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 11 Bài 19 Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, ngắn gọn giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn tập để học tốt Hóa học 11 Bài 19.
Lý thuyết Hóa học 11 Bài 19 (sách mới cả ba sách)
Lời giải sgk Hóa học 11 Bài 19:
Lưu trữ: Lý thuyết Hóa 11 Bài 19: Luyện tập : Tính chất hóa học của cacbon, silic và các hợp chất của chúng (sách cũ)
I. Cacbon
1. Đơn chất
- Chất rắn, không tan trong nước, có 4 dạng thù hình: Kim cương, than chì, Fuleren, than vô định hình.
- Tính khử:
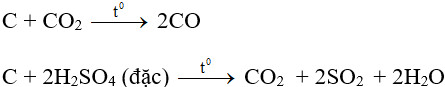
- Tính oxi hóa:
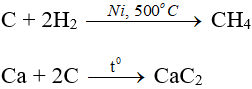
2. Oxit
a. Cacbon monooxit (CO)
- CO là oxit trung tính. Không màu, không mùi, nhẹ hơn không khí, ít tan trong nước, rất độc.
- Hoá tính quan trọng là tính khử ở nhiệt độ cao:
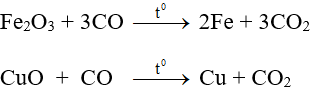
b. Cacbon đioxit (CO2)
- Khí không màu, không mùi, nặng hơn không khí, dễ hóa lỏng, không duy trì sự cháy và sự sống. Ở trạng thái rắn, CO2 gọi là nước đá khô.
- CO2 là một oxit axit.
CO2 + H2O → H2CO3
CO2 + NaOH → NaHCO3
- Tính oxi hóa:
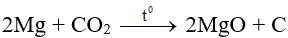
3. Axit cacbonic
- Là axit rất yếu và kém bền.
H2CO3 → CO2↑ + H2O
- Trong nước, điện li yếu:
H2CO3 → HCO3- + H+
HCO3- → CO32- + H+
4. Muối cacbonat
- Tính tan: Muối axit đa số dễ tan (trừ NaHCO3 hơi ít tan). Muối trung hoà không tan trong nước (trừ cacbonat của kim loại kiềm và amoni).
- Tác dụng với axit:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
- Tác dụng với dung dịch kiềm:
NaHCO3 + NaOH → Na2CO3 + H2O
- Thủy phân trong nước tạo môi trường kiềm:
CO32- + H2O → HCO3- + OH-
HCO3- + H2O → H2CO3 + OH-
- Dễ bị nhiệt phân hủy:
2NaHCO3 → Na2CO3 + CO2 + H2O
CaCO3 → CaO + CO2

II. Silic
1. Đơn chất
- Silic là chất rắn có 2 dạng thù hình: Si vô định hình, Si tinh thể.
- Si là phi kim yếu, tương đối trơ.
- Tính khử:
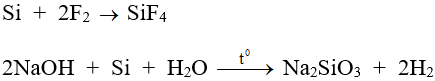
- Tính oxi hóa:
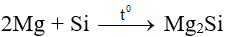
2. Silic đioxit (SiO2)
- Dạng tinh thể, không tan trong nước, nhiệt độ nóng chảy là 1713oC, tồn tại trong tự nhiên ở dạng cát và thạch anh.
- Tan chậm trong kiềm hoặc cacbonat kim loại kiềm nóng chảy:
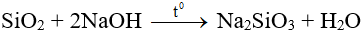
- Tác dụng với HF (dùng để khắc thủy tinh).
SiO2 + 4HF → SiF4 + 2H2O
3. Axit silixic (H2SiO3)
- Là chất keo, không tan trong nước. Khi sấy khô, axit silixic mất 1 phần nước tạo Silicagen (được dùng để hút ẩm):
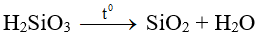
- H2SiO3 là axit rất yếu, yếu hơn H2CO3:
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
4. Muối silicat
- Muối silicat của kim loại kiềm tan trong nước và bị thủy phân mạnh tạo môi trường kiềm:
Na2SiO3 + 2H2O → 2NaOH + H2SiO3↓

