Lý thuyết so sánh tính chất của hiđrocacbon thơm với hiđrocacbon no và không no - Hoá học lớp 11
Lý thuyết so sánh tính chất của hiđrocacbon thơm với hiđrocacbon no và không no
Tài liệu Lý thuyết so sánh tính chất của hiđrocacbon thơm với hiđrocacbon no và không no Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về so sánh tính chất của hiđrocacbon thơm với hiđrocacbon no và không no từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

I. Hidrocacbon thơm
1. Đặc điểm cấu trúc và khả năng phản ứng
- Có vòng benzen. 6 nguyên tử Csp2 liên kết tạo thành lục giác đều.
- Các aren dễ thế, khó cộng, bền với chất oxi hóa.
2. Phản ứng thế
- Halogen thế vào nhân khi có Fe xúc tác:
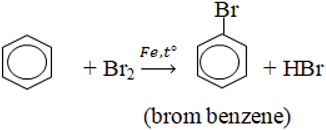
- Thế vào nhánh trong điều kiện chiếu sáng:
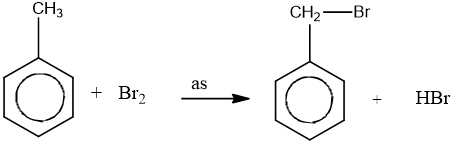
- Khi có sẵn nhóm thế ở nhân benzen, sản phẩm thế được định hưởng theo quy tắc sau:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2, …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
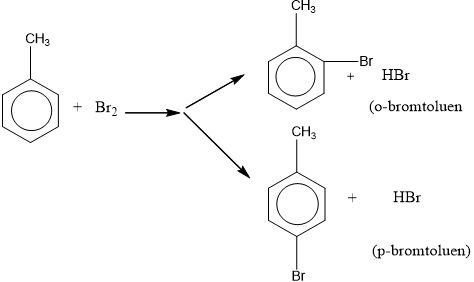
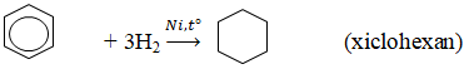
3. Phản ứng cộng
Đun nóng có xúc tác kim loại, aren cộng H2 tạo thành xicloankan.
4. Phản ứng oxi hóa
- Cháy tỏa nhiều nhiệt.
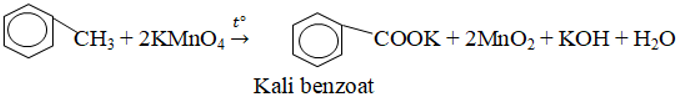
- Vòng benzen không bị oxi hóa, nhánh ankykl bị oxi hóa thành nhóm –COOH.
Ví dụ:
II. Hidrocacbon no
1. Đặc điểm cấu trúc và khả năng phản ứng
- Chỉ có các nguyên tử Csp3.
- Tương đối trơ ở điều kiện thường.
2. Phản ứng thế
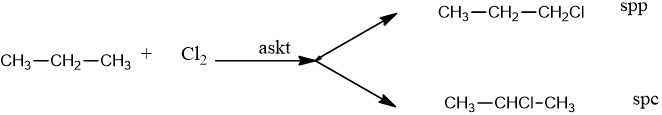
- Khi đun nóng hoặc chiếu sáng: Clo có thể thế ở nhiều vị trí khác nhau còn brom thế ở C bậc cao.
3. Phản ứng cộng
Không có phản ứng cộng (trừ xiclopropan và xiclobutan).
4. Phản ứng oxi hóa
- Cháy, tỏa nhiệt.
- Chỉ bị oxi hóa ở nhiệt độ cao hoặc có thêm xúc tác.
CnH2n+2 + O2 → nCO2 + (n + 1)H2O

III. Hidrocacbon không no
1. Đặc điểm cấu trúc và khả năng phản ứng
- Có C lai hóa sp2 hoặc sp.
- Trung tâm các phản ứng hóa học do các liên kết π kém bền.
- Phản ứng đặc trưng là phản ứng cộng.
2. Phản ứng thế
- Ở nhiệt độ cao, clo thế H ở C bên cạnh Csp2.
- Phản ứng thế của ank-1-in:
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
3. Phản ứng cộng
- Anken, ankin dễ cộng với H2, HX (X: OH-, halogen).
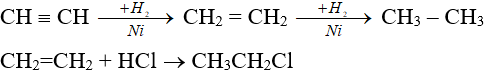
4. Phản ứng oxi hóa
- Cháy, tỏa nhiệt.
- Dễ bị oxi hóa bởi dd KMnO4 và các chất oxi hóa khác.
Ví dụ:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH

