Bài tập xác định chất khử, sản phẩm khử và cách giải
Bài tập xác định chất khử, sản phẩm khử và cách giải
Với Bài tập xác định chất khử, sản phẩm khử và cách giải Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập xác định chất khử, sản phẩm khử từ đó đạt điểm cao trong bài thi môn Hoá 11.

A. Lý thuyết ngắn gọn
- Axit nitric là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử, mà HNO3 có thể bị khử đến các sản phẩm khác nhau của nitơ.
- Các sản phẩm khử của N+5: NO2, NO, N2O, N2 và NH4NO3.
B. Phương pháp giải
Bước 1: Nếu tạo ra hỗn hợp khí, thiết lập biểu thức tính M trung bình của hh từ đó rút ra tỉ lệ số mol (hay tỉ lệ thể tích) giữa các khí sản phẩm.
Bước 2: Viết phương trình cho nhận electron của các chất oxi hóa khử.
Bước 3: Sử dụng bảo toàn electron tìm số mol các chất chưa biết.
Bước 4: Tính toán theo yêu cầu bài toán.
Chú ý: + Khí NO2 có màu nâu đỏ
+ Khí N2, NO, N2O không màu
+ Khí NO hóa nâu ngoài không khí
C. Ví dụ minh họa
Ví dụ 1: Hòa tan hoàn toàn 11,2 gam Fe vào HNO3 dư, thu được dung dịch A và 6,72 lít hỗn hợp khí B gồm NO và một khí X, với tỉ lệ thể tích là 1:1. Khí X là
A. NO2.
B. N2.
C. N2O.
D. NO.
Lời giải chi tiết
Số mol của hỗn hợp khí B: nB = 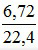 = 0,3 mol → nNO = nx = 0,15 mol .
= 0,3 mol → nNO = nx = 0,15 mol .
Giả sử số electron mà N+5 đã nhận vào để tạo ra sản phẩm X là n, ta có :
Quá trình oxi hóa :
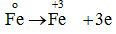
0,2 0,6 mol
Quá trình khử :
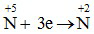
0,45 0,15 mol
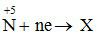
0,15n 0,15 mol
Áp dụng định luật bảo toàn electron ta có :
0,15n + 0,45 = 0,6 → n = 1
Vậy 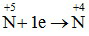
Kết luận: Khí X là NO2.
Chọn A.
Ví dụ 2: Hoà tan hoàn toàn 8,862 gam hỗn hợp gồm Al và Mg vào dung dịch HNO3 loãng, thu được dung dịch X và 3,136 lít (đktc) hỗn hợp Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Khối lượng của Y là 5,18 gam. Cho dung dịch NaOH (dư) vào X và đun nóng, không có khí mùi khai thoát ra. Phần trăm khối lượng của Al trong hỗn hợp ban đầu là
A. 19,53%.
B. 12,80%.
C. 10,52%.
D. 15,25%.
Lời giải chi tiết
Theo giả thiết Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Suy ra hỗn hợp Y có chứa NO và một khí còn lại là N2 hoặc N2O.
nY = 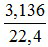 = 0,14 mol →
= 0,14 mol → 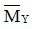 =
= 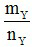 =
= 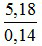 = 37 gam / mol → MNO <
= 37 gam / mol → MNO < 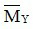 < MN2O .
< MN2O .
Vậy hỗn hợp Y gồm hai khí là NO và N2O. Đặt số mol của hai khí là x và y, ta có :
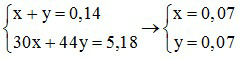
Gọi số mol của Al và Mg trong hỗn hợp là a và b, ta có :
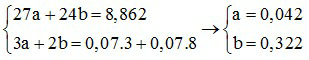
Phần trăm khối lượng của Al trong hỗn hợp ban đầu là :
%Al = 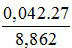 = 12,8%
= 12,8%
Chọn B.
Ví dụ 3: Hoà tan hoàn toàn 19,2 gam kim loại M trong dung dịch HNO3 dư thu được 8,96 lít (đktc) hỗn hợp khí gồm NO2 và NO có tỉ lệ thể tích 3:1. Kim loại M là
A. Fe.
B. Cu.
C. Al.
D. Zn.
Lời giải chi tiết
Số mol của hỗn hợp khí: nkhí = 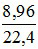 = 0,4 mol
= 0,4 mol
Vì VNO2 : VNO = 3:1 → nNO2 : nNO = 3:1 → nNO2 = 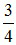 . 0,4 = 0,3 mol; nNO =
. 0,4 = 0,3 mol; nNO = 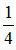 . 0,4 = 0,1 mol
. 0,4 = 0,1 mol
Gọi n là hóa trị của M. Quá trình nhường electron: M M+n + ne (1)
Áp dụng định luật bảo toàn electron ta có :
3.nNO + nNO2 = n.nM ⇔ 3.0,1 + 0,3 = n.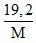 ⇔ M = 32n ⇒ n = 2 ; M = 64.
⇔ M = 32n ⇒ n = 2 ; M = 64.
Vậy kim loại M là Cu
Chọn B.

C. Bài tập tự luyện
Câu 1: Ngâm 10,1 gam hỗn hợp gồm Mg và Zn trong dung dịch HNO3 vừa đủ, sau phản ứng thu được 1,12 lít một chất khí (sản phẩm khử duy nhất) không màu, nhẹ hơn không khí. Thể tích HNO3 0,5M đã dùng là
A. 100 ml.
B. 250 ml.
C. 500 ml.
D. 1200 ml.
Câu 2: Hòa tan một hỗn hợp X gồm hai kim loại A và B trong dung dịch HNO3 loãng. Kết thúc phản ứng thu được hỗn hợp khí Y gồm 0,1 mol NO, 0,15 mol NO2 và 0,05 mol N2O. Biết rằng không có phản ứng tạo muối NH4NO3. Số mol HNO3 đã phản ứng là
A. 0,95.
B. 0,105.
C. 1,2.
D. 1,3.
Câu 3: Một hỗn hợp bột 2 kim loại Mg và R được chia thành 2 phần bằng nhau
- Phần 1 cho tác dụng với HNO3 dư thu được 1,68 lít N2O duy nhất.
- Phần 2 hòa tan trong 400 ml HNO3 loãng 0,7M, thu được V lít khí không màu, hóa nâu trong không khí. Giá trị của V (biết các thể tích khí đều đo ở đktc) là
A. 2,24 lít.
B. 1,68 lít.
C. 1,568 lít.
D. 4,48 lít.
Câu 4: Cho 3,06 gam một oxit kim loại M2On (M có hóa trị không đổi) tan hết trong dung dịch HNO3. Cô cạn dung dịch sau phản ứng thu được 12,78 gam muối khan. Kim loại M là
A. Mg.
B. Zn.
C. Al.
D. Ba.
Câu 5: Hòa tan 24 gam oxit cao nhất của một kim loại hóa trị III vào dung dịch HNO3. Cô cạn dung dịch sau phản ứng thu được 72,6 gam muối khan. Công thức của oxit là
A. Al2O3.
B. Fe2O3.
C. Cr2O3.
D. Fe3O4.
Câu 6: Hòa tan 3,6 gam một oxit kim loại trong dung dịch HNO3 đặc, nóng dư thu được dung dịch chứa 12,1 gam muối. Công thức hóa học của oxit là
A. CuO.
B. MgO.
C. FeO.
D. Fe2O3.
Câu 7: Hòa tan 2,32 gam muối cacbonat trong dung dịch HNO3 loãng, dư thu được dung dịch chứa 4,84 gam muối. Công thức hóa học của muối là
A. Na2CO3.
B. K2CO3.
C. BaCO3.
D. FeCO3.
Câu 8: Cho 0,8 mol Al tác dụng với dung dịch HNO3 thu được 0,3 mol khí X là sản phẩm khử duy nhất. Khí X là
A. NO2.
B. NO.
C. N2O.
D. N2.
Câu 9: Hòa tan hoàn toàn 6,5 gam kim loại Zn vào dung dịch HNO3 loãng, giả sử chỉ thu được 0,448 lít khí X duy nhất (đktc). Khí X là
A. N2.
B. NO.
C. N2O.
D. NO2.
Câu 10: Chia 38,6 gam hỗn hợp gồm Fe và kim loại M có hóa trị duy nhất thành 2 phần bằng nhau:
Phần 1: Tan vừa đủ trong 2 lít dung dịch thấy thoát ra 14,56 lít H2 (đktc).
Phần 2: Tan hoàn toàn trong dung dịch HNO3 loãng, nóng thấy thoát ra 11,2 lít khí NO duy nhất (đktc). Kim loại M là
A. Zn.
B. Mg.
C. Pb.
D. Al.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
D |
C |
C |
C |
B |
C |
D |
C |
A |
D |

