Các dạng toán P2O5 tác dụng với dung dịch kiềm và cách giải
Các dạng toán P2O5 tác dụng với dung dịch kiềm và cách giải
Với Các dạng toán P2O5 tác dụng với dung dịch kiềm và cách giải Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập P2O5 tác dụng với dung dịch kiềm từ đó đạt điểm cao trong bài thi môn Hoá 11.

A. Lý thuyết ngắn gọn
Bài toán P2O5 tác dụng với dung dịch kiềm tạo muối và nước, axit hoặc kiềm dư. Vì vậy để thuận lợi cho quá trình giải quyết bài toán ta có thể tư duy theo hướng sau:
P2O5 + 3H2O → H3PO4
H+ + OH- → H2O
Nghĩa là xét bài toán tác dụng với H2O sinh ra axit sau đó đến phản ứng trung hòa để làm đơn giản hóa vấn đề.
Xét T = 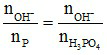
+ T < 1: tạo muối H2PO4- và H3PO4
+ T = 1: tạo muối H2PO4-
+ 1 < T < 2: tạo muối và H2PO4- và HPO42-
+ T = 2: tạo muối HPO42-
+ 2 < T < 3: tạo muối HPO42- và PO43-
+ T = 3: tạo muối PO43-
+ T > 3: tạo muối PO43- và OH-
B. Phương pháp giải
Tính tỉ lệ mol T = 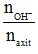 để từ đó xác định sản phẩm sinh ra trong phản ứng.
để từ đó xác định sản phẩm sinh ra trong phản ứng.
Viết phương trình phản ứng tạo ra các sản phẩm, đặt ẩn số mol cho các chất cần tính. Từ giả thiết suy mối quan hệ về số mol giữa các chất trong phản ứng và các chất sản phẩm, lập hệ phương trình, giải hệ phương trình. Từ đó suy ra kết quả mà đề yêu cầu.
C. Ví dụ minh họa
Ví dụ 1: Cho 14,2 gam P2O5 vào 200 gam dung dịch NaOH 8% thu được dung dịch A. Muối thu được và nồng độ % tương ứng là
A. Na2HPO4 và 11,2%.
B. Na3PO4 và 7,66%.
C. Na2HPO4 và 13,26%.
D. Na2HPO4; NaH2PO4 đều là 7,66%.
Lời giải chi tiết
Theo giả thiết ta có :
nP2O5 = 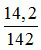 = 0,1 mol; nNaOH =
= 0,1 mol; nNaOH = 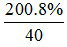 = 0,4 mol.
= 0,4 mol.
Khi cho P2O5 vào dung dịch kiềm thì trước tiên P2O5 phản ứng với nước sau đó mới phản ứng với dung dịch kiềm.
Phương trình phản ứng :
P2O5 + 3H2O → 2H3PO4 (1)
mol: 0,1 → 0,2
Tỉ lệ 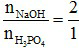 ⇒ Sản phẩm tạo thành là Na2HPO4.
⇒ Sản phẩm tạo thành là Na2HPO4.
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
mol: 0,4 → 0,2 → 0,2
Theo (1) ta thấy : nNa2HPO4 = 0,2 mol → mNa2HPO4 = 142.0,2 = 28,4 gam
Khối lượng dung dịch sau phản ứng là : m = mdd NaOH + mP2O5 = 200 + 14,2 = 214,2 mol
Nồng độ phần trăm của dung dịch Na2HPO4 là : C%Na2HPO4 = 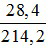 . 100 = 13,26%.
. 100 = 13,26%.
Chọn C.
Ví dụ 2: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
A. 1,76.
B. 2,13.
C. 4,46.
D. 2,84.
Lời giải chi tiết
P2O5 + 3H2O → 2H3PO4
x 3x 2x
P2O5 : x mol + 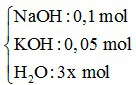 →
→ 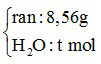
TH1: 3nH3PO4 ≤ nNaOH + nKOH
→ t = 6x
Bảo toàn khối lượng: 142x + 40.0,1 + 56.0,05 + 18.3x = 8,56 + 18.6x
→ x = 0,02
→ m = 0,02.142 = 2,84g
TH2: 3nH3PO4 > nNaOH + nKOH
→ t = 0,15
Bảo toàn khối lượng: 142x + 40.0,1 + 56.0,05 + 18.3x = 8,56 + 18.0,15
→ x = 0,05 (loại)
Chọn D.
Ví dụ 3: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 3m gam hỗn hợp chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
A. 1,76.
B. 2,13.
C. 4,46.
D. 2,85.
Lời giải chi tiết
P2O5 + 3H2O → 2H3PO4
x 3x 2x
P2O5 : x mol + 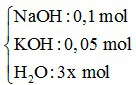 →
→ 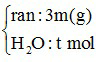
TH1: 3nH3PO4 ≤ nNaOH + nKOH
→ t = 6x
Bảo toàn khối lượng: 142x + 40.0,1 + 56.0,05 + 18.3x = 3.142x + 18.6x
→ x = 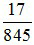
→ m = 2,857 g
TH2: 3nH3PO4 > nNaOH + nKOH
→ t = 0,15
Bảo toàn khối lượng: 142x + 40.0,1 + 56.0,05 + 18.3x = 3.142x + 18.0,15
→ x = 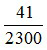 (loại)
(loại)
Chọn D.

C. Bài tập tự luyện
Câu 1: Cho 0,1 mol P2O5 vào dung dịch có chứa 0,35 mol KOH. Dung dịch thu được có chứa các chất:
A. K3PO4, K2HPO4.
B. K2HPO4 và KH2PO4.
C. K3PO4 và KOH.
D. H3PO4 và KH2PO4.
Câu 2: Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là
A. 25.
B. 50.
C. 75.
D. 100.
Câu 3: Cho 14,2 gam P2O5 vào 100 ml dung dịch chứa NaOH 1M và KOH 2M, thu được dung dịch X. Các anion có mặt trong dung dịch X là
A. PO43- và OH-
B. H2PO4- và HPO42-.
C. HPO42- và PO43-.
D. H2PO4- và PO43-.
Câu 4: Thêm 7,1gam P2O5 vào dung dịch chứa 150ml dung dịch KOH 1M, sau phản ứng hoàn toàn thu được :
A. KH2PO4 và K2HPO4
B. KH2PO4 và K3PO4
C. K3PO4 và K2HPO4
D. K3PO4 và KOH dư
Câu 5: Cho 500ml dung dịch chứa 7,28g KOH và 3,55g P2O5 . Tìm CM của các muối trong dung dịch thu được :
A. 0,05M và 0,06M
B. 0,04M và 0,06M
C. 0,04M và 0,08M
D. 0,06M và 0,09M
Câu 6: Cho 1,42g P2O5 vào dung dịch chứa 1,12g KOH . Tính khối lượng muối thu được :
A. 2,72g
B. 2,27g
C. 2,3g
D. 2,9g
Câu 7: Ôxi hoá hoàn toàn 6,2g photpho rồi hoà tan toàn bộ sản phẩm vào 25ml dd NaOH 25% ( d = 1,28g/ml) thì muối tạo thành sau pư là:
A. Na3PO4
B. Na2HPO4
C. NaH2PO4
D. Na3PO4 và Na2HPO4
Câu 8: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,12 gam hỗn hợp chất rắn khan. Giá trị của m là
A. 1,76.
B. 2,13.
C. 4,46.
D. 2,84.
Câu 9: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,15 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
A. 1,76.
B. 2,13.
C. 4,97.
D. 2,84.
Câu 10: Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,15 mol KOH, thu được dung dịch X. Cô cạn X, thu được 9,98 gam hỗn hợp chất rắn khan. Giá trị của m là
A. 1,76.
B. 2,13.
C. 4,26.
D. 2,84.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
B |
B |
B |
A |
B |
A |
C |
B |
C |
C |

