Lý thuyết Tính chất của Anđehit - Hoá học lớp 11
Lý thuyết Tính chất của Anđehit
Tài liệu Lý thuyết Tính chất của Anđehit Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về Tính chất của Anđehit từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

1. Đặc điểm cấu tạo, phân loại
a/ Cấu tạo
– Công thức tổng quát của anđehit là: R(CHO)m (m ≥ 1)
R có thể là H hoặc gốc hiđrocacbon và đặc biệt có hợp chất CHO-CHO, trong đó m = 2, R không có.
– Công thức của anđehit no đơn chức, mạch thẳng:
CnH2n+1CHO (n ≥ 0)
– Trong phân tử anđehit có nhóm chức -CHO liên kết với gốc R có thể no hoặc không no.
b/ Phân loại:
- Dựa vào đặc điểm cấu tạo gốc hidrocacbon:
+ Anđehit no
+ Anđehit không no
+ Anđehit thơm
- Dựa vào số nhóm –CHO
+ Anđehit đơn chức
+ Anđehit đa chức

CH2=CH-CH=O propenal: Anđehit không no
C6H5-CH=O benzanđehit: Anđehit thơm
O=CH-CH=O anđehit oxalic: Anđehit đa chức
2. Danh pháp
- Tên thay thế: Tên hiđrocacbon no tương ứng với mạch chính + al
- Tên thông thường: anđehit + tên axit tương ứng.
| Anđehit | Tên thay thế | Tên thông thường |
|
HCH=O CH3CH=O CH3CH2CH=O (CH3)2CHCH2CH=O CH3CH=CHCH=O |
metanal etanal propanal 3-metylbutanal but-2-en-1-al |
fomanđehit (anđehit fomic) axetanđehit (anđehit axetic) Propionanđehit (anđehit propionic) isovaleranđehit (anđehit isovaleric) crotonanđehit (anđehit crotonic) |
3. Tính chất vật lý
- Ở đk thường, các anđehit đầu dãy là các chất khí và tan rất tốt trong nước. Các anđehit tiếp theo là các chất lỏng hoặc rắn, độ tan giảm khi phân tử khối tăng.
– Nhiệt độ sôi của anđehit thấp hơn của rượu tương ứng vì giữa các phân tử anđehit không có liên kết hidro.
- Dung dịch bão hòa của anđehit fomic (37 - 40%) được gọi là fomalin.

4. Tính chất hóa học
a. Phản ứng cộng hiđro
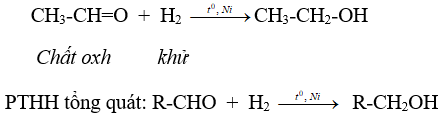
b. Phản ứng oxi hóa không hoàn toàn
HCHO + 2AgNO3 + H2O + 3NH3 −tº→ H-COONH4 + 2NH4NO3 + 2Ag
TQ: R-CH=O + 2AgNO3 + H2O + 3NH3 −tº→ R-COONH4 + 2NH4NO3 + 2Ag
Pư trên còn được gọi là pư tráng bạc.
Hay: 2CH3-CH=O + O2 −tº, xt→ 2CH3-COOH
2R-CHO + O2 −tº, xt→ 2R-COOH
Nhận xét: Anđehit vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
c. Tác dụng với brom và kali pemanganat
Anđehit rất dễ bị oxi hoá, nó làm mất màu nước brom, dung dịch kali pemanganat và bị oxi hoá thành axit cacboxylic, thí dụ :
RCH=O + Br2 + H2O → R-COOH + 2HBr
* Chú ý : Đối với HCHO phản ứng xảy ra như sau :
HCH=O + 2Br2 + H2O → CO2 + 4HBr
5. Điều chế, ứng dụng
a. Điều chế
- Từ ancol: Oxi hóa ancol bậc I.
R-CH2OH + CuO −tº→ R-CHO + H2O + Cu
- Fomanđehit được điều chế trong công nghiệp bằng cách oxi hoá metanol nhờ oxi không khí ở 600ºC - 700ºC với xúc tác là Cu hoặc Ag :
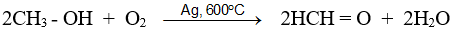
- Từ hiđrocacbon
CH4 + O2 −tº, xt→ HCHO + H2O
2CH2=CH2 + O2 −tº, xt→ 2CH3-CHO
CH CH + H2O −HgSO4→ CH3-CHO
b. Ứng dụng
- Fomanđehit :
Fomanđehit được dùng chủ yếu để sản xuất poli(phenolfomanđehit) (làm chất dẻo) và còn được dùng trong tổng hợp phẩm nhuộm, dược phẩm.
Dung dịch 37- 40% fomanđehit trong nước gọi là fomalin (còn gọi là fomol) được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng...
- Axetanđehit : Axetanđehit chủ yếu được dùng để sản xuất axit axetic.

