Lý thuyết Phân loại các chất điện li - Hoá học lớp 11
Lý thuyết Phân loại các chất điện li
Tài liệu Lý thuyết Phân loại các chất điện li Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về Phân loại các chất điện li từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

1. Độ điện li (α)
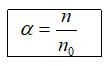
n: số phân tử hoà tan; n0: số phân tử ban đầu.
2. Chất điện li mạnh và chất điện li yếu
- Chất điện li mạnh: Là những chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion (α = 1, phương trình biểu diễn →).
Axit mạnh: HCl, HNO3, HClO4, H2SO4, HBr, HI, …
Bazơ mạnh: KOH, NaOH, Ba(OH)2, …
Muối: Hầu hết các muối (trừ HgCl2, Hg(CN)2 ).
- Chất điện li yếu: Là những chất khi tan trong nước, chỉ có một phần số phân tử hoà tan phân li ra ion (0 < α < 1, phương trình biểu diễn ⇋).
Axit yếu: CH3COOH, HClO, H2S, HF, H2SO3, H2CO3, ...
Bazơ yếu: Mg(OH)2, Al(OH)3, NH3, …
- Cân bằng điện li:
Ví dụ: HF → H+ + F-
* Ảnh hưởng của sự pha trộn đến độ điện li α: Khi pha loãng → α tăng.