Lý thuyết Hóa 11 Bài 1 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 11 Bài 1 Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, ngắn gọn giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn tập để học tốt Hóa học 11 Bài 1.
Lý thuyết Hóa học 11 Bài 1 (sách mới cả ba sách)
Lời giải sgk Hóa học 11 Bài 1:
(Kết nối tri thức) Giải Hóa 11 Bài 1: Khái niệm về cân bằng hoá học
(Chân trời sáng tạo) Giải Hóa 11 Bài 1: Khái niệm về cân bằng hóa học
Lưu trữ: Lý thuyết Hóa 11 Bài 1: Sự điện li (sách cũ)
I. Sự điện li
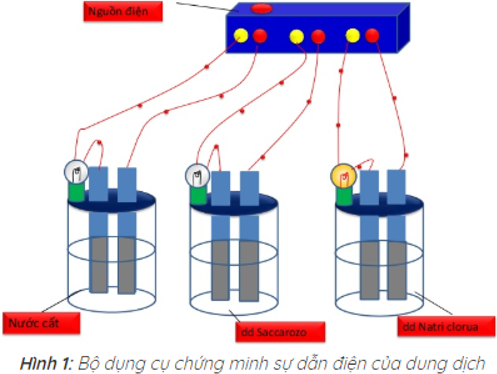
Kết quả thí nghiệm cho thấy chỉ có bóng đèn ở cốc đựng dung dịch NaCl sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện.
1. Nguyên nhân tính dẫn điện của các dung dịch axit, bazo và muối trong nước
- Các axit, bazo, muối khi tan trong nước phân li ra các ion làm cho dung dịch của chúng có tính dẫn điện.
- Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
- Những chất tan trong nước phân li ra ion gọi là chất điện li.
- Sự điện li được biểu diễn bằng phương trình điện li.
NaCl → Na+ + Cl-
HCl → H+ + Cl-
NaOH → Na+ + OH-
2. Kết luận
a. Sự điện li:là quá trình phân li các chất trong nước ra ion.
b. Chất điện li:là những chất tan trong nước phân li ra được ion. Dung dịch trong nước của các chất điện li sẽ dẫn điện được.
c. Phương trình điện li

|
AXIT → Cation H+ + Anion gốc axit BAZƠ → Cation KL + Anion OH- MUỐI → Cation KL (hoặc NH4+) + Anion gốc axit |
d. Các hệ quả:
- Trong một dung dịch, tổng ion dương = tổng ion âm.
- Tổng số gam các ion sẽ bằng tổng số gam các chất tan có trong dung dịch đó.

