Lý thuyết Khái quát Nhóm Nitơ - Hoá học lớp 11
Lý thuyết Khái quát Nhóm Nitơ
Tài liệu Lý thuyết Khái quát Nhóm Nitơ Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về Khái quát Nhóm Nitơ từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

I. Vị trí của nhóm nito trong bảng tuần hoàn
- Thuộc nhóm V trong bảng hệ thống tuần hoàn.
- Nhóm Nitơ gồm: Nitơ (N), Photpho (P), Asen(As), atimon (Sb) và bitmut (Bi).
- Chúng đều thuộc các nguyên tố p.
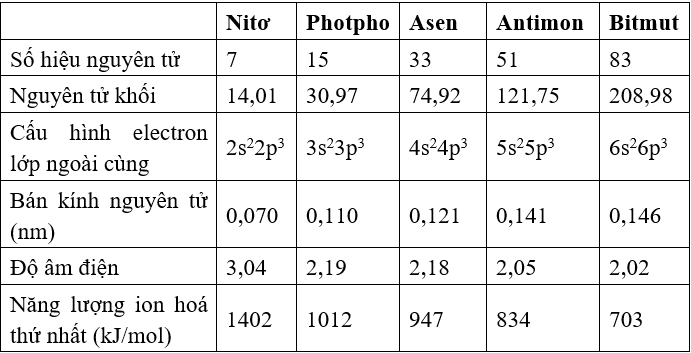
Một số tính chất của các nguyên tố nhóm nitơ
II. Tính chất chung các nguyên tố nhóm nitơ.
1. Cấu hình electron của nguyên tử
- Cấu hình lớp electron ngoài cùng: ns2np3.
- Ở trạng thái cơ bản, nguyên tử của các nguyên tố nhóm nitơ có 3 electron độc thân, do đó trong các hợp chất chúng có cộng hóa trị là 3.
- Đối với các nguyên tố: P, As, Sb ở trạng thái kích thích có 5 elctron độc thân nên trong hợp chất chúng có liên kết cộng hóa trị là 5 (trừ Nitơ).
2. Sự biến đổi tính chất của các đơn chất
a. Tính oxi hóa khử
+ Trong các hợp chất chúng có các số oxi hoá: -3, +3, +5. Riêng Nitơ còn có các số oxi hoá: +1 , +2 , +4.
+ Các nguyên tố nhóm Nitơ vừa có tính oxi hoá vừa có tính khử.
+ Khả năng oxi hóa giảm từ nitơ đến bitmut.
b. Tính kim loại - phi kim: Đi từ nitơ đến bitmut, tính phi kim của các nguyên tố giảm dần, đồng thời tính kim loại tăng dần.

3. Sự biến đổi tính chất của các hợp chất
a. Hợp chất với hiđro: RH3
+ Độ bền nhiệt của các hiđrua giảm từ NH3 đến BiH3.
+ Dung dịch của chúng không có tính axit .
b. Oxit và hiđroxit
+ Có số oxi hoá cao nhất với ôxi: +5.
+ Độ bền của hợp chất với số oxi hoá +5 giảm xuống.
+ Với N và P số oxi hóa +5 là đặc trưng.
+ Tính bazơ của các oxit và hiđroxit tăng còn tính axit giảm theo chiều từ nitơ đến bitmut.

