Lý thuyết Tính chất của Photpho và hợp chất của chúng - Hoá học lớp 11
Lý thuyết Tính chất của Photpho và hợp chất của chúng
Tài liệu Lý thuyết Tính chất của Photpho và hợp chất của chúng Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về Tính chất của Photpho và hợp chất của chúng từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

I. Đơn chất của photpho
Vì P có các số oxi hoá: -3, 0, +3, +5 nên P có thể thể hiện tính khử và tính oxi hoá.
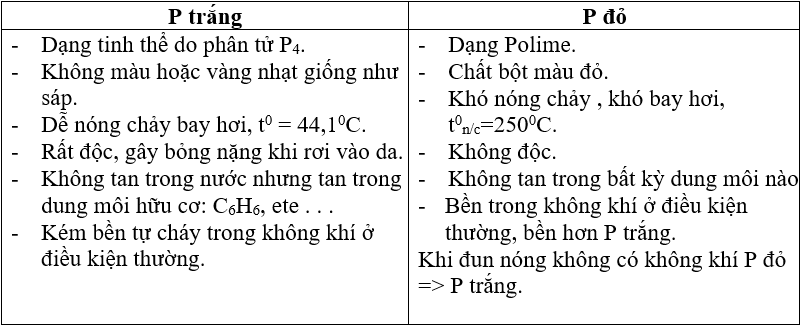
a. Tính oxi hoá: P0 → P-3
Tác dụng với một số kim loại hoạt động, tạo ra photphua kim loại.
Ví dụ:
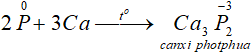
b. Tính khử: P0 → P+3, P0 → P+5
- Tác dụng với oxi: Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho:
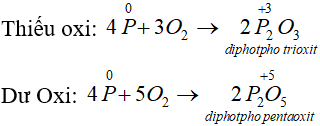
- Tác dụng với clo: Khi cho clo đi qua P nóng chảy, sẽ thu được các hợp chất photpho clorua:
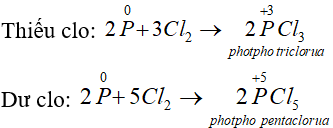
- Tác dụng với hợp chất:
6P + 5KClO3 → 3P2O5 + 5KCl
II. Axit photphoric
- Là axit 3 nấc, có độ mạnh trung bình.
- Không có tính oxi hóa.
- Tạo ra 3 loại muối khi tác dụng với dung dịch kiềm do dung dịch nó phân li ra 3 nấc:
H3PO4 ⇋ H+ + H2PO4- ⇒ k1 = 7, 6.10-3
H2PO4- ⇋ H+ + HPO42- ⇒ k2 = 6,2.10-8
HPO42- ⇋ H+ + PO43- ⇒ k3 = 4,4.10-13
⇒ nấc 1 > nấc 2 > nấc 3.
Ví dụ:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O

III. Muối photphat
1. Phân loại
Axít photphoric tạo ra 3 loại muối:
- Muối photphat trung hòa: Na3PO4, Ca3(PO4)2, …
- Muối đihidrophotphat: NaH2PO4, Ca(H2PO4)2, …
- Muối hidrophotphat: Na2HPO4, CaHPO4, …
2. Tính tan
- Muối dễ tan trong nước:
+ Tất cả các muối photphat của Na, K, NH4+.
+ Muối dihidrophotphat của các kim loại khác.
- Muối không tan hoặc ít tan trong nước:
+ Muối hidrophotphat và muối photphat trung hòa của các kim loại trừ của Na, K, NH4+.
3. Nhận biết ion photphat
Thuốc thử là bạc nitrat.
3Ag+ + PO43- → Ag3PO4↓ (màu vàng)

