Lý thuyết Hóa 11 Bài 13 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 11 Bài 13 Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, ngắn gọn giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn tập để học tốt Hóa học 11 Bài 13.
Lý thuyết Hóa học 11 Bài 13 (sách mới cả ba sách)
Lời giải sgk Hóa học 11 Bài 13:
(Kết nối tri thức) Giải Hóa 11 Bài 13: Cấu tạo hoá học hợp chất hữu cơ
(Chân trời sáng tạo) Giải Hóa 11 Bài 13: Hydrocarbon không no
Lưu trữ: Lý thuyết Hóa 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng (sách cũ)
I. Đơn chất nitơ
- Cấu hình electron nguyên tử: 1s22s22p3, nguyên tử có 3 electron độc thân. Các số oxi hóa: -3, 0, +1, +2, +3, +4, +5.
- Phân tử N2 có liên kết ba bền vững nên N2 khá trơ ở điều kiện thường.
- Có số oxi hóa trung gian nên N2 thể hiện cả tính khử và tính oxi hóa.
II. Hợp chất của nitơ
1. Amoniac
- Là chất khí tan rất nhiều trong nước.
- Tính bazo yếu:
+ Phản ứng với nước: NH3 + H2O ⇋ NH4+ + OH-.
+ Phản ứng với axit tạo muối amoni: NH3 + HCl → NH4Cl (amoni clorua).
+ Phản ứng với dung dịch muối:
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại.
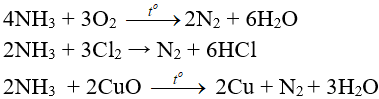
- Khả năng tạo phức chất tan:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
AgCl + 2NH3 → [Ag(NH3)2]Cl
2. Muối amoni
- Dễ tan trong nước, là chất điện li mạnh.
- Trong dung dịch, ion NH4+ là axit yếu: NH4+ + H2O ⇋ NH3 + H3O+.
- Tác dụng với dung dịch kiềm:
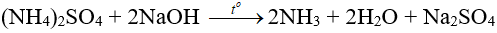
- Dễ bị nhiệt phân hủy:
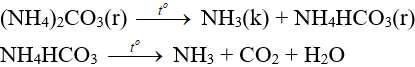
3. Axit nitric
- Là axit mạnh.
- Tính axit: HNO3 → H+ + NO3-.
- Tính oxi hóa mạnh: Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
+ Oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt)).
Tùy nồng độ axit và tính khử của kim loại sẽ cho sản phẩm khử khác nhau: NO2, NO, N2O, N2, NH4NO3.
Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O.
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O.
+ Oxi hóa được nhiều phi kim và các hợp chất có tính khử.
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
3FeO + 10HNO3(d) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(d) → 3S + 2NO + 4H2O

4. Muối nitrat
- Dễ tan trong nước, là chất điện li mạnh.
- Dễ bị nhiệt phân hủy:
2KNO3 → 2KNO2 + O2
2Cu(NO3)2 → 2CuO + 4NO2 + O2
2AgNO3 → 2Ag + 2NO2 + O2
- Nhận biết ion NO3-:
Sử dụng hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng:
3Cu + 8H+ + 2NO3- → 3Cu2+ (dd màu xanh) + 2NO↑ + 4H2O
2NO + O2 (không khí) → 2NO2 (màu nâu đỏ)

