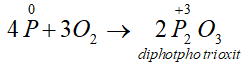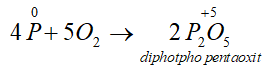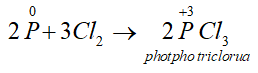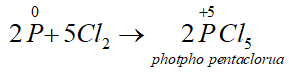Lý thuyết Hóa 11 Bài 10 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 11 Bài 10 Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, ngắn gọn giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn tập để học tốt Hóa học 11 Bài 10.
Lý thuyết Hóa học 11 Bài 10 (sách mới cả ba sách)
Lời giải sgk Hóa học 11 Bài 10:
(Kết nối tri thức) Giải Hóa 11 Bài 10: Hợp chất hữu cơ và hoá học hữu cơ
(Cánh diều) Giải Hóa 11 Bài 10: Công thức phân tử hợp chất hữu cơ
(Chân trời sáng tạo) Giải Hóa 11 Bài 10: Công thức phân tử hợp chất hữu cơ
Lưu trữ: Lý thuyết Hóa 11 Bài 10: Photpho (sách cũ)
I. Tính chất vật lí
a. P trắng
- Dạng tinh thể do phân tử P4.
- Không màu hoặc vàng nhạt giống như sáp.
- Dễ nóng chảy bay hơi, tº = 44,1ºC.
- Rất độc, gây bỏng nặng khi rơi vào da.
- Không tan trong nước nhưng tan trong dung môi hữu cơ: C6H6, ete...
- Oxi hoá chậm ⇒ phát sáng.
- Kém bền tự cháy trong không khí ở điều kiện thường.
b. P đỏ
- Dạng Polime.
- Chất bột màu đỏ.
- Khó nóng chảy, khó bay hơi, tºn/c = 250ºC.
- Không độc.
- Không tan trong bất kỳ dung môi nào.
- Không độc.
- Không oxi hoá chậm ⇒ không phát sáng.
- Bền trong không khí ở điều kiện thường, bền hơn P trắng.
- Khi đun nóng không có không khí P đỏ ⇒ P trắng.
Vì P có các số oxi hoá: -3, 0, +3, +5. Có thể thể hiện tính khử và tính oxi hoá.

II. Tính chất hóa học
- Độ âm điện P < N.
- Nhưng P hoạt động hóa học hơn N2 vì liên kết N ≡ N bền vững.
- P trắng hoạt động hơn P đỏ.
a. Tính oxi hoá: tác dụng với một số kim loại hoạt động, tạo ra photphua kim loại.
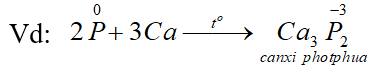
b. Tính khử: tác dụng với các phi kim hoạt động như oxi, halozen, lưu huỳnh … cũng như với các chất oxi hóa mạnh khác
- Tác dụng với oxi: Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho:
Thiếu oxi:
Dư Oxi:
- Tác dụng với clo: Khi cho clo đi qua P nóng chảy, sẽ thu được các hợp chất photpho clorua:
Thiếu clo:
Dư clo:
Tác dụng với hợp chất: P dễ dàng tác dụng với các hợp chất có tính oxi hóa mạnh như HNO3 đặc, KClO3, KNO3, K2Cr2O7, …
6P + 5KClO3 → 3P2O5 + 5KCl
III. Trạng thái tự nhiên
- P khá hoạt động về mặt hóa học nên không gặp P ở dạng tự do trong tự nhiên.
- Phần lớn P tồn tại ở dạng muối của axit photphoric. Hai khoáng vật chính của photpho là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Sản xuất axit photphoric, sản xuất diêm.
- Ngoài ra được sử dụng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói, ....
2. Điều chế
Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc khoảng 1200ºC trong lò điện:
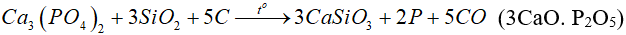
Hơi photpho thoát ra được ngưng tụ khi làm lạnh, thu được photpho trắng ở dạng rắn.