Lý thuyết Hóa 11 (hay, chi tiết) | Kiến thức trọng tâm Hóa học 11
Haylamdo biên soạn và sưu tầm lý thuyết Hóa 11 sách mới Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, chi tiết giúp học sinh lớp 11 nắm vững kiến thức trọng tâm Hóa học 11 từ đó học tốt môn Hóa 11.
Tóm tắt Lý thuyết Hóa 11 (hay, chi tiết)
Lý thuyết Hóa 11 Kết nối tri thức
Lý thuyết Hóa 11 Chân trời sáng tạo
Nội dung đang được cập nhật ...
Lý thuyết Hóa 11 Cánh diều
Nội dung đang được cập nhật ...
Lưu trữ: Tổng hợp Lý thuyết Hóa 11 (sách cũ)
- Tổng hợp Lý thuyết chương Sự điện li
- Tổng hợp Lý thuyết chương Nhóm Nitơ, Photpho
- Tổng hợp Lý thuyết chương Nhóm Cacbon, Silic
- Tổng hợp Lý thuyết chương Đại cương về hóa học hữu cơ
- Tổng hợp Lý thuyết chương Hidrocacbon no
- Tổng hợp Lý thuyết chương Hidrocacbon không no
- Tổng hợp Lý thuyết chương Hidrocacbon thơm
- Tổng hợp Lý thuyết chương Dẫn xuất Halogen, Ancol, Phenol
- Tổng hợp Lý thuyết chương Anđehit, Xeton, Axit Cacboxylic
Chương 1: Sự điện li
Lý thuyết Sự điện li
I. Sự điện li
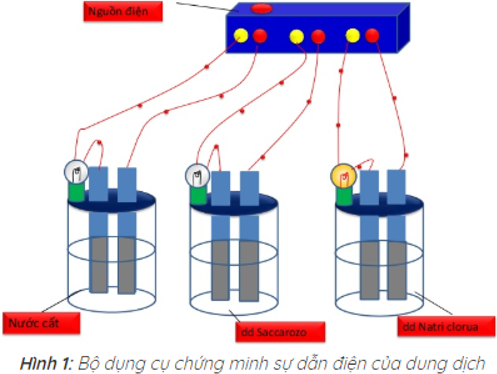
Kết quả thí nghiệm cho thấy chỉ có bóng đèn ở cốc đựng dung dịch NaCl sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện.
1. Nguyên nhân tính dẫn điện của các dung dịch axit, bazo và muối trong nước
- Các axit, bazo, muối khi tan trong nước phân li ra các ion làm cho dung dịch của chúng có tính dẫn điện.
- Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
- Những chất tan trong nước phân li ra ion gọi là chất điện li.
- Sự điện li được biểu diễn bằng phương trình điện li.
NaCl → Na+ + Cl-
HCl → H+ + Cl-
NaOH → Na+ + OH-
2. Kết luận
a. Sự điện li:là quá trình phân li các chất trong nước ra ion.
b. Chất điện li:là những chất tan trong nước phân li ra được ion. Dung dịch trong nước của các chất điện li sẽ dẫn điện được.
c. Phương trình điện li
|
AXIT → Cation H+ + Anion gốc axit BAZƠ → Cation KL + Anion OH- MUỐI → Cation KL (hoặc NH4+) + Anion gốc axit |
d. Các hệ quả:
- Trong một dung dịch, tổng ion dương = tổng ion âm.
- Tổng số gam các ion sẽ bằng tổng số gam các chất tan có trong dung dịch đó.
Lý thuyết Axit, bazơ, muối
1. Axit, bazo, muối
a. Axit và bazơ theo thuyết Areniut
* Axit:Là chất khi tan trong nước phân li cho ion H+.
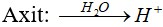
* Bazơ:Là chất khi tan trong nước phân li cho ion OH-.
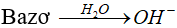
* Axit nhiều nấc:Những axit khi tan trong nước phân li nhiều nấc cho ion H+.
Ví dụ:
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → H+ + PO43-
* Bazơ nhiều nấc:Những bazơ khi tan trong nước phân li nhiều nấc cho ion OH-.
Ví dụ:
Mg(OH)2 → Mg(OH)+ + OH-
Mg(OH)+ → Mg2+ + OH-
* Hiđroxit lưỡng tính: Là những hiđrôxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
A(OH)n: Zn(OH)2, Pb(OH)2, Sn(OH)2, Cu(OH)2, Al(OH)3, Cr(OH)3.
Phân li theo kiểu bazơ:
Ví dụ:
Zn(OH)2 → Zn2+ + 2OH-
Al(OH)3 → Al3+ + 3OH-
Phân li theo kiểu axit:
Ví dụ:
Zn(OH)2 → ZnO22- + 2H+
Al(OH)3 → AlO2- + H3O+
b. Axit, bazơ theo Bronsted
|
Axit là chất (hoặc ion) nhường proton H+ Bazơ là chất (hoặc ion) nhận proton H+ |
Chú ý: Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4, …) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb).
Ví dụ:
CH3COOH → CH3COO- + H+
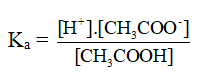
CH3COOH + H2O → CH3COO- + H+
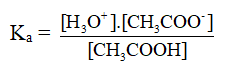
NH3 + H2O → NH4+ + OH-
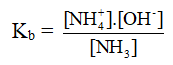
- Vì nồng độ của nước được coi như hằng số nên ta có thể bỏ qua nồng độ của nước trong biểu thức xác định hằng số phân li axit, hay bazơ.
- Đối với bazơ nhiều nấc sẽ có nhiều hằng số phân li ở các nấc khác nhau.
- Hằng số phân li bazơ chỉ phụ thuôc vào bản chất bazơ và nhiệt độ. Nếu giá trị Kb càng nhỏ thì lực bazơ của nó càng yếu (hay tính bazơ càng yếu).
- Mối liên hệ giữa hằng số Ka và Kb.
Ka = 10-14/Kb hay Ka. Kb = 10-14.
Muối axit, muối trung hoà
+ Muối axit: Muối có anion gốc axit còn khả năng phân li cho ion H+.
Ví dụ: NaHCO3; NaH2PO4; NaHSO4; ...
+ Muối trung hoà: Muối có anion gốc axit không còn khả năng phân li cho ion H+.
Ví dụ: NaCl , (NH4)2SO4, Na2CO3, ...
+ Muối bazo: Muối có nhóm –OH có thể thay thế bằng gốc axit.
Ví dụ: Mg(OH)Cl; Fe(OH)2Cl, ...
+ Ngoài ra còn kể đến một số muối kép như: HCl.NaCl; KCl.MgCl.6H2O; K2SO4.Al2(SO4)3, ...
+ Muối phức: [Ag(NH3)2]Cl; [Cu(NH3)4]SO4, ...
Sự điện li của muối trong nước: Hầu hết các muối (kể cả muối kép) khi tan trong nước phân li hoàn toàn thành cation kim loại (NH4+) và anion gốc axit.
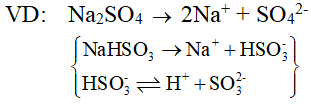
Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit - bazơ
I. Nước là chất điện li yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu.
- Phương trình điện li:
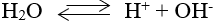
2. Tích số ion của nước
- Ở 25oC, hằng số KH2O gọi là tích số ion của nước:
KH2O = [H+].[OH-] = 10-14
⇒ [H+] = [OH-] = 10-7.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
Là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7 M.
b. Môi trường kiềm
Là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7 M.
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH

2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
Bảng màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
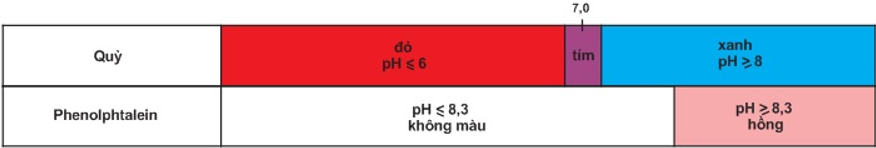
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng. Dùng băng giấy tẩm dung dịch hỗn hợp này có thể xác định được gần đúng giá trị pH của dung dịch.
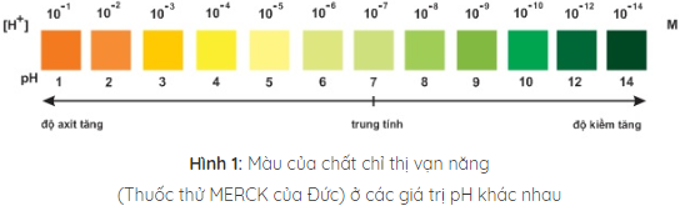
3. Bảng công thức pH trong các môi trường
| CÔNG THỨC | MÔI TRƯỜNG |
|
pH = - lg[H+] pOH = - lg[OH-] [H+].[OH-] = 10-14 pH + pOH = 14 pH = a [H+] = 10-a pOH = b [OH-] = 10-b |
pH < 7 → Môi trường axít pH > 7 → Môi trường bazơ pH = 7 → Môi trường trung tính [H+] càng lớn ↔ Giá trị pH càng bé [OH-] càng lớn ↔ Giá trị pH càng lớn |
....................................
....................................
....................................

