100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (nâng cao) - Hoá học lớp 12
100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (nâng cao)
Với 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (nâng cao) Hoá học lớp 12 tổng hợp 100 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Kim loại kiềm, Kim loại kiềm thổ, Nhôm từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Câu 1. Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be B. Mg
C. Ca. D. Ba
Lời giải:
Gọi M là kim loại nhóm II, số mol là x
M (x) + 2HCl → MCl2 x(mol) + H2
Theo đề bài ra ta có hệ phương trình:
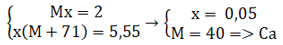
→ Đáp án C
Câu 2. Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (đktc). Tìm tên hai kim loại đem dùng.
A. Ca và Mg B. Ca và Sr.
C. Mg và Ba D. Ba và Sr
Lời giải:
Gọi R là kim loại hai chu kì liên tiếp của nhóm IIA.
Ta có: nH2 = 0,672/22,4 = 0,03(mol)
Phương trình hóa học:
R (0,03) + 2HCl → RCl2 + H2 (0,03) (1)
⇒ MR = 1,67/0,03 = 55,667
⇒ 2 kim loại cần tìm là: Ca và Sr.
→ Đáp án B
Câu 3. Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g B. 56,1 g
C. 65,1g D. 51,6 g
Lời giải:
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
→ Đáp án B
Câu 4. Nhận biết Al, Mg, Al2O3 dùng:
A. Dung dịch HCl. B. Dung dịch HNO3.
C. Dung dịch CuCl2. D. Dung dịch NaOH.
Lời giải:
Lần lượt cho NaOH vào các mẫu thử. Chất rắn tan có khí thoát ra là Al, tan không có khí là Al2O3, không tan là MgO.
Phương trình hóa học:
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Al2O3 + 2NaOH → NaAlO2 + H2O
→ Đáp án D
Câu 5. Cho 10g một kim loại kiềm thổ tác dụng với H2O, thu được 6,11 lít khí H2 (ở 25oC và 1 atm). Hãy xác định tên của kim loại kiềm thổ đã dùng.
A. Mg B. Ca
C. Ba D. Be
Lời giải:
Ta có:
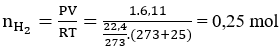
Gọi A là kí hiệu, nguyên tử khối của kim loại.
A (10/A) + 2H2O → A(OH)2 + H2 (0,25)
⇒ 10/A= 0,24 → A = 40 (Ca)
→ Đáp án B
Câu 6. Hỗn hợp X gồm M2CO3, MHCO3, MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 gam chất rắn. Cũng đem 20,29 gam hỗn hợp X tác dụng hết với 500ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y.Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 gam kết tủa. Kim loại M là
A. Na B. Li
C. K D. Cs
Lời giải:
+) Nung X:
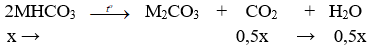
⇒ Δm giảm = mCO2 + mH2O ⇒ 31x = 20,29 – 18,74 ⇒ x = 0,05 mol
+) X + HCl:
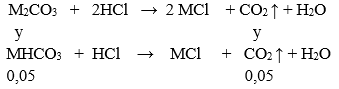
⇒ nCO2 = y + 0,05 = 0,15 ⇒ y = 0, 1 mol
Dung dịch Y chứa MCl và HCl dư. Gọi z là số mol MCl có trong X ta có:
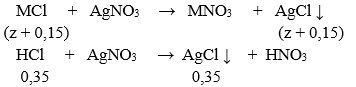
⇒ nAgCl = 0,5 + z = 74,62/143,5 = 0,52 ⇒ z = 0,02
⇒(2M + 60).0,1 + (M + 61). 0,05 + (M + 35,5).0,02 = 20,29 ⇒ M = 39(K)
→ Đáp án C
Câu 7. Hòa tan hòa toàn 6,645g hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì liên tiếp nhau vào nước được dd X. Cho toàn bộ dd X tác dụng hoàn toàn với dd AgNO3 (dư), thu được 18,655g kết tủa. Hai kim loại kiềm trên là
A. Na, K B. Rb, Cs
C. Li , Na D. K , Rb
Lời giải:
MCl (0,13) + AgNO3 → AgCl (0,13) + MNO3
nAgCl = 18,655/143,5 = 0,13
⇒ M = (6,645/0,13) - 35,5 = 15,61
⇒ M1 = 9 (Li) < 15,61 < M2 = 23(Na)
→ Đáp án C
Câu 8. Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. Giấy quỳ tím B. Zn
C. Al D. BaCO3
Lời giải:
Dùng quì tím: chỉ nhận biết được dung dịch KOH.
- Dùng Zn, Al: không nhận biết được.
- Dùng BaCO3:
+ Cho vào dung dịch KOH không có hiện tượng
+ Cho vào dung dịch HCl có khí bay lên
+ Cho vào dung dịch H2SO4: có khí bay lên và kết tủa trắng
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
→ Đáp án D
Câu 9. Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A. Natri , magie B. Liti và beri
C. Liti và beri D. Kali , bari
Lời giải:
A (x) + HCl → ACl + 1/2 H2 (0,5 x)
B (y) + 2HCl → BCl2 + H2 (y)↑
⇒ nH2 = 0,5x + y = 0,25 ⇒ 0,25 < x + y < 0,5
⇒ 7,1/0,5 < M < 7,1/0,25 ⇒ 14,2 < M < 28,4
Chỉ có cặp nghiệm A = 23 (Na ), B = 24 (Mg) thỏa mãn
→ Đáp án A
Câu 10. Hòa tan hết 10,1 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước thu được 3 lít dung dịch có pH = 13. Hai kim loại kiềm đó là:
A. Na, K B. Li, Na
C. K, Rb D. Rb, Cs
Lời giải:
pH = 13 ⇒ [OH-] = 0,1M ⇒ nOH- = 0,3 mol
M (0,3 ) + H2O → M+ + OH- (0,3) + 1/2 H2
⇒ 23(Na) < M = 10,1/0,3 = 33,67 < 39 (K)
→ Đáp án A
Câu 11. Cho các chất rắn đựng trong các lọ mất nhãn BaO, MgO, Al2O3. Chỉ dùng một hóa chất nào sau đây có thể nhận biết được 3 chất trên?
A. H2O B. HCl
C. H2SO4 D. Fe(OH)2
Lời giải:
- Hòa tan lần lượt các mẫu vào nước, mẫu chất rắn nào tan là BaO
PTHH: BaO + H2O → Ba(OH)2
- Lấy Ba(OH)2 cho vào 2 chất rắn, chất nào tan ra là Al2O3 còn lại là MgO
PTHH: Ba(OH)2 + Al2O3 + H2O → Ba(AlO2)2 + 2H2O
→ Đáp án A
Câu 12. Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là:
A. Mg B. Al
C. Ca D. Na
Lời giải:
M (1,25x) → Mn+ + ne (1,25nx)
Zn (x) → Zn2+ + 2e (2x)
Cl2 (0,2) + 2e (0,4) → 2Cl-
2H+ + 2e (0,5) → H2 (0,25)
Bảo toàn e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M + 65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
→ Đáp án A
Câu 13. Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
A. K B. Na
C. Ba D. Ca
Lời giải:
M: x mol; M2On: y mol
M (x) + nH2O → M(OH)n (x) + n/2 H2 (xn/2)
⇒ nx/2 = 0,01 ⇒ nx = 0,02
M2On (y) + nH2O → 2M(OH)n (2y)
⇒ nM(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01, y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
→ Đáp án B
Câu 14. Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2 , NaOH, Na2 CO3, KHSO4, Na2 SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
A. 4 B. 7
C. 5 D. 6
Lời giải:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 15. Có 4 chất rắn đựng trong 4 lọ riêng biệt không nhãn: Na2CO3, CaCO3, Na2SO4 và CaSO4.H2O. Chỉ dùng cặp hóa chất nào sau đây có thể nhận được cả 4 chất trên?
A. H2O và Na2CO3.
B. H2O và HCl.
C. H2SO4 và BaCl2.
D. H2O và KCl.
Lời giải:
Hòa tan vào nước ta chia làm 2 nhóm. Sau đó dùng HCl để nhận biết chất phản ứng với HCl tạo khí là muối CO32-
Nhóm 1: Na2SO4 và Na2CO3
Nhóm 2: CaCO3 và CaSO4.H2O
PT: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chú ý: Muối cacbonat giải phóng khí CO2 khi tác dụng với axit.
→ Đáp án B
Câu 16. Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 5,8 g B. 6,5 g
C. 4,2 g D. 6,3 g
Lời giải:
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 -to→ RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
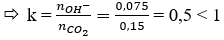
→ tạo ra muối NaHCO3 và CO2 dư.
CO2 + NaOH (0,075) → NaHCO3 (0,075)
→ mmuối = 0,075.84 = 6,3(g)
→ Đáp án D
Câu 17. Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
A. 2,65l B. 2,24l
C. 1,12l D. 3,2 l
Lời giải:
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3. 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+ TH2: Al3+ hết → tạo
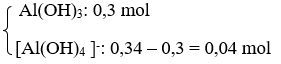
→ Số mol OH- = 3. 0,3 + 4. 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax
→ Đáp án A
Câu 18. Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là:
A. 2,88 B. 4,32
C. 5,04 D. 2,16
Lời giải:
nFe = 3,36/56 = 0,06 mol
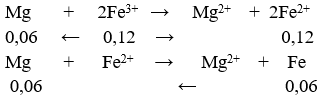
→ m = 0,12. 24 = 2,88 gam
→ Đáp án A
Câu 19. Sau khi thực hiện phản ứng nhiệt nhôm với Fe3O4 thu được chất rắn A và nhận thấy khối lượng nhiệt nhôm tăng 0,96(g). Cho A tác dụng với dung dịch NaOH dư thu được 0,672 lít khí (đktc), (giả sử các phản ứng đều xảy ra với hiệu suất 100%). Khối lượng của A là:
A. 1,08g B. 1,62g
C. 2,1g D. 5,1g
Lời giải:
8Al + 3Fe3O4 -to→ 9Fe + 4Al2O3
Khối lượng nhôm tăng chính là khối lượng của nguyên tố oxi.
nO (trong Al2O3) = 0,96/16 =0,06 mol
nAl2O3 = 1/3. nO = 0,06/3 = 0,02 mol
Theo phản ứng: nFe = 9/4. nAl2O3 = (9/4). 0,02 = 0,045 mol
Hỗn hợp A sau phản ứng tác dụng với NaOH dư tạo ra khí H2. Chứng tỏ sau phản ứng nhiệt nhôm, nhôm còn dư:
Ta có: nH2 = 0,672/22,4 = 0,03 mol
Al (0,02) + NaOH + H2O → NaAlO2 + 3/2 H2 (0,03)
Vậy: mA = mAl dư + mAl2O3 = 0,02.27 + 0,045.56 + 0,02.102 = 5,1 (g)
→ Đáp án D
Câu 20. Khối lượng riêng của canxi kim loại là 1,55g/cm3. Giả thiết cho rằng trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể , phần còn lại là khe rỗng. Bán kính nguyên tử canxi theo lý thuyết là :
A. 0,185 nm B. 0,196 nm
C. 0,155 nm D. 0,168 nm
Lời giải:
d = mNT/VTT = 0,74. mNT/VTT
⇒ VTT = 4πr3/3 = 0,74. mNT/d = (0,74.40)/(6,02.1023.2,55)
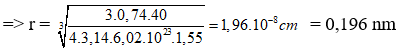
→ Đáp án B
Câu 21. Hòa tan 7,8 gam một kim loại R vào nước thu được 100ml dung dịch D và 2,24 lít H2 (đktc). Vậy R và nồng độ mol của dung dịch D là:
A. Na và 1M. B. K và 2M.
C. K và 1M. D. K và 1,5M.
Lời giải:
Số mol H2 = 0,1 mol
Phương trình phản ứng: 2M (0,2) + 2H2O (0,2) → 2MOH + H2 (0,1)
Tính được M = m: n = 7,8: 0,2 = 39. Vậy kim loại cần tìm là K.
CM = 0,2/0,1 = 2M
→ Đáp án B
Câu 22. Cho m gam NaOH vào 2 lít dd NaHCO3 nồng độ a mol/l, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dd BaCl2 (dư ) thu được 11,82g kết tủa . Mặt khác , cho 1 lít dd X vào dd CaCl2(dư) rồi đun nóng. Sau khi kết thúc các phản ứng thu được 7,0g kết tủa. Giá trị của a, m tương ứng là:
A. 0,04 và 4,8 B. 0,07 và 3,2
C. 0,08 và 4,8 D. 0,14 và 2,4
Lời giải:
+) 1/2 X + BaCl2:
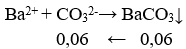
+) 1/2 X + CaCl2:
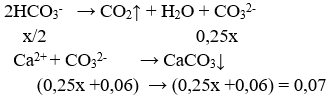
⇒ x = 0,04 mol
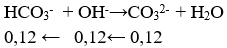
⇒ tổng nHCO3- = 0,12 + 0,04 = 0,06 mol
⇒ a = 0,08 mol/l
⇒ m = 40.0,12 = 4,8 g
→ Đáp án C
Câu 23. Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào m gam dung dịch hỗn hợp chứa 0,05 mol NaOH; 0,05mol KOH; 0,05 mol Ba(OH)2. Dung dịch sau phản ứng có khối lượng ?
A. (m – 11,65) gam
B. (m + 6,6) gam
C. (m – 5,05) gam
D. (m – 3,25) gam
Lời giải:
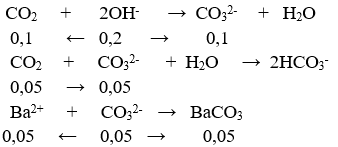
⇒ mdd = m + 0,15.44 – 197.0,05 = (m – 3,25) gam
→ Đáp án D
Câu 24. Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Giá trị của X là:
A. 1,0 B. 1,4
C. 1,2 D. 1,6
Lời giải:
Ta có: nCO2 = 0,1 mol; nBaCO3 = 11,82/197 = 0,06 mol; nK2CO3 = 0,02 mol
Khi sục CO2 vào dung dịch hỗn hợp K2CO3 và KOH, giả sử chỉ xảy ra phản ứng:
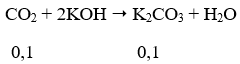
⇒ nK2CO3 (trong dd) = 0,1 + 0,02 = 0,12 mol
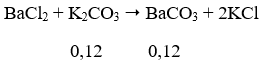
Ta thấy n↓ = 0,12 → n↓ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3
Áp dụng định luật bảo toàn nguyên tố C ta có:
nC(trong CO2) + nC(trong K2CO3) = nC(trong BaCO3) + nC(trong KHCO3)
⇒ 0,1 + 0,02 = 0,06 + x (x là số mol BaCO3)
⇒ x = 0,06

→ nKOH = 0,14 mol → [KOH] = 0,14/0,1 = 1,4M
→ Đáp án B
Câu 25. Cho 0,96 gam bột Cu và dung dịch HNO3 đặc, nóng (dư) sau phản ứng hấp thụ hết khí thoát ra vào 0,4 lít dung dịch KOH 0,1M thu được 0,4 lít dung dịch X. Dung dịch X có giá trị pH là( bỏ qua sự điện li của H2O) và phản ứng của các muối)
A. 12,4 B. 13,4
C. 1,6 D. 2,6
Lời giải:
nNO2 = 2nCu = 0,03 mol
2NO2 (0,03) + 2NaOH (0,03) → NaNO2 + NaNO3 + H2O
⇒ nNaOH còn = 0,04 - 0,03 = 0,01 mol
⇒ [OH-] = 0,01/0,04 = 0,025 M
⇒ pH = 14 + lg 0,025 = 12,4
→ Đáp án A
Câu 26. Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được V lít khí (ở đktc) và dung dịch X. Khi cho dư nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa. Biểu thức liên hệ giữa V với a, b là:
A. V = 22,4(a - b). B. V = 11,2(a - b).
C. V = 11,2(a + b). D. V = 22,4(a + b).
Lời giải:
-Nếu cho từ từ HCl vào Na2CO3 sẽ có hai phản ứng :
H+ + CO32- → HCO3-
H+ + HCO3- → H2O + CO2
Phân tích: H+ + CO32- → HCO3-
vì có khí nên H+ dư, tính theo CO32-: H+ dư = a - b
H+ + HCO3- → H2O + CO2 (∗)
Vì cho Ca(OH)2 có kết tủa nên HCO3- dư , tính theo H+
Ca(OH)2 + HCO3- → CaCO3 + H2O
→ Thể tích khí: V = (a - b).22,4
→ Đáp án A
Câu 27. Đốt cháy 16,1 gam Na trong bình chứa đầy khí O2, sau một thời gian thu được m gam hỗn hợp chất rắn Y gồm Na2O, Na2O2 và Na dư. Hòa tan hết toàn bộ lượng Y trên vào nước nóng, sinh ra 5,04 lít (đktc) hỗn hợp khí Z, có tỉ khối so với He là 3. Giá trị của m là
A. 18,8 B. 21,7
C. 18,5 D. 21,4
Lời giải:
Z gồm H2, O2. mZ = 4.3.0,225 = 2,7 g
Gọi a, b lần lượt là số mol H2, O2
Ta có hệ :
a + b = 0,225 (1)
2a + 32b = 2,7 (2)
⇒ a = 0,15 , b = 0,075
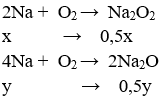
⇒ nNa còn = 0,7 - (x + y)
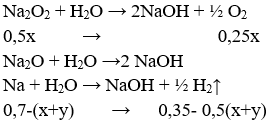
⇒ nO2 = 0,25x = 0,075 mol ⇒ x = 0,3 mol
⇒ nH2 = 0,35 - 0,5(x + y) = 0,15 ⇒ y = 0,1 mol
⇒ m = mNa2O2 + mNa2O + mNa dư = 78.0,15 + 62.0,05 + 23.0,3 = 21,7 g
→ Đáp án B
Câu 28. Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1: 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
Hướng dẫn:
Lời giải:
Ta có: nH2 = 0,04 mol
Gọi: nNa = x mol → nAl = 2x mol
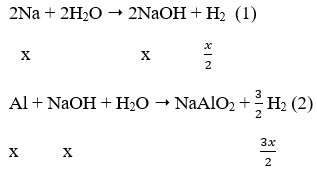
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
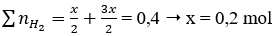
⇒ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
⇒ mAl = 0,2.27 = 5,4 (g)
Câu 29. Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng.
A. 0,8M B. 1,2M
C. 1M D. 0,75M
Lời giải:
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
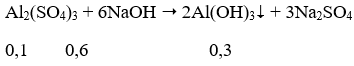
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4]
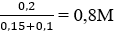
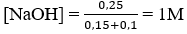
→ Đáp án C
Câu 30. Thuốc thử dùng để nhận biết các dung dịch NaCl, CaCl2, MgCl2 là:
A. NaOH, HCl B. Quì tím, NaOH
C. NaOH, Na2CO3 D. Quì tím, HCl.
Lời giải:
- Cho NaOH lần lượt vào các mẫu thử. Có kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Tiếp tục cho Na2CO3 vào 2 mẫu thử còn lại → Xuất hiện tủa trắng là CaCl2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
→ Đáp án C
Câu 31. Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Các thí nghiệm điều chế được NaOH là:
A. II, V và VI.
B. II, III và VI.
C. I, II và III.
D. I, IV và V.
Lời giải:
Các thí nghiệm (II), (III) và (VI) điều chế được NaOH:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
2NaCl + 2H2O -đpdd c.m.n→ 2NaOH + H2 + Cl2
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
→ Đáp án B
Câu 32. Hòa tan hoàn toàn một lượng hỗn hợp Na và K vào nước được dung dịch A và V lít khí ở đktc. Để trung hòa hòa toàn dung dịch A phải dùng 75 ml dung dịch H2SO4 0,5M. Vậy V có giá trị là:
A. 0,56 lít B. 0,672 lít
C. 0,84 lít D. 1,12 lít
Lời giải:
Bài toán này có thể giải ngắn gọn như sau:
Số mol OH- tạo ra = số mol H+ trung hòa = 2. Số mol H2
Số mol H2 = 0,075: 2 = 0,00375 → V = 0,84 lít
→ Đáp án C
Câu 33. Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M, và 0,224l khí H2 (đktc). Kim loại M là
A. K B. Na
C. Ba D. Ca
Lời giải:
M: x mol; M2On: y mol
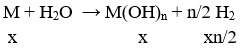
⇒ nx/2 = 0,01 ⇒ nx = 0,02
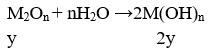
⇒ nM(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02; y = 0 ⇒ B.C loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01, y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
→ Đáp án C
Câu 34. Cho 3,9 gam hỗn hợp 2 muối Na2CO3 và K2SO3 tác dụng với 200 ml dung dịch HCl, ta thu được một hỗn hợp khí A có tỉ khối hơi so với metan là 3,583 và dung dịch B. Để trung hòa lượng axit còn dư trong dung dịch B ta phải dùng hết 100 ml dung dịch Ba(OH)2 0,2M. Vậy % Na2CO3 và K2SO3 trong hỗn hợp ban đầu là:
A. 60,5% và 39,5%
B. 64% và 36%
C. 64,6% và 35,4%
D. 25,14% và 74,86%
Lời giải:
Gọi x, y là số mol cảu Na2CO3 và K2SO4 trong hỗn hợp.
Phương trình phản ứng xảy ra:
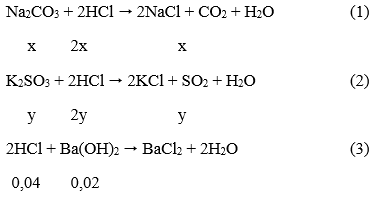
Theo đề bài ta có: 106x + 158y = 3,9 (I)
Mặt khác: (44x+16y)/(x+y) = 33,586.16 ⇒ -13,328x + 6,672y = 0 (II)
x = 0,00925 mol; y = 0,0185 mol
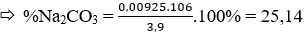
→ Đáp án D
Câu 35. Cho 6,2 gam hỗn hợp gồm Na và một kim loại kiềm M có tỉ lệ số mol là 1:1 tác dụng với 104 gam nước, người ta thu được 110 gam dung dịch có khối lượng riêng là 1,1 g/ml. Vậy kim loại kiềm M là:
A. Li B. K
C. Rb D. Cs
Lời giải:
Phương trình phản ứng
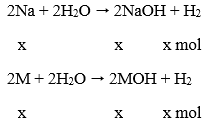
Theo đề bài ta có: 23x + Mx = 6,2 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mkim loại + mnước = mdd + mhiđro
Từ đó: mhiđro = mkim loại - mnước = mdd = 6,2 + 104 - 110 = 0,2 (g)
→ x = 0,1 mol, thay vào (1) ta được M = 39 (K)
→ Đáp án B
Câu 36. Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
A. 4 B. 7
C. 5 D. 6
Lời giải:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 37. Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2 B. 0,15
C. 0,1 D. 0,05
Lời giải:
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+= 2.0,1 = 0,2 mol
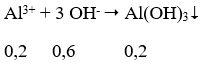
→ nOH- dư = 0,7 - 0,6 = 0,1 mol
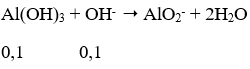
→ nAl(OH)3 = 0,2 - 0,1 = 0,1 mol
→ Đáp án C
Câu 38. Trộn 0,81 gam bột Al với bột Fe2O3 và CuO rồi nung nóng để tiến hành phản ứng nhiệt nhôm, thu được hỗn hợp X. Hòa tan X trong dung dịch HNO3 loãng, nóng, thu được V lit khí NO (đktc). Giá trị của V là:
A. 0,224 lit B. 2,24 lit.
C. 6,72 lit D. 0,672 lit
Lời giải:
Ta có: nAl = 0,03 (mol)
Các phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe (1)
2Al + 3CuO → Al2O3 + 3Cu (2)
Gọi số mol Al tham gia phản ứng (1) là x, tham gia phản ứng (2) là y.
Theo (1): nFe = nAl = x (mol)
Theo (2): nCu = 3/2 nAl = 3/2.y (mol)
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (4)
Theo (3): nNO/(3) = nFe = x (mol).
Theo (4): nNO/(4) = 2/3 nCu = 2x/3. 3x/2 .y = y(mol)
⇒ nNO = x + y = 0,03 (mol) ⇒ VNO = 0,03 x 22,4 = 0,672 (lit).
→ Đáp án D
Câu 39. Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là:
A. 0,4M B. 0,2M
C. 0,6M D. 0,1M
Lời giải:
Ta có: nCO2 = 0,15 mol; nBa(OH)2 = 0,125 mol; nOH-= 0,25 mol
Ta thấy
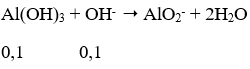
Phương trình phản ứng
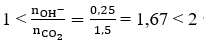
Ta có hệ:
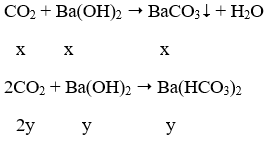
⇒ [Ba(HCO3)2] = 0,025/0,125 = 0,2M
→ Đáp án B
Câu 40. Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g B. 56,1 g
C. 65,1g D. 51,6 g
Lời giải:
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
→ Đáp án B
Câu 41. Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là
A. Mg B. Al
C. Ca D. Na
Lời giải:
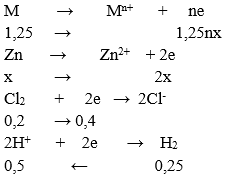
BT e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M +65)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
→ Đáp án A
Câu 42. Cho m gam bột Al vào cốc chứa V lít dung dịch NaOH 2M, sau phản ứng hoàn toàn cho tiếp vào dung dịch HCl vào cốc đó đến khi kết tủa tan hết thấy cần dùng 800ml dung dịch HCl 1M và có 3,36 lít khí thoát ra (ở đktc). Giá trị của m và V lần lượt là
A. 6,075 và 0,2500
B. 7,425 và 0,0625
C. 3,375 và 0,2500
D. 6,075 và 0,0625
Lời giải:
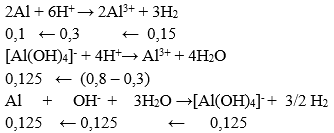
⇒ m = (0,125 + 0,1).27 = 6,075 g
⇒ Vdd NaOH = 0,125/2 = 0,0625 lít
→ Đáp án D
Câu 43. Cho dung dịch chứa 6,595 gam muối clorua của kim loại kiềm thuộc hai chu kì liên tiếp và dung dịch AgNO3 (dư), thu được 15,785 gam kết tủa. Phần trăm khối lượng của muối có khối lượng phân tử nhỏ là:
A. 92,719% B. 11,296%
C. 7,281% D. 88,704%
Lời giải:
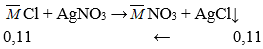
⇒ M + 35,5 = 6,595/0,11
⇒ M = 24,45 ⇒ M1 = 23 (Na) < M < M2 = 39 (K)
Ta có: a + b = 0,11 (1)
58,5a + 74,5b = 6,595 (2)
⇒ a = 0,1, b = 0,01
⇒ % mNaCl = (0,1.58,5.100%)/6,595 = 88,7%
→ Đáp án D
Câu 44. Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
A. 0,24M. B. 0,48M.
C. 0,2M. D. 0,4M.
Lời giải:
nKCl = 35,25/74,5 = 0,5 mol; nCl2 = 13,44/22,4 = 0,6 mol
2KOH (1mol) + Cl2 (0,6) → KCl (0,5) + KClO + H2O
CM KOH = 1/2,5 = 0,4 M
→ Đáp án D
Câu 45. Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M , KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là :
A. 4,48 B. 3,36
C. 2,24 D. 1,12
Lời giải:
nCO32- = 0,15 mol; nHCO3- = 0,1 mol; nH+ = 0,2 mol
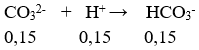
nH+ còn lại = 0,2 – 0,15 = 0,05 mol
nHCO3- = 0,1 + 0,15 = 0,25 mol
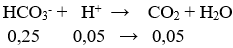
⇒ V = 0,05.22,4 = 1,12 lít
→ Đáp án D
Câu 46. Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất, ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là
A. NO và Mg. B. N2O và Al
C. N2O và Fe. D. NO2 và Al.
Lời giải:
MKhí = 22 chứng tỏ NxOy là N2O duy nhất
nN2O = 0,042 mol
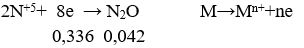
BT e ⇒ ne = 0,036 mol ⇒ nM = 0,036/n
Khi đó M = 3,024/(0,336:n)
M = 9n ⇒ n = 3, M = 27 ⇒ Chọn Al
→ Đáp án B
Câu 47. Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
A. 4,48. B. 1,12.
C. 2,24. D. 3,36.
Lời giải:
Số mol CO32- = 0,15 (mol); số mol HCO3- = 0,1(mol); số mol H+ = 0,2(mol)
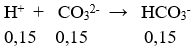
Tổng số mol HCO3- = 0,25 mol;
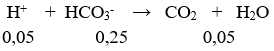
VCO2 = 0,05.22,4 = 1,12 (lít)
→ Đáp án B
Câu 48. Cho m gam bột Mg vào 500ml dung dịch FeCl3 1M. Sau khi phản ứng xảy ra hoàn toàn, khối lượng dung dịch thay đổi 2,4 gam so với dung dịch ban đầu ( nước bay hơi, không đáng kể). Giá trị nào của m trong các giá trị sau là không thỏa mãn ?
A. 2,4 B. 12,3
C. 8,7 D. 9,6
Lời giải:
Mg + 2Fe3+ → Mg2+ + 2Fe2+ (1)
+) Nếu Mg hết Fe3+ còn ⇒ m = 2,4
+) Nếu Mg còn, Fe3+ hết
(1) ⇒ nMg = 1/2 nFe3+ = 0,25 mol
Mg + Fe2+ → Mg2+ + Fe (2)
• Nếu Δm↓ = 24(x + 0,25) – 56x = 2,4 ⇒ x = 0,1125 mol
⇒ m = (0,25 + 0,1125).24 = 8,7 g
• Nếu Δm↑ = -24(x + 0,25 ) + 56x = 2,4 ⇒ x = 0,2625 mol
⇒ m = (0,25 + 0,2625).24 = 12,3 g
→ Đáp án D
Câu 49. Cho 100ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55g. Tính nồng độ dung dịch NaOH ban đầu.
A. 0,75 M B. 1,75M
C. 1M D. 1,25M
Lời giải:
Số mol AlCl3 là: nAlCl3 = 0,1.1 = 0,1 (mol)
Số mol Al2O3 là: nAl2O3 = 2,55/102 = 0,025 (mol)
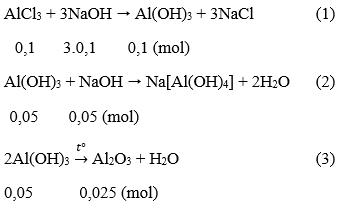
Theo pt(3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
Nồng độ mol/l CM (NaOH) = 0,35/0,2 = 1,75M
→ Đáp án B
Câu 50. Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 có nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là:
A. 0,032 B. 0,048
C. 0,06 D. 0,04
Lời giải:
Ta có: nCO2 = 2,688/22,4 = 0,12 mol;
nBaCO3 = 11,82/197 = 0,06 mol
Do nCO2 ≠ nBaCO3 nên ngoài BaCO3 còn có Ba(HCO3)2 được tạo thành.

Theo phản ứng: ∑nBa(OH)2 = 0,08 + 0,02 = 0,1 mol
a = 0,1/2,5 = 0,04M
→ Đáp án D
Câu 51. Trộn 5,4g bột Al với 17,4g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng, dư thì thu được 5,376 lít H2 (dktc). Hiệu suất của phản ứng nhiệt nhôm là:
A. 62,5% B. 60%
C. 20% D. 80%
Lời giải:
Ta có: nAl = 5,4/27 = 0,2 mol
nFe3O4 = 17,4/232 = 0,075 mol
nH2 = 5,376/22,4 = 0,24 mol
8Al (8/3 x) + 3Fe3O4 (x) → 9Fe (3x) + 4Al2O3
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
Hỗn hợp rắn sau phản ứng gồm Al dư, Fe3O4 dư, Al2O3 và Fe.
Theo phản ứng: nAl phản ứng = 8/3 x mol ⇒ Al dư = (0,2 - 8/3 x) mol
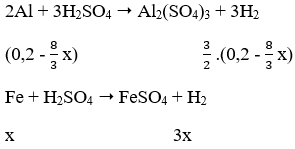
⇒ 3/2. (0,2 - 8x/3) + 3x = 0,24 ⇒ x = 0,06 mol
Vậy H = (0,06/0,075). 100% = 80%
→ Đáp án D
Câu 52. Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Giá trị của m là
A. 3,940. B. 1,182.
C. 2,364. D. 1,970.
Lời giải:
nOH- = 0,006 + 2.0,012 = 0,03(mol)
nCO2 = 0,02(mol). Có: 1 < (nOH-)/nCO2 < 2 nên tạo ra 2 ion số mol bằng nhau = 0,01mol
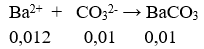
Khối lượng kết tủa = 0,01. 197 = 1,97(g)
→ Đáp án D
Câu 53. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaOH 0,2M , sau phản ứng thu được số mol CO2 là:
A. 0,03 B. 0,01
C. 0,02 D. 0,015
Lời giải:
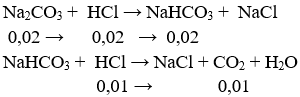
⇒ nCO2 = 0,01 mol
→ Đáp án B
Câu 54. Hòa tan hết 17,94 gam một kim loại kiềm vào một lượng nước du thu được dung dịch X. Cho dung dịch X tác dụng với 36,92 gam P2O5 thì thu được dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau. Kim loại kiềm là
A. Na B. Rb
C. K D. Li
Lời giải:
nH3PO4 = 2nP2O5 = 2.36,92/142 = 0,52 mol
M + H2O → MOH + 1/2 H2 ↑
Phản ứng xảy ra theo thứ tự:
H3PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
MH2PO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4 ⇒ nMH2PO4 = nM2HPO4 = 0,26
nM = nMH2PO4 + 2nM2HPO4 = 0,78 mol ⇒ M = 17,94/0,78 = 23(Na)
TH2: Hai muối là: M2HPO4 và M3PO4 ⇒ nM2HPO4 = nM3PO4 = 0,26
nM = 2nM2HPO4 + 3nM3PO4 = 1,3 mol ⇒ M = 17,94/1,3 = 13,8(loại)
→ Đáp án A
Câu 55. Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
A. 75 % và 0,54 mol B. 80 % và 0,52 mol
C. 75 % và 0,52 mol D. 80 % và 0,54 mol
Lời giải:
nAl = 0,2 mol; nFe3O4 = 0,075 mol; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn: 8Al (x) + 3Fe3O4 → 4Al2O3 (0,5x) + 9Fe
Hòa tan chất rắn (Fe, Al dư) vào H2SO4 ⇒ H2
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 → x = 0,16 mol → Hphản ứng = 0,16/0,2 = 80%
BT e ⇒ nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
→ nH2SO4 phản ứng = 1,08/2 = 0,54mol
→ Đáp án D
Câu 56. Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào m gam dung dịch hỗn hợp chứa 0,05 mol NaOH; 0,05mol KOH; 0,05 mol Ba(OH)2. Dung dịch sau phản ứng có khối lượng?
A. (m – 11,65) gam
B. (m + 6,6) gam
C. (m – 5,05) gam
D. (m – 3,25) gam
Lời giải:
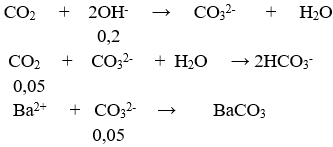
⇒ mdd = m + 0,15.44 – 197.0,05 = (m – 3,25) gam
→ Đáp án D
Câu 57. Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
A. 1,2 B. 1,0
C. 12,8 D. 13,0
Lời giải:
nH+ = 0,1(2. CM H2SO4 + CM HCl ) = 0,02;
nNaOH = 0,1[CM NaOH + 2CM Ba(OH)2] = 0,04.
H+ + OH- → H2O dư 0,02 mol OH-.
[OH-] = 0,02/(0,1 + 0,1) = 0,1 = 10-1.
[H+] = 10-13 ⇒ pH = 13
→ Đáp án D
Câu 58. Hoà tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước, thu được dung dịch X và 2,688 lít khí H2 (đktc). Dung dịch Y gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4: 1. Trung hoà dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là
A. 13,70 gam. B. 18,46 gam.
C. 12,78 gam. D. 14,62 gam.
Lời giải:
nH2 = 0,12 mol; nOH- = 0,24 mol
Để trung hòa dd X thì dung dịch Y cần dùng với số mol H+ là 0,24 mol
Gọi số mol của H2SO4 là x thì số mol của HCl là 4x
2x + 4x = 0,24 nên x = 0,04;
Khối lượng muối = khối lượng kim loại + khối lượng gốc axi = 8,94 + 0,04.96 + 0,16.35,5 = 18,46 g
→ Đáp án B
Câu 59. Nhận biết Al, Mg, Al2O3 dùng:
A. Dung dịch HCl.
B. Dung dịch HNO3.
C. Dung dịch CuCl2.
D. Dung dịch NaOH.
Lời giải:
Lần lượt cho NaOH vào các mẫu thử. Chất rắn tan có khí thoát ra là Al, tan không có khí là Al2O3, không tan là MgO.
Phương trình hóa học:
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Al2O3 + 2NaOH → NaAlO2 + H2O
→ Đáp án D
Câu 60. Hòa tan hoàn toàn a gam bột Al vào dung dịch HNO3 dư thu được 8,96 lít (đktc) gồm hỗn hợp hai khí NO và N2O có tỉ lệ số mol là 1: 3. Giá trị của a là:
A. 32,4 B. 24,3
C. 15,3 D. 29,7
Lời giải:
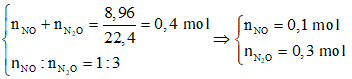
-BT e→ 3nAl = 3nNO + 8nN2O = 2,7 mol ⇒ nAl = 0,9 mol → a = 24,3g
→ Đáp án B
Câu 61. Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
A. 0,22l B. 0.2l
C. 0,15l D. 0,12l
Lời giải:
Số mol Al = 0,81/27 = 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
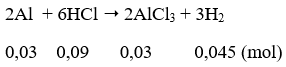
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
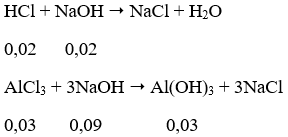
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (lít)
→ Đáp án A
Câu 62. Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00 B. 0,75
C. 1,25 D. 1,00
Lời giải:
nOH- = nNaOH + 2nCa(OH)2 = 0,05 mol
nCO2 = 0,672/22,4 = 0,03 mol
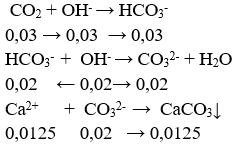
⇒ x = 0,0125.100 = 1,25 g
→ Đáp án C
Câu 63. Hòa tan hoàn toàn 14,58 gam Al trong dung dịch HNO3 loãng, đun nóng thì có 2,0 mol HNO3, đã phản ứng, đồng thời có V lít khí N2 thoát ra (đktc). Giá trị của V là
A. 2,24 B. 2,80
C. 1,12 D. 1,68
Lời giải:
+ Đặt nNH4NO3 = a, nN2 = b
⇒ 10nNH4NO3 + 8nN2 = 3nAl = 1,62 (1)
⇒ 12nNH4NO3 + 10nN2 = nHNO3 = 2 (2)
+ Giải hệ (1) và (2) ⇒ b = nN2 = 0,05 mol
⇒ VN2 = 1,12 lít
→ Đáp án C
Câu 64. Cho dung dịch chứa a mol Ca(HCO3)2 tác dụng với dung dịch chứa a mol chất tan X. Để thu được lượng kết tủa lớn nhất thì X là
A. Ba(OH)2. B. Ca(OH)2.
C. NaOH. D. Na2CO3.
Lời giải:
Lượng kết tủa thu được lớn nhất khi:
- X chứa cation cũng tạo được kết tủa với .
- Cation có nguyên tử khối lớn nhất.
Kết hợp hai điều kiện trên chọn được chất X phù hợp là Ba(OH)2.
Ca(HCO3)2 + Ba(OH)2 → CaCO3↓ + 2H2O + BaCO3↓
→ Đáp án A
Câu 65. Cho các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2. Số dung dịch tác dụng được với dung dịch NaHCO3 là:
A. 3. B. 1.
C. 2. D. 4.
Lời giải:
Có 3 dung dịch tác dụng được với dung dịch NaHCO3: HNO3, Ca(OH)2, KHSO4.
HNO3 + NaHCO3 → NaNO3 + H2CO3
Ca(OH)2 + 2NaHCO3 → CaCO3 + 2H2O + Na2CO3
2NaHCO3 + 2KHSO4 → 2H2O + Na2SO4 + K2SO4 + 2CO2
→ Đáp án A
Câu 66. Hỗn hợp X gồm Ba, BaO và Ba(OH)2 có tỉ lệ số mol tương ứng 1: 2: 3. Cho m gam X vào nước thì thu được a lít dung dịch Y và V lít khí H2 (đktc). Hấp thụ 8V lít CO2 (đktc) vào a lít dung dịch Y đến phản ứng xảy ra hoàn toàn thì thu được 98,5 gam kết tủa. Giá trị của m là
A. 105,16. B. 119,50.
C. 95,60. D. 114,72.
Lời giải:
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6V/22,4
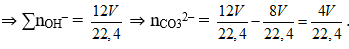
⇒ nBaCO3 = (4V/22,4) x 197 = 98,5 → V = 2,8.
⇒ nBa = 2,8/22,4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125 x 137 + 0,25 x 153 + 0,375 x 171 = 119,5 gam
→ Đáp án B
Câu 67. Đốt nóng hỗn hợp X gồm Fe2O3 và bột Al trong môi trường không có không khí. Nếu cho những chất còn lại sau phản ứng tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2; còn nếu cho tác dụng với dung dịch HCl dư thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là:
A. 0,3 B. 0,4
C. 0,25 D. 0,6
Lời giải:
Khi cho Al phản ứng với NaOH hoặc HCl thì số mol H2 thu được là như nhau:
nH2 = 0,3 mol ⇒ nAl = 0,2 mol
Từ đó suy ra nH2 do Fe tạo ra = 0,4 - 0,3 = 0,1 mol
→ nFe = 0,1 mol ⇒ nAl đã phản ứng tạo Fe là 0,1 mol vì:
Fe2O3 + 2Al (0,1) → Al2O3 + 2Fe (0,1)
→ ∑nAl trong X = 0,1 + 0,2 = 0,3mol
→ Đáp án A
Câu 68. Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
A. 1,2 B. 1,8
C. 2,4 D. 2
Lời giải:
Ta có: nAlCl3 = 1,5.0,2 = 0,3 mol; nAl(OH)3 = 15,6/78 = 0,2 mol
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại, bị NaOH hòa tan 1 phần còn 15,6 (g).
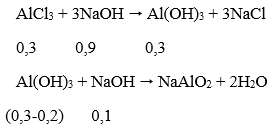
Theo phương trình phản ứng, ta có: nNaOH = 0,9 + 0,1 = 1 mol
⇒ VNaOH = 1/0,5 = 2 lít
→ Đáp án D
Câu 69. Cho 19,02 gam hỗn hợp Mg, Ca, MgO, CaO, MgCO3, CaCO3 tác dụng vừa đủ với m gam dung dịch HCl 10% thu được 4,704 lít hỗn hợp khí X (đktc). Biết khối lượng hỗn hợp khí X là 5,25 gam và dung dịch sau phản ứng chứa 19,98 gam CaCl2. Giá trị của m gần giá trị nào nhất sau đây?
A. 229,95. B. 153,30.
C. 237,25. D. 232,25.
Lời giải:
X gồm H2 và CO2. Đặt nCO2 = x; nH2 = y ⇒ nX = x + y = 0,21 mol;
mX = 5,25g = 44x + 2y.
Giải hệ có: x = 0,115 mol; y = 0,095 mol.
Quy đổi hỗn hợp ban đầu về Mg, Ca, O và CO2
⇒ nCa = nCaCl2 = 0,18 mol.
Đặt nMg = x; nO = y ⇒ 24x + 0,18 x 40 + 16y + 0,115 x 44 = 19,02g
Bảo toàn electron: 2x + 0,18 × 2 = 0,095 × 2 + 2y.
Giải hệ có: x = 0,135 mol; y = 0,22 mol.
⇒ nHCl = 2nMg + 2nCa = 2 x 0,135 + 2 x 0,18 = 0,63 mol
⇒ m = 0,63 x 36,5: 0,1 = 229,95(g).
→ Đáp án A
Câu 70. Hấp thụ hoàn toàn 4,48 lít CO2 ở (đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là:
A. 19,70 B. 17,73
C. 9,85 D. 11,82
Lời giải:
Ta có: nCO2 = 4,48/22,4 = 0,2 mol
nNaOH = 0,5.0,1 = 0,05 mol
nBa(OH)2 = 0,2.0,5 = 0,1 mol
nOH- = 0,1.2 + 0,05 = 0,25 mol
nBa2+ = 0,1 mol
Ta thấy:
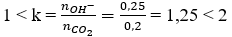
→ tạo ra 2 ion CO32- và HCO3-
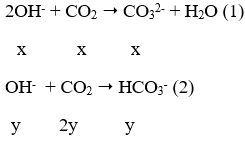
Ta có hệ phương trình:
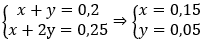
Ba2+ + CO32- → BaCO3↓
⇒ mBaCO3 = 0,05.197 = 9,85 g
→ Đáp án C
Câu 71. Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,030. B. 0,010.
C. 0,020. D. 0,015.
Lời giải:
Theo thứ tự phản ứng HCl sẽ phản ứng với Na2CO3 trước, lượng dư mới phản ứng với NaHCO3.
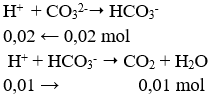
→ Đáp án B
Câu 72. Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1: 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 10,8 B. 5,4
C. 7,8 D. 43,2
Lời giải:
Ta có: nH2 = 0,896/22,4 = 0,04 mol
Gọi: nNa = x mol → nAl = 2x mol
Phản ứng:
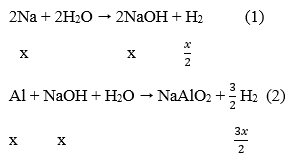
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2) ∑nH2 = x/2 + 3x/2 = 0,4 → x = 0,2 mol
mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
mAl = 0,2.27 = 5,4 (g)
→ Đáp án B
Câu 73. Hỗn hợp X gồm Na, Al và Fe (với tỉ lệ số mol giữa Na và Al tương ứng là (2: 1). Cho X tác dụng với H2O (dư) thu được chất rắn Y và V lít khí. Cho toàn bộ Y tác dụng với dung dịch H2SO4 loãng (dư) thu được 0,25V lít khí. Biết các khí đo ở cùng điều kiện, các phản ứng đều xảy ra hoàn toàn. Tỉ lệ số mol của Fe và Al trong X tương ứng là
A. 1: 2. B. 5: 8.
C. 5: 16. D. 16: 5.
Lời giải:
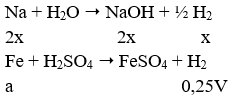
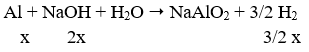
Ta có: a = 0,25V;
còn: x + 3x/2 = 5x/2 = 2,5x = V suy ra x = V/2,5
Vậy a/x = 0,25V/0,4V = 5/8
→ Đáp án B
Câu 74. Thuốc thử dùng để nhận biết các dung dịch NaCl, CaCl2, MgCl2 là:
A. NaOH, HCl B. Quì tím, NaOH
C. NaOH, Na2CO3 D. Quì tím, HCl.
Lời giải:
- Cho NaOH lần lượt vào các mẫu thử. Có kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Tiếp tục cho Na2CO3 vào 2 mẫu thử còn lại ⇒ Xuất hiện tủa trắng là CaCl2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
→ Đáp án C
Câu 75. Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc) duy nhất và dung dịch X chứa m gam muối. Giá trị của m là
A. 34,10 B. 31,32
C. 34,32 D. 33,70
Lời giải:
Số mol N2O = 1,008/22,4 = 0,045 mol;
4M + 10HNO3 (0,5) → 4M(NO3)2 + N2O (0,045) + 5H2O
Số mol HNO3 phản ứng = 0,045.10 = 0,45 mol < 0,5 suy ra có tạo sản phẩm khử khác là NH4NO3
4M + 10HNO3 (0,05) → 4M(NO3)2 + NH4NO3 (0,005) + 3H2O
Vậy m = 8,9 + 62.( 8.0,045 + 8.0,005)+ 80.0.005=34,1g
→ Đáp án A
Câu 76. Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80
Lời giải:
nAl dư = 2nH2/3 = 0,1 mol
⇒ H = [(0,25 – 0,1)/0,25]. 100% = 60%
2Al (0,15) + Fe2O3 → Al2O3 +2Fe
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
→ Đáp án A
Câu 77. Dung dịch X chứa 0,12 mol Na+; x mol SO42-; 0,12 mol Cl- và 0,05 mol NH4+. Cho 300 ml dung dịch Ba(OH)2 0,1M vào X đến khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
A. 7,190 B. 7,020
C. 7,875 D. 7,705.
Lời giải:
Có dung dịch X gồm NaCl (0,12 mol), và (NH4)2SO4 (0,025 mol)
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Sau phản ứng dư: 0,005 mol Ba(OH)2 trong dung dịch
m = 0,12.58,5 + 0,005.171 = 7,875 gam
→ Đáp án C
Câu 78. Hòa tan hoàn toàn 3,60 gam Mg trong 500 ml dung dịch HNO3 0,80M, phản ứng kết thúc thu được 448 ml một khí X (ở đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2M. Giá trị của V là:
A. 167,5. B. 230.
C. 156,25. D. 173,75.
Lời giải:
Bảo toàn khối lượng: mdung dịch tăng = mMg – mX ⇒ mX = 3,6 – 3,04 = 0,56(g).
⇒ MX = 0,56: 0,02 = 28 (N2)
Chú ý: "hòa tan hoàn toàn" ⇒ Mg hết.
Bảo toàn electron: 2nMg = 10nN2 + 8nNH4NO3 ⇒ nNH4NO3 = 0,0125 mol.
Bảo toàn nguyên tố Nitơ: ∑nNO3-/Y = 0,4 – 0,02 x 2 – 0,0125 = 0,3475 mol.
⇒ Bảo toàn nguyên tố Natri: nNaOH = nNaNO3 = 0,3475 mol ⇒ V = 173,75 ml
→ Đáp án D
Câu 79. Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
A. 5 gam B. 15 gam
C. 20gam D. 40gam
Lời giải:
Có
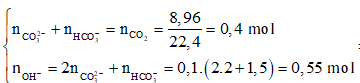
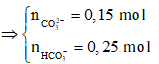
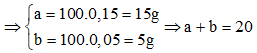
→ Đáp án C
Câu 80. Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
A. 45,6 gam B. 57,0 gam
C. 48,3 gam D. 36,7 gam
Lời giải:
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
- Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
Phương trình hóa học:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2. 3 = 0,6 mol
→ nFe3O4 = 0,15 mol
Áp dụng nguyên tố với Fe: nFe = 3nFe3O4 = 3. 0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam
→ Đáp án C
Câu 81. Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3 , Fe và Fe3O4
Lời giải:
8Al + 3Fe3O4 -to→ 4Al2O3↓ + 9Fe
⇒ nFe3O4 / nAl = 3/8 < 1/3 ⇒ Al còn Fe3O4 hết
⇒ Hỗn hợp sản phẩm gồm Al2O3, Fe và Al
→ Đáp án B
Câu 82. Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là:
A. 23,2 B. 12,6
C. 18,0 D. 24,0
Lời giải:
Pt pư: 4FeS2 (0,15) + 11O2 -to→ 2Fe2O3 (0,3) + 8SO2 (1)
Ta có: nBa(OH)2 = 0,15 mol
nKOH = 0,1 mol => nBa2+ = 0,15 mol; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) ↓ BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- → BaSO3↓ + H2O
Ta có: nBaCO3 = 0,1 mol
Phương trình hóa học:

Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: nSO2 = 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: nFeS2 = 1/2 nSO2 = 0,15 mol ⇒ mFeS2 = 120.0,15 = 15 (g)
→ Đáp án C
Câu 83. Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
A. 4 B. 7
C. 5 D. 6
Lời giải:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 84. Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 2,44 gam B. 2,22 gam
C. 2,31 gam D. 2,58 gam.
Lời giải:
Ta có: số mol CO2 = 0,015 mol;
Số mol OH- = 0,02 + 0,02 = 0,4 mol;
Vậy k > 2 nên tạo muối trung hòa, dư OH-:
khối lượng rắn = 23.0,02 + 39.0,02 + 0,015.60 + 0,01.17 = 2,31g
→ Đáp án C
Câu 85. Nung hỗn hợp gồm 10,8 gam gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại M trong Y là:
A. 5,6 gam B. 22,4 gam
C. 11,2 gam D. 16,6 gam
Lời giải:
2Al (0,2) + Fe2O3 (0,1) → Al2O3 + 2Fe (0,2)
⇒ Khối lượng kim loại trong Y = mFe + mAl dư = 56.0,2 + 10,8 - 27.0,2 = 16,6 g
→ Đáp án D
Câu 86. Cho hỗn hợp K2CO3 và NaHCO3 (tỉ lệ mol 1: 1) vào bình dung dịch Ba(HCO3)2 thu được kết tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 0,5M vào bình đến khi không còn khí thoát ra thì hết 560 ml. Biết toàn bộ Y phản ứng vừa đủ với 200 ml dung dịch NaOH 1M. Khối lượng kết tủa X là
A. 3,94 gam. B. 7,88 gam.
C. 11,28 gam. D. 9,85 gam.
Lời giải:
Dung dịch Y có HCO3- phản ứng NaOH tỉ lệ mol 1:1 nên nHCO3- trong Y= 0,2 mol
Gọi số mol K2CO3 là x và Ba(HCO3)2 là y.
Khi phản ứng HCl ta có số mol HCl = 2x + x + 2y = 0,28 hay 3x + 2y = 0,28;
nHCO3- = x + 2y = 0,2 nên x = 0,04 và y = 0,08.
Vậy nBaCO3 = x = 0,04 ⇒ m = 7,88g
→ Đáp án B
Câu 87. Hòa tan hoàn toàn 13,44 gam kim loại M bằng dung dịch HCl, thu được 5,376 lít khí H2 (đktc). Kim loại M là
A. Mg. B. Al.
C. Zn. D. Fe.
Lời giải:
Đặt n là hóa trị của M. Bảo toàn electron: n x nM = 2nH2.
⇒ nM = 0,48/n ⇒ MM = 13,44/(0,48:n) = 28n.
⇒ n = 2 và MM = 56 (Fe)
→ Đáp án D
Câu 88. Cho dãy các kim loại: Fe, Zn, Al, Mg, Ag, Cu. Số lượng kim loại vừa phản ứng được với dung dịch NaHSO4, vừa phản ứng được với dung dịch HNO3 đặc, nguội là
A. 3. B. 4.
C. 2. D. 5.
Hướng dẫn:
NaHSO4 có tính axit mạnh (điện li hoàn toàn ra H+).
NaHSO4 → Na+ + H+ + SO42–.
Al, Fe và Cr bị thụ động với HNO3 đặc, nguội.
⇒ Các kim loại thỏa mãn điều kiện trên là Zn và Mg
→ Đáp án C
Lời giải:
→ Đáp án
Câu 89. Hỗn hợp X gồm Na, Al và Fe, hỗn hợp Y gồm Al và kim loại R. Biết rằng, khối lượng của Al có trong X và Y bằng nhau, tổng khối lượng của Na và Fe có trong X gấp 2 lần khối lượng của R có trong Y. Hòa tan hoàn toàn lần lượt X, Y băng lượng dư dung dịch H2SO4 loãng thì cả 2 trường hợp đều thu được V lít khí H2 (đktc). Kim loại R là
A. Ca. B. Be.
C. Zn. D. Mg.
Lời giải:
Do lượng Al trong X và Y như nhau ⇒ khác nhau là do Na, Fe và R
⇒ Bỏ Al ra để tiện xét bài toán ⇒ Xét hỗn hợp X gồm Na, Fe và Y chỉ chứa R.
Giả sử mY = 100g ⇒ ∑mX = 200g.
• Giả sử hỗn hợp X chỉ chứa Na ⇒ nNa = 200: 23 mol ⇒ nH2 = 100/23 mol.
• Giả sử hỗn hợp X chỉ chứa Fe ⇒ nH2 = nFe = 200: 56 mol = 25/7 mol.
Thực tế X chứa cả Na và Fe ⇒ 25/7 < nH2 < 100/23 mol.
Gọi hóa trị của R là n. Bảo toàn electron: nR = 2nH2/n.
⇒ 50 / 7n < nR < 200 / 23n ⇒ 11,5n < MR = 100/nR < 14n.
TH1: n = 1 ⇒ 11,5 < MR < 14 ⇒ không có kim loại nào.
TH2: n = 2 ⇒ 23 < MR < 28 ⇒ R là Magie(Mg) ⇒ chọn D.
TH3: n = 3 ⇒ 34,5 < MR < 42 ⇒ không có kim loại nào.
→ Đáp án D
Câu 90. Cho 7,2 gam bột Mg tan hết trong dd hỗn hợp HCl (dư) và KNO3 thu được dung dịch X chứa m gam muối và 2,688 lít khí Y (đktc) gồm N2 và H2 có khối lượng 0,76 gam. Giá trị của m là
A. 28,50. B. 30,5.
C. 34,68. D. 29,84.
Lời giải:
Từ nHỗn hợp 2 khí và khối lượng 2 khí ⇒ nN2 = 0,01 và nH2 = 0,1 mol.
Bảo toàn e ta có nNH4+ =
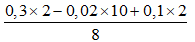
⇒ nHCl = 12nN2 + 2nH2 + 10nNH4+ = 0,69 mol.
Sơ đồ bài toán:
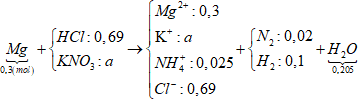
+ Bảo toàn điện tích hoặc bảo toàn nitơ ⇒ nK+ = 0,065 mol.
⇒ mMuối = 0,3x24 + 0,065x39 + 0,025x18 + 0,69x35,5 = 34,68 gam.
→ Đáp án C
Câu 91. Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
A. 10,4 B. 27,3
C. 54,6 D. 23,4
Lời giải:
- Theo đề ta có:
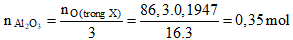
- Khi hòa tan hỗn hợp X bằng nước. Xét dung dịch Y ta có:
+ nAlO2 = 2nAl2O3 = 0,7 mol -BTDT→ nOH- = 2nH2 - 2nAlO2- = 0,5 mol
- Khi cho dung dịch Y tác dụng với 2,4 mol HCl, vì:
nAlO2- + nOH- < nH+ < 4nAlO2- + nOH-
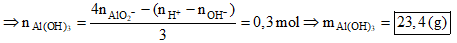
→ Đáp án D
Câu 92. Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X nói trên là
A. 1,68 gam. B. 2,56 gam.
C. 3,36 gam. D. 3,42 gam.
Lời giải:
Số mol nHCl = 0,04 mol ⇒ nOH- = 0,04 mo.
⇒ Bảo toàn điện tích ta có: nNa+ = 0,03 mol.
⇒ Chất rắn thu được khi cô cạn dd X = 0,01 x 137 + 0,01 x 62 + 0,04 x 17 + 0,03 x 23 = 3,36 gam.
→ Đáp án C
Câu 93. Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 80 B.160
C.60 D. 40
Lời giải:
Có nCO32- = nHCO3- = 0,03 mol > nBa2+ = 0,02 mol (có 0,02 mol BaCO3)
⇒ dung dịch X có 0,01 mol CO32-
Và nOH- dư = 0,04 – 0,03 = 0,01 mol,
Để vừa bắt đầu xuất hiện bọt khí thì
nH+ = nOH- + nCO32- = 0,01 + 0,01 = 0,02 =0,25V
⇒ V = 80 ml
→ Đáp án A
Câu 94. Trộn 10,8 g bột Al với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiêt nhôm là
A. 80% B. 90%
C. 70% D. 60%
Lời giải:
Ta có: nAl = 10,8/27 = 0,4 mol;
nFe3O4 = 34,8/232 = 0,15 mol; nH2 = 10,752/22,4 = 0,48 mol
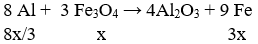
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng:
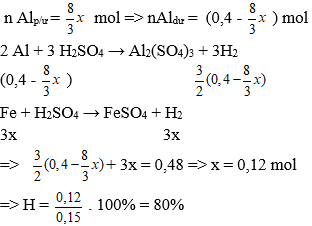
→ Đáp án A
Câu 95. Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
A. 7,7. B. 7,3.
C. 5,0. D. 6,55.
Lời giải:
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Phản ứng với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2x2 = 0,4 (1).
+ Phản ứng với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35x2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2 x 27 + 0,1 x 23 = 7,7 gam
→ Đáp án A
Câu 96. Hấp thụ hoàn toàn 0,672 lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00 B. 0,75
C. 1,25 D. 1,00
Lời giải:
nOH- = nNaOH + 2nCa(OH)2 = 0,05 mol
nCO2 = 0,672/22,4 = 0,03 mol
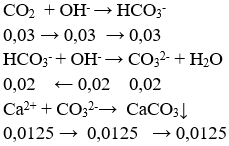
⇒ x = 0,0125.100 = 1,25 g
→ Đáp án C
Câu 97. Hỗn hợp X gồm hai kim loại kiềm và một kim loại kiềm thổ. Hòa tan hoàn toàn 1,788 gam X vào nước, thu được dung dịch Y và 537,6 ml khí H2 (đktc). Dung dịch Z gồm H2SO4 và HCl, trong đó số mol của HCl gấp hai lần số mol của H2SO4. Trung hòa dung dịch Y bằng dung dịch Z tạo ra m gam hỗn hợp muối. Giá trị của m là
A. 4,656 B. 4,460
C. 2,790 D. 3,792
Lời giải:
Có nH2SO4 = x mol; nHCl = 2x mol
4x = 0,024.2 ⇒ x = 0,012 mol
⇒ mmuối = 1,788 + 0,024.35,5 + 0,012.96 = 3,792 gam
→ Đáp án D
Câu 98. Cho các dung dịch đựng trong các lọ mất nhãn sau: NaCl, Na2CO3, Na2SO3, Na2S, HCl. Chỉ dùng một chất nào sau đây có thể nhận biết được cả 5 chất trên?
A. Quì tím B. H2SO4
C. Pb(NO3)2 D. BaCl2
Lời giải:
Thí nghiệm trên từng lượng nhỏ hóa chất
Cho quỳ tím vào từng dung dịch: HCl làm quì tím hóa đỏ, Na2CO3 làm quì tím hóa xanh.
Cho HCl vào 3 mẫu thử còn lai. Lọ có khí thoát ra có mùi trứng thối là Na2S, lọ có khí mùi sốc là Na2SO3, lọ còn lại không hiện tượng là NaCl.
Phương trình hóa học:
2HCl + Na2S → 2NaCl + H2S
2HCl + Na2SO3 → 2NaCl + SO2 + H2O.
→ Đáp án A
Câu 99. Hòa tan hỗn hợp gồm: K2O, BaO, Al2O3, Fe3O4 vào nước (dư) thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là:
A. K2CO3 B. Fe(OH)3
C. Al(OH)3 D. BaCO3
Lời giải:
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + OH- → 2AlO2- + H2O
⇒ Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO2-
AlO2- + CO2 + H2O → Al(OH)3↓ + HCO3-
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
→ Đáp án C
Câu 100. Thuốc thử dùng để nhận biết Na, Ca, Na2O là:
A. H2O, quỳ tím
B. H2O, dung dịch Na2CO3
C. Dung dịch HCl, quì tím
D. H2O, dung dịch HCl.
Lời giải:
- Lần lượt hòa tan các mẫu thử vào nước: tan và có khí thoát ra là Na và Ca; mẫu tan nhưng không có khí là Na2O.
PTHH: Ca + 2H2O → Ca(OH)2 + H2
Na + H2O → NaOH + 3/2 H2
Na2O + H2O → 2NaOH
- Tiếp tục cho Na2CO3 vào dung dịch thu được từ 2 mẫu có khí thoát ra. Mẫu nào xuất hiện kết tủa là Ca(OH)2 ⇒ chất ban đầu là Ca.
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
→ Đáp án B

