Phương pháp bảo toàn khối lượng trong hóa học vô cơ hay, chi tiết, có lời giải - Hoá học lớp 12
Phương pháp bảo toàn khối lượng trong hóa học vô cơ hay, chi tiết, có lời giải
Với Phương pháp bảo toàn khối lượng trong hóa học vô cơ hay, chi tiết, có lời giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập bảo toàn khối lượng trong hóa học vô cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Phương pháp giải
Các dạng bài thường gặp:
+ Bài toán Kim loại + axit → Muối + Khí
mmuối = mkim loại + manion gốc axit
→ Biết lượng khí ⇒ lượng anion gốc axit + mkim loại ⇒ mmuối
→ Biết mmuối và manion gốc axit ⇒ mkim loại
→ Biết manion gốc axit ⇒ lượng khí
VD: 2HCl → H2 ⇒ nH2 = 2nCl-
+ Bài toán khử oxit kim loại bằng CO; H2:
Ta có: oxit + CO(H2) → c/rắn + hỗn hợp khí ( CO, CO2 hoặc H2O, H2)
Bản chất: CO + [O]oxit → CO2
H2 + [O]oxit → H2O
⇒ mrắn = moxit – mO
nO oxit = nCO2 (= nH2O)
+ Bài toán tạo muối tác dụng với axit; hoặc muối tác dụng với muối; hoặc muối tác dụng với kiềm tạo ra khí hoặc kết tủa
mdung dịch thu được = mtham gia – m khí ( hoặc kết tủa)
+ Các bài toán về nhiệt phân; điện phân: Nhiệt phân muối cacbonat, muối nitrat, hiđroxit,… Điện phân dung dịch muối ăn, điện phân nóng chảy,…
mc/rắn sau = mban đầu – mkhí
mdung dịch sau = mdung dịch ban đầu – mkhí
+ Bài toán về nhiệt nhôm: Al + Oxit kim loại → Kim loại + Al2O3
Ví dụ minh họa
Ví dụ 1: Cho 50g dung dịch BaCl2 20,8% vào 100g dung dịch Na2CO3, lọc bỏ kết tủa thu được dung dịch X. Tiếp tục cho 50g dung dịch H2SO4 9,8% dung dịch X thấy thoát ra 0,448 lít khí (đktc). Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của dung dịch Na2CO3 và khối lượng dung dịch sau cùng là:
A. 8,15% và 198,27%
B. 7,42% và 189,27% gam
C. 6,65% và 212,5g
D. 7,42% và 286,72 gam
Giải:

Ví dụ 2: Cho V lít CO ở (đktc) phản ứng với 1 lượng dư hỗn hợp chất rắn gồm Cu và Fe3O4 nung nóng . Sau khi phản ứng hoàn toàn khối lượng chất rắn giảm 0,32 gam. Giá trị của V là?
A. 0,112 lít
B. 0,224 lít
C. 0,448 lít
D. 0,56 lít
Giải:
Vì Cu không phản ứng với CO nên trước và sau phản ứng khối lượng không thay đổi, nên khối lượng giảm 0,32 g là do CO khử oxit sắt lấy oxi trong oxit
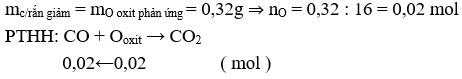
⇒ VCO = 0,02.22,4 = 0,448 l
⇒ Đáp án C
Ví dụ 3: Cho m gam bột Cu vào 200ml dung dịch AgNO3 0,2M, sau phản ứng thu được 3,88 gam chất rắn X và dung dịch Y. Cho 2,925 gam bột Zn vào dung dịch Y sau phản ứng thu được 5,265 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất. Giá trị của m là :
A. 3,17
B. 2,56
C. 1,92
D. 3,2.
Giải:
Khi Cu tác dụng với dung dịch AgNO3 có thể Cu dư hoặc hết ;
Khi cho Zn vào dung dịch Y sau phản ứng chỉ chứa 1 muối duy nhất ⇒ Zn dư hoặc phản ứng vừa đủ với muối.
Bảo toàn N ta có: nZn(NO3)2 = ½ nAgNO3 = 0,04 mol
Với bài toán này chúng ta không xác định được cụ thể các chất dư hay hết, nên ta sẽ sử đụng định luật bảo toàn khối lượng:
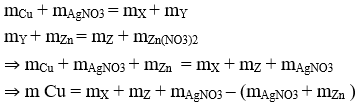
⇒ m = 3,88 + 0,02.189 + 5,265 – (0,04.170 - 2,925) = 3,2 gam. ⇒ Đáp án D
Ví dụ 4: Điện phân dung dịch chứa CuSO4 và KCl với điện cực trơ đến khi thấy khí bắt đầu thoát ra ở cả hai điện cực thì dừng lại thấy có 448ml khí (đktc) thoát ra ở anot. Dung dịch sau khi điện phân có thể hòa tan tối đa 0,8g MgO. Khối lượng dung dịch sau điện phân đã giảm bao nhiêu gam ( coi lượng H2O bay hơi là không đáng kể)
A. 2,7
B. 1,03
C. 2,95
D. 2,89
Giải:
CuSO4 + 2KCl 
Dung dịch sau điện phân có thể hòa tan được 0,8g MgO ⇒ Trong phản ứng (1) CuSO4 còn dư
⇒ Trong dung dịch sau điện phân còn H2SO4; nMgO = nH2SO4 = 0,2 mol
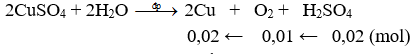
448ml khí thoát ra ở anot gồm: Cl2 và O2
nO2 + nCl2 = 0,02 mol ⇒ nCl2 = 0,02 – 0,01 = 0,01 mol
Từ (1) ⇒ n Cu = n Cl2 = 0,01 mol
⇒ nCu = 0,02 + 0,01 = 0,03 mol
Áp dụng định luật bảo toàn khối lượng:
mdung dịch giảm = mCu + mCl2 + mO2 = 0,03.64 + 0,01.71 + 0,01.32 = 2,95g
⇒ Đáp án C
Ví dụ 5: Hòa tan hoàn toàn 8,9g hỗn hợp 2 kim loại bằng dung dịch HCl dư được 4,48 lít (đktc). Cô cạn dung dịch thu được sau phản ứng thì lượng muối khan thu được là:
A. 23,1g
B. 46,2g
C. 70,4g
C. 32,1g
Giải:
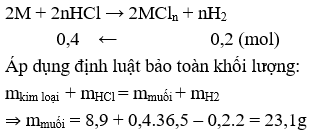
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Nhiệt phân hoàn toàn 80g một loại quặng đôlômit có lẫn tạp chất trơ, hòa tan chất rắn vào nước dư thấy còn lại 22,4 gam chất rắn không tan. Thành phần % khối lượng của tạp chất trong quặng nêu trên là:
A. 8%.
B. 25%.
C. 5,6%.
D. 12%.
Lời giải:
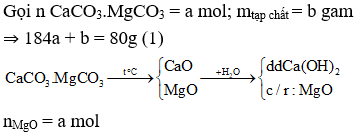
22,4g gam chất rắn gồm MgO và tạp chất. Bảo toàn khối lượng ta có:
⇒ 40a + b = 22,4 (2)
Từ (1)(2) ⇒ a = 0,4; b = 6,4
%m tạp chất = 6,4/80.100% = 8% ⇒ Đáp án A
Bài 2: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4. và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A:
A. 44,8%.
B.50%.
C.32%.
D.25,6%.
Lời giải:
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
Bảo toàn khối lượng ta có:
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)

Bài 3: Cho hỗn hợp X gồm Fe3O4 và Fe2O3 vào dung dịch H2SO4 loãng dư thu được dung dịch X trong đó số mol Fe2(SO4)3 gấp 2 lần số mol FeSO4. Mặt khác, hòa tan hoàn toàn 39,2 gam hỗn hợp X trong H2SO4 đặc, nóng thu được bao nhiêu lít SO2 (đktc)?
A. 1,68 lít.
B. 3,36 lít.
C. 1,12 lít.
D. 2,24 lít.
Lời giải:
Quy đổi hỗn hợp X gồm a mol Fe2O3 và b mol FeO
⇒nFe2(SO4)3 = a và nFeSO4 = b
Theo giả thiết a = 2b ⇒hỗn hợp X gồm 2b mol Fe2O3 và b mol FeO.
Trong 39,2 gam hỗn hợp X gồm 2b’ mol Fe2O3 và b’ mol FeO ⇒ 320b'+72b' = 39,2
⇒ b’ = 0,1 ⇒nFeO = 0,1
Bảo toàn e:
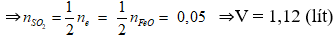
Bài 4: Cho 39,2 gam hỗn hợp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu (trong đó oxi chiếm 18,367% về khối lượng) tác dụng vừa đủ với 850 ml dung dịch HNO3 nồng độ a mol/l, thu được 0,2 mol NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
A.2,0.
B. 1,5.
C.3,0.
D.1,0.
Lời giải:
Coi M gồm a mol Fe, b mol Cu và 0,45 mol O
Bảo toàn khối lượng và bảo toàn e ta có:

⇒ a = 2 ⇒ Đáp án A
Bài 5: Cho m gam bột Fe vào 50 ml dung dịch Cu(NO3)2 1M, sau phản ứng thu được dung dịch X và 4,88 gam chất rắn Y. Cho 4,55 gam bột Zn vào dung dịch X, kết thúc phản ứng thu được 4,1 gam chất rắn Z và dung dịch chứa một muối duy nhất. Giá trị của m là
A. 4,48.
B. 2,80.
C. 5,60.
D. 8,40.
Lời giải:
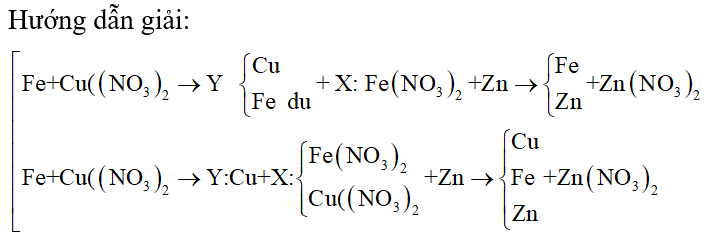
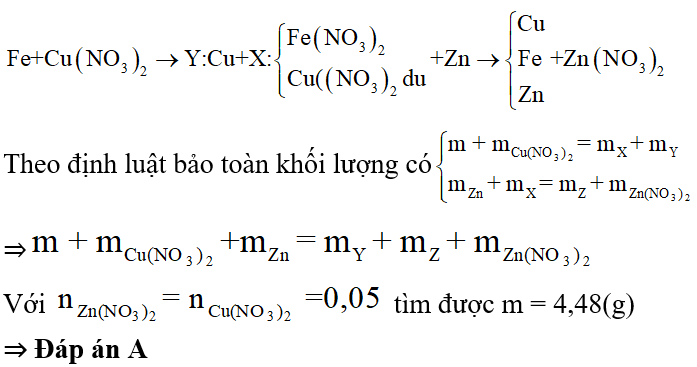
Bài 6: Lấy V (ml) dung dịch H3PO4 35% (d = 1,25 g/ml) đem trộn với 200 ml dung dịch KOH 1M thu được dung dịch chứa 14,95 (g) muối. Giá trị V là:
A. 18,48 (ml).
B. 16,8 (ml).
C. 25(ml).
Lời giải:
Dung dịch chỉ chứa muối nên KOH và H3PO4 hết.
nH2O tách ra = nOH- = 0,2 mol
Bảo toàn khối lượng ta có:
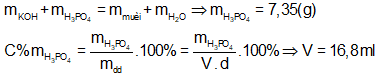
⇒ Đáp án B
Bài 7: Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí) hỗn hợp X gồm Al và Fe3O4 sau một thời gian thu được m gam hỗn hợp Y. Chia Y thành hai phần bằng nhau. Phần 1 tác dụng vừa đủ với 100 ml dung dịch NaOH 0,5M. Phần 2 tác dụng hết với dung dịch HNO3 đặc nóng, dư thu được 3,696 lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
A.4,83.
B.8,46.
C.9,66.
D.19,32.
Lời giải:
Coi hỗn hợp X ban đầu cũng như hỗn hợp Y gồm a mol Al và 3b mol Fe, 4b mol O.
Ở mỗi phần có nAl = 0,5a = nNaOH = 0,05 nên a = 0,1.
Áp dụng định luật bảo toàn mol electron cho phần 2 có: 3nFe + 3nAl = 2nO + nNO2
hay 4,5b + 1,5a = 4b + 0,165 ⇒ b = 0,03.
Bảo toàn khối lượng ta có: m = mFe +mO + mAl = 9,66 (gam) ⇒ Đáp án C
Bài 8: Cho 2,16 gam hỗn họp gồm Al và Mg tan hết trong dung dịch axit HNO3 loãng, đun nóng nhẹ tạo ra dung dịch X và 448 ml (đo ở 354,9°K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so vói oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi thu được 3,84 gam chất rắn T. Giá trị của m là
A. 15,18.
B. 17,92.
C. 16,68.
C. 15,48.
Lời giải:


Do đó muối Z gồm 0,04 mol Al(NO3)3; 0,045 mol Mg(NO3)2 và 3,75.10-3 mol NH4NO3.
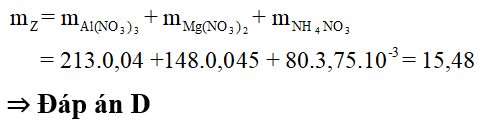
Bài 9: Nung m gam hỗn hợp bột gồm Al và FexOy trong điều kiện không có không khí cho đến khi phản ứng hoàn toàn thu đươc hỗn hợp X. Trộn đều X, chia X thành 2 phân. Phần 1 (có khối lượng 14,49 gam) hòa tan hết trong HNO3 dư thu đươc 0,165 mol khí NO (sản phẩm khử duy nhất của N+5). Phần 2 tác dụng hết với dung dịch NaOH, t° thấy giải phóng 0,015 mol H2 và còn lại 2,52 gam chất rắn. Công thức sắt oxit và giá trị m là:
A.Fe2O3; 19,32 (g).
B. Fe3O4; 28,98 (g).
C. Fe2O3; 28,98 (g).
D. Fe3O4; 19,32 (g).
Lời giải:
Do phần 2 có H2 bay ra nên Al dư.
Hỗn hợp X gồm: x (mol) Al, y (mol) Fe, z (mol) Al2O3
- Xét phần 1: nAl = x1; nFe =y1
Bảo toàn e ta có: 3nNO = 3nFe + 3nAl ⇒ x1 + y1 = 0,165 (mol)
- Xét phần 2: Chất rắn là Fe.
Ta có nFe = y2 = 0,045 (mol)
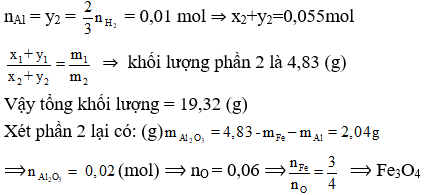
⇒ Đáp án D
Bài 10: Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200ml dung, dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A.2,58g.
B.2,22g.
C.2,31 g.
C.2,44g.
Lời giải:

⇒ Đáp án C

