Bài tập về Crom (Cr) cực hay, có lời giải chi tiết - Hoá học lớp 12
Bài tập về Crom (Cr) cực hay, có lời giải chi tiết
Với Bài tập về Crom (Cr) cực hay, có lời giải chi tiết Hoá học lớp 12 tổng hợp 30 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Crom (Cr) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Bài 1: Cấu hình electron không đúng là (biết Cr có Z = 24)
A. Cr: [Ar] 3d5 4s1. B. Cr: [Ar] 3d4 4s2.
C. Cr2+: [Ar] 3d4. D. Cr3+: [Ar] 3d3.
Lời giải:
Đáp án: B
Ta có cấu hình electron của Cr: [Ar] 3d5 4s1
→ Cr2+: [Ar] 3d4
→ Cr3+: [Ar] 3d3.
Bài 2: Vị trí của Crom (z = 24) trong bảng tuần hoàn là
A. ô 24, chu kỳ 4, nhóm VIA.
B. ô 24, chu kỳ 4, nhóm VIB.
C. ô 24, chu kỳ 4, nhóm IB.
D. ô 24, chu kỳ 4, nhóm IIB.
Lời giải:
Đáp án: B
Ta có cấu hình electron của Cr: [Ar] 3d5 4s1
→ Crom ở ô thứ 24 do z = 24, chu kỳ 4 do có 4 lớp electron, nhóm VIB do có 6 electron hóa trị, nguyên tố d.
Bài 3: Các số oxi hóa phổ biến của crom trong hợp chất là
A. +2, +4 và +6. B. +2, +3 và +6.
C. +1, +3 và +6. D. +3, +4 và +6.
Lời giải:
Đáp án: B
Trong hợp chất Cr có số oxi hóa biến đổi từ + 1 đến +6, trong đó phổ biến nhất là các số oxi hóa +2, +3 và +6.
Bài 4: Nhận xét nào không đúng về tính chất vật lý của crom?
A. Crom có màu trắng ánh bạc.
B. Crom cứng nhất trong số các kim loại.
C. Crom khó nóng chảy.
D. Crom là kim loại nhẹ.
Lời giải:
Đáp án: D
Crom là kim loại nặng.
Bài 5: Nhận định nào sau đây là đúng?
A. Crom có tính khử mạnh hơn sắt.
B. Crom chỉ tạo được oxit bazơ.
C. Trong tự nhiên, crom có ở dạng đơn chất.
D. Phương pháp thường dùng để điều chế crom là điện phân Cr2O3.
Lời giải:
Đáp án: A
B sai vì crom có thể tạo oxit lưỡng tính.
C sai vì trong tự nhiên crom chỉ có ở dạng hợp chất.
D sai vì phương pháp thường dùng để điều chế crom là phương pháp nhiệt nhôm.
Bài 6: Ứng dụng nào sau đây không phải của crom?
A. Crom là kim loại rất cứng có thể dùng để cắt thủy tinh.
B. Crom dùng để tạo thép cứng, không gỉ, chịu nhiệt.
C. Crom là kim loại nhẹ, được sử dụng tạo các hợp kim của ngành hàng không.
D. Điều kiện thường, crom tạo lớp màng oxit mịn, bền được dùng để mạ bảo vệ thép.
Lời giải:
Đáp án: C
Crom là kim loại nặng.
Bài 7: Kim loại không tác dụng với nước ở nhiệt độ thường là
A. Al và Ba. B. Mg và Ca.
C. Cr và Sr. D. Cr và Be.
Lời giải:
Đáp án: D
Cr và Be không tác dụng với nước ở nhiệt độ thường.
Bài 8: Ở nhiệt độ thường, crom có cấu trúc mạng tinh thể là
A. lập phương tâm diện. B. lập phương.
C. lập phương tâm khối. D. lục phương.
Lời giải:
Đáp án: C
Crom có cấu trúc mạng tinh thể lập phương tâm khối.
Bài 9: Hiện nay, từ quặng cromit người ta điều chế Cr bằng phương pháp nào?
A. Tách quặng rồi thực hiện điện phân nóng chảy Cr2O3.
B. Tách quặng rồi thực hiện phản ứng nhiệt nhôm Cr2O3.
C. Tách quặng rồi thực hiện phản ứng khử Cr2O3 bởi CO.
D. hòa tan quặng bằng HCl rồi điện phân dung dịch CrCl3.
Lời giải:
Đáp án: B
Cr2O3 được tách ra từ quặng, sau đó thực hiện phản ứng nhiệt nhôm để điều chế Cr.
Bài 10: Cr không phản ứng với axit nào sau đây?
A. HCl loãng, nóng. B. H2SO4 loãng, nóng.
C. H2SO4 đặc, nóng. D. H2SO4 đặc, nguội.
Lời giải:
Đáp án: D
Cr thụ động trong H2SO4 đặc, nguội.
Bài 11: Quặng phổ biến nhất của crom là?
A. Pirit. B. Canxit.
C. Cromit. D. Đolomit.
Lời giải:
Đáp án: D
Quặng phổ biến nhất của crom là cromit.
Bài 12: Đốt cháy hoàn toàn bột crom trong oxi dư thu được 4,56 gam một oxit duy nhất. Khối lượng crom bị đốt cháy là
A. 0,78g. B. 3,12g.
C. 1,74g. D. 1,19g.
Lời giải:
Đáp án: B
4Cr (0,06) + 3O2 → 2Cr2O3 (0,03 mol)
→ mCr = 0,06.52 = 3,12 gam.
Bài 13: Hòa tan hết 2,16 gam hỗn hợp Cr và Fe trong dung dịch HCl đun nóng thu được 896 ml khí ở đktc. Khối lượng crom trong hỗn hợp ban đầu là
A. 0,065g. B. 1,040g.
C. 0,560g. D. 1,015g.
Lời giải:
Đáp án: B
Gọi số mol của Cr và Fe lần lượt là x và y mol
→ 52x + 56y = 2,16
PTHH:
Cr (x) + 2HCl → CrCl2 + H2 (x mol)
Fe (y) + 2HCl → FeCl2 + H2 (y mol)
nkhí = x + y = 0,04
Giải hệ phương trình được x = y = 0,02.
Vậy mCr = 0,02.52 = 1,04 gam.
Bài 14: Trong số các cặp kim loại sau đây, cặp nào bền vững trong môi trường không khí và nước nhờ có màng oxit bảo vệ?
A. Cu và Al. B. Al và Cr.
C. Fe và Al. D. Fe và Cr.
Lời giải:
Đáp án: B
Al và Cr bền vững trong môi trường không khí và nước do có màng oxit bảo vệ.
Bài 15: Cho m gam Cr tác dụng hoàn toàn với dung dịch HCl nóng, dư thu được 6,72 lít khí H2 (đktc). Giá trị của m là
A. 7,8 gam B. 15,6 gam
C. 10,4 gam D. 5,2 gam.
Lời giải:
Đáp án: B
Cr (0,3) + 2HCl → CrCl2 + H2 (0,3 mol)
→ m = 0,3.52 = 15,6 gam.
Bài 16: Dung dịch HCl, H2SO4 loãng sẽ oxi hóa crom đến mức oxi hóa nào?
A. +2. B. +6.
C. +3. D. +4.
Lời giải:
Đáp án: A
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Sau phản ứng Cr có số oxi hóa +2.
Bài 17: Cho 5,2g Cr tác dụng với HNO3 loãng dư thu được V lít khí NO (đktc, sản phẩm khử duy nhất). V có giá trị là
A. 2,24. B. 3,36.
C. 4,48. D. 6,72.
Lời giải:
Đáp án: A
Cr (0,1) + 4HNO3 → Cr(NO3)3 + NO (0,1 mol) + 2H2O
V = 0,1.22,4 = 2,24 lít.
Bài 18: Cho 100 gam hợp kim của Fe, Cr, Al tác dụng với dung dịch NaOH dư thoát ra 5,04 lít khí (đktc) và một phần rắn không tan. Lọc lấy phần không tan đem hòa tan hết bằng dung dịch HCl nóng, dư thấy thoát ra 38,8 lít khí (đktc). Phần trăm khối lượng các chất trong hợp kim là
A. 13,66% Al; 82,29% Fe và 4,05% Cr.
B. 4,05% Al; 83,66% Fe và 12,29% Cr.
C. 4,05% Al; 82,29% Fe và 13,66% Cr.
D. 4,05% Al; 13,66% Fe và 82,29% Cr.
Lời giải:
Đáp án:
Gọi số mol Fe, Cr và Al lần lượt là x, y và z mol
→ 56x + 52y + 27z = 100 (1)
Cho hợp kim tác dụng với NaOH chỉ có Al phản ứng:
2Al (0,15) + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (0,225 mol)
→ z = 0,15
Sau phản ứng còn Fe, Cr cho vào HCl nóng, dư có phản ứng
Cr (y) + 2HCl → CrCl2 + H2 (y mol)
Fe (x) + 2HCl → FeCl2 + H2 (x mol)
→ x + y = 1,7321
Giải hệ pt được x = 1,4702; y = 0,2691; z = 0,15.
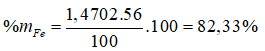
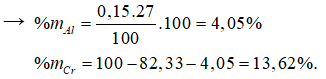
Bài 19: Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là
A. Fe, Al và Cr. B. Fe, Al và Zn.
C. Mg, Al và Cu. D. Fe, Zn và Cr.
Lời giải:
Đáp án: A
Fe, Al và Cr bị thụ động trong HNO3 đặc nguội.
Bài 20: Cho 10,8 g hỗn hợp Cr và Fe tác dụng hoàn toàn với dung dịch HCl nóng, dư thu được 4,48 lít khí (đktc). Tổng khối lượng muối thu được trong dung dịch sau phản ứng là
A. 18,7g. B. 25,0g.
C. 19,7g. D. 16,7g.
Lời giải:
Đáp án: B
Bảo toàn H có nHCl = 2.nkhí = 2.0,2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mKL + maxit = mmuối + mkhí
→ mmuối = 10,8 + 0,4.36,5 – 0,2.2 = 25 gam.

