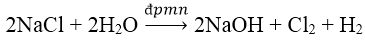Các dạng bài tập Kim loại kiềm, kim loại kiềm thổ, nhôm chọn lọc có đáp án chi tiết - Hoá học lớp 12
Các dạng bài tập Kim loại kiềm, kim loại kiềm thổ, nhôm chọn lọc có đáp án chi tiết
Với Các dạng bài tập Kim loại kiềm, kim loại kiềm thổ, nhôm chọn lọc có đáp án chi tiết Hoá học lớp 12 tổng hợp các dạng bài tập, 300 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Kim loại kiềm, kim loại kiềm thổ, nhôm từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Tổng hợp Lý thuyết chương Kim loại kiềm, kim loại kiềm thổ, nhôm
- Lý thuyết Tính chất của Kim loại kiềm Xem chi tiết
- Lý thuyết Tính chất của Kim loại kiềm thổ Xem chi tiết
- Lý thuyết Tính chất của Nhôm Xem chi tiết
- Lý thuyết về các hợp chất quan trọng của kim loại kiềm Xem chi tiết
- Lý thuyết về các hợp chất quan trọng của kim loại kiềm thổ Xem chi tiết
- Lý thuyết về tính chất của kim loại kiềm, kim loại kiềm thổ Xem chi tiết
- Lý thuyết về các hợp chất quan trọng của nhôm Xem chi tiết
- Lý thuyết về Tính chất của nhôm và hợp chất của nhôm Xem chi tiết
Phương pháp giải Các dạng bài tập chương Kim loại kiềm, kim loại kiềm thổ, nhôm
- 6 dạng bài tập Kim loại kiềm, kiềm thổ, nhôm trong đề thi Đại học có giải chi tiết Xem chi tiết
- Dạng 1: Tính chất chung của kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 2: Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 3: Nhận biết, điều chế kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 4: Bài toán xác định tên kim loại Xem chi tiết
- Dạng 5: CO2, SO2 tác dụng với dung dịch kiềm Xem chi tiết
- Dạng 6: Tính lưỡng tính của nhôm Xem chi tiết
- Dạng 7: Phản ứng nhiệt nhôm Xem chi tiết
- Dạng 8: Các dạng bài tập về muối cacbonat Xem chi tiết
- Dạng 9: Các dạng bài tập về nước cứng Xem chi tiết
- Bài tập về Hợp chất của kim loại kiềm thổ cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của kim loại kiềm cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của nhôm cực hay, có lời giải chi tiết
- Bài tập về Kim loại kiềm thổ cực hay, có lời giải chi tiết
- Bài tập về Kim loại kiềm cực hay, có lời giải chi tiết
- Bài tập về Nhôm cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (cơ bản) Xem chi tiết
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (nâng cao) Xem chi tiết
Cách giải bài tập về Tính chất chung của kim loại kiềm, kiềm thổ, nhôm hay, chi tiết
Lý thuyết và Phương pháp giải
Đề làm tốt dạng bài này cần nắm vững các tính chất vật lý, hóa học và phương pháp điều chế kim loại kiềm, kiềm thổ, nhôm và các hợp chất của chúng.
Bài 1: Phát biểu nào sau đây không đúng về kim loại kiềm?
A. Nhiệt độ nóng chảy và nhiệt độ sôi thấp.
B. Khối lượng riêng nhỏ.
C. Độ cứng giảm dần từ Li đến Cs
D. Mạng tinh thể của kim loại kiềm là lập phương tâm diện.
Bài 2: Chọn phát biểu đúng:
A. Dung dịch Na2CO3 có tính kiềm mạnh.
B. Dung dịch Na2CO3 có môi trường trung tính có Na2CO3 là muối trung hòa.
C. Dung dịch chứa Na2CO3 có môi trường axit do Na2CO3 là muối của axit yếu.
D. Na2CO3 dễ bị phân hủy khi đung nóng.
Bài 3: Để bảo quản kim loại kiềm người ta thường làm như thế nào?
A. Để trong bình kín.
B. Để trong bóng tối.
C. Ngâm trong dầu hỏa.
D. Để nơi thoáng mát.
Bài 4: Trường hợp nào sau đây không có sự tạo thành Al(OH)3:
A. Cho dung dịch NH3 vào dung dịch AlCl3
B. Cho Al2O3 vào nước.
C. Cho Al4C3 vào nước.
D. Cho dung dịch Na2CO3 vào dung dịch AlCl3.
Bài 5: Phương pháp chung để điều chế kim loại kiềm là
A. Thủy luyện
B. Điện phân dung dịch
C. Nhiệt luyện
D. Điện phân nóng chảy.
Bài 6: Phát biểu nào không đúng?
A. Tất cả các kim loại kiềm thổ đều tác dụng với dung dịch HCl.
B. Tất cả các kim loại kiềm thổ đều tác dụng với nước.
C. Tất cả các kim loại kiềm thổ đều tác dụng với oxi ở nhiệt độ cao.
D. Tất cả các kim loại kiềm thổ đều tác dụng với dung dịch HNO3 đặc, nguội.
Bài 7: Phản ứng điều chế NaOH trong công nghiệp là:
A. 2Na + 2H2O → 2NaOH + H2
B. 2NaCl + 2H2O →2NaOH 2 Cl2 + H2
C. Na2O + H2O → 2NaOH
D. Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4.
Bài 8: Phản ứng nhiệt phân nào sau đây không xảy ra?
A. Mg(OH)2 → MgO + H2O
B. 2NaHCO3 → Na2CO3 + CO2 + H2O
C. K2CO3 → K2O + CO2
D. 2NaNO3 → 2NaNO2 + O2
Bài 9: Cho viên Na vào dung dịch CuSO4, hiện tượng quan sát được là:
A. Bọt khí.
B. Bọt khí và kết tủa màu xanh.
C. Kết tủa màu đỏ.
D. Bọt khí và kết tủa màu đỏ.
Bài 10: Cho dần dần đến dư dung dịch HCl vào dung dịch NaAlO2, hiện tượng quan sát được là:
A. Có kết tủa trắng keo xuất hiện, kết tủa không tan.
B. Không có hiện tượng.
C. Có kết tủa trắng keo xuất hiện, sau đó kết tủa tan một phần.
D. Có kết tủa trắng keo xuất hiện, sau đó kết tủa tan hết.
Bài 11: Chỉ ra phát biểu sai.
A. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
B. Năng lượng ion hóa thứ nhất giảm dần từ Be đến Ba.
C. Ở nhiệt độ thường Be không phản ứng với nước còn Mg thì phản ứng chậm.
D. Các kim loại kiềm thổ đều nhẹ hơn nhôm.
Bài 12: Cho các chất: NaHCO3 , CO, Al(OH)3, Fe(OH)3, HF, Cl2, NH4Cl. Số chất tác dụng được với dung dịch NaOH loãng ở nhiệt độ thường là:
A. 4 B. 5 C. 3 D. 6
Bài 13: Phản ứng giải thích sự tạo thành thạch nhũ trong các hang động là:
A. CaCO3 → CaO + CO2
B. Ca(OH)2 + 2CO2 → Ca(HCO3)2
C. Ca(HCO3)2 → CaCO3 + CO2 + H2O
D. CaCO3 + H2O + CO2 → Ca(HCO3)2
Bài 14: Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
A. 4 B. 7 C. 5 D. 6
Bài 15: Chất nào sau đây làm mềm nước vĩnh cửu (chứa CaCl2, MgSO4)?
A. Ca(OH)2
B. Na2CO3
C. NaOH
D. H2SO4
Bài 16: Dẫn từ từ khí CO2 vào dung dịch Ca(OH)2 cho đến dư, sau đó lại đun nóng dung dịch sản phẩm thu được. Vậy hiện tượng quan sát được là:
A. Ban đầu xuất hiện kết tủa trắng, sau đó kết tủa tăng dần đến cực đại.
B. Ban đầu xuất hiện kết tủa trắng, sau đó kết tủa tan dần, khi đun nón dung dịch thì kết tủa lại xuất hiện.
C. Ban đầu xuất hiện kết tủa trắng, sau đó kết tủa tan dần dung dịch có màu xanh, khi đun nóng dung dịch thì kết tủa lại xuất hiện và có khí bay ra.
D. Ban đầu xuất hiện kết tủa trắng, sau đó kết tủa tan dần dung dịch trở nên trong suốt, khi đun nóng dung dịch thì kết tủa lại xuất hiện và có khí bay ra.
Đáp án và hướng dẫn giải
| 1 - D | 2 - A | 3 - C | 4 - B | 5 - D | 6 - B | 7 - B | 8 - C |
| 9 - B | 10 - D | 11 - D | 12 - B | 13 - C | 14 - D | 15 - B | 16 - D |
Bài 1:
Kim loại kiềm có cấu trúc mạng tinh thể theo kiểu lập phương tâm khối.
Bài 4:
Al2O3 không tan trong nước
PT: AlCl3 + 3H2O + 3NH3 → Al(OH)3 + 3NH4Cl
12H2O + Al4C3 → 4Al(OH)3 + 3CH4
2AlCl3 + 3H2O + 3Na2CO3 → 2Al(OH)3 + 6NaCl + 3CO2
Bài 6:
Be không tác dụng với nước.
Bài 9:
PT: 2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4
Bài 10:
PT: HCl + NaAlO2 + H2O → Al(OH)3↓ + NaCl
Al(OH)3 + 3HCl (dư) → AlCl3 + 3H2O.
Bài 11:
Ba nặng hơn Al vì có D = 3,5g/cm3 > DAl = 2,7g/cm3 .
Bài 12:
Các chất: NaHCO3, Al(OH)3, HF, Cl2, NH4Cl tác dụng được với dung dịch NaOH loãng ở nhiệt độ thường:
NaHCO3 + NaOH → Na2CO3 + H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
HF + NaOH → NaF + H2O
Cl2 + NaOH → NaClO + NaCl + H2O
NH4Cl + NaOH → NaCl + NH3 + H2O
Bài 14:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → 4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3↓ + CaCO3↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
Bài 16:
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
CO2 + H2O + CaCO3 ↓ → Ca(HCO3)2
Ca(HCO3)2 −tº→ CaCO3 + CO2↑ + H2O
Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm cực hay
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Để làm tốt dạng bài tập này cần nằm vững tính chất hóa học của đơn chất, hợp chất của kim loại kiềm, kiềm thổ, nhôm và sự chuyển hóa giữa chúng. Đặc biệt lưu ý đến các tính chất đặc biệt như tính lưỡng tính của nhôm, trình tự phản ứng của các chất. Cần xác định loại phản ứng, có sự thay đổi số oxi hóa hay không để lựa chọn chất cần phản ứng cho thích hợp.
Ví dụ minh họa
Bài 1: Chọn X, Y, Z, T, E- theo đúng trật tự tương ứng trong sơ đồ sau:
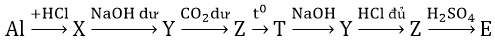
Hãy viết các phản ứng theo sơ đồ trên.
Hướng dẫn:
Phản ứng
2Al + 6HCl → 2AlCl3 + 3H_2
AlCl3 + 4NaOH → NaAlO2+ 3NaCl + 2H2O
NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
2Al(OH)3 −tº→ Al2O3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
H2O + NaAlO2 + HCl → Al(OH)3 + NaCl
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Bài 2: Ion Na+ có tồn tại hay không, nếu ta thực hiện các phản ứng hóa học sau:
a. NaOH tác dụng với dung dịch HCl.
b. NaOH tác dụng với dung dịch CuCl2.
c. Phân hủy NaHCO3 bằng nhiệt.
d. Điện phân NaOH nóng chảy.
e. Điện phân NaCl nóng chảy.
Hướng dẫn:
a. Có, vì: NaOH + HCl → NaCl + H2O
b. Có, vì: 2NaOH + CuCl2 → 2NaCl + Cu(OH)2
c. Có, vì: 2NaHCO3 −tº→ Na2CO3 + H2O + CO2↑
d. Không, vì: 4NaOH → 4Na + 2H2O + O2↑
e. Không, vì: 2NaCl → 2Na + 2Cl2↑
Bài 3: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
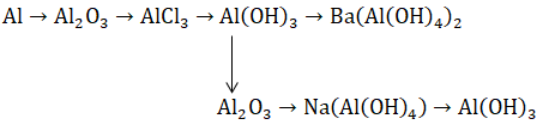
Hướng dẫn:
(1) 4Al + 3O2 → 2AlCl3 + 3H2
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
(4) 2Al(OH)3 + Ba(OH)2 → Ba(Al(OH)4)2
(5) 2Al(OH)3 −tº→ Al2O3 + 3H2O
(6) Al2O3 + 2NaOH + 3H2O → 2Na(Al(OH)4)
(7) Na(Al(OH)4) + CO2 → NaHCO3 + Al(OH)3
B. Bài tập trắc nghiệm
Bài 1: Viết phương trình phản ứng để giải thích hiện tượng xảy ra khi:
a. Cho dd NH3 dư vào dd AlCl3.
b. Cho từ từ dd NaOH đến dư vào dd AlCl3.
c. Cho từ dd Al2(SO4)3 vào dd NaOH và ngược lại.
Lời giải:
Đáp án:
a) Cho dd NH3 dư vào dd AlCl3.
Xuất hiện kết tủa keo trắng Al(OH)3
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
b) Cho từ từ dd NaOH đến dư vào dd AlCl3.
Ban đầu xuất hiện kết tủa trắng keo Al(OH)3, sau đó kết tủa tan ra dung dịch trở lại trong suốt.
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → Na[Al(OH)4]
c) Cho từ dd Al2(SO4)3 vào dd NaOH và ngược lại.
Nếu cho từ từ dung dịch Al2(SO4)3 vào dung dịch NaOH xuất hiện kết tủa Al(OH)3 sau đó kết tủa tan ngay.
Ngược lại cho từ từ dung dịch NaOH vào dung dịch Al2(SO4)3 ban đầu sẽ có kết tủa keo trắng Al(OH)3, sau đó khi dư NaOH thì kết tủa tan ra.
Al2(SO4)3 + 6NaOH → 3Na2SO4 + 2Al(OH)3↓
Al(OH)3 + NaOH → Na[Al(OH)4]
Bài 2: Cho sơ đồ chuyển hóa sau:
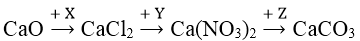
Công thức của X, Y, Z lần lượt là:
A. Cl2, AgNO3, MgCO3.
B. Cl2, HNO3, CO2.
C. HCl, HNO3, NaNO3.
D. HCl, AgNO3, (NH4)2CO3.
Lời giải:
Đáp án: D
- Đáp án A: Cl2, AgNO3, MgCO3: không xảy ra.
- Đáp án B: Cl2. HNO3, CO2: không xảy ra.
- Đáp án C: CaO + 2HCl → CaCl2 + H2O
CaCl2 + HNO3: không xảy ra
- Đáp án D: CaO + 2HCl → CaCl2 + H2O
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl
Ca(NO3)2 + (NH4)2CO3 → CaCO3↓ + 2NH4NO3
Bài 3: Hòa tan hỗn hợp gồm: K2O, BaO, Al2O3, Fe3O4 vào nước (dư) thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là:
A. K2CO3 B. Fe(OH)3 C. Al(OH)3 D. BaCO3
Lời giải:
Đáp án:C
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + 2OH- → 2AlO-2 + H2O
Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO-2.
AlO-2 + CO2 + 2H2O → Al(OH)3↓ + HCO-3
Bài 4: Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển đổi sau:
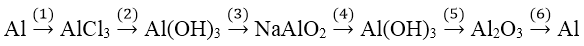
Lời giải:
Đáp án:
(1) 2Al + 6HCl → 2AlCl3 + 3H2
(2) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
(3) Al(OH)3 + NaOH → NaAlO2 + 2H2O
(4) NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3
(5) 2Al(OH)3 −tº, xt→ Al2O3 + 3H2O
(6) 2Al2O3 −đpnc→ 4Al + 3O2
Bài 5: Tùy thuộc nồng độ của dung dịch HNO3, kim loại nhôm có thể khử HNO3 thành NO2, NO, N2 hoặc NH4NO3. Hãy viết phương trình hóa học của những phản ứng trên.
Lời giải:
Đáp án:
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Bài 6: Phản ứng nào sau đây không xảy ra:
A. CaO + CO2 → CaCO3
B. Ca(OH)2 + CO2 → CaCO3 + H2O
C. CaCl2 + MgCO3 → CaCO3 + MgCl2
D. CaO + H2O → Ca(OH)2
Lời giải:
Đáp án: C
Bài 7: Nung nóng từng cặp chất sau trong bình kín:
(1) H2(k) + CuO(r) ; (2) C (r) + KClO3; (3) Fe (r) + O2(r)
(4) Mg(r) + SO2(k); (5) Cl2(k) + O2(k); (6) K2O (r) + CO2(k)
Số trường hợp có phản ứng hóa học xảy ra là:
A. 4 B. 2 C. 3 D. 5
Lời giải:
Đáp án: D
(1) H2 + CuO → H2O + Cu
(2) 3C + 2KClO3 → 3 CO2 + 2KCl
(3) 3Fe + 2O2 → Fe3O4
(4) 2Mg + SO2 → 2MgO + S
(6) K2O + CO2 → K2CO3
Bài 8: Phản ứng vừa tạo kết tủa vừa có khi bay ra là:
A. FeSO4 + HNO3
B. KOH + Ca(HCO3)2
C. MgS + H2O
D. BaO + NaHSO4
Lời giải:
Đáp án: C
A. 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO ↑ + 2H2O
B. 2KOH + Ca(HCO3)2 → CaCO3↓ + K2CO3 + 2H2O
C. MgS + 2H2O → Mg(OH)2 ↓ + H2S↑
D. BaO + 2NaHSO4 → BaSO4↓ + Na2SO4 + H2O
Cách nhận biết, điều chế kim loại kiềm, kiềm thổ, nhôm hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Để làm tốt dạng bài tập này không những phải nắm vững tính chất hóa học của các phương trình phản ứng mà còn phản nắm vững hiện tượng kèm theo (có kết tủa, màu sắc kết tủa, bọt khí, ...).
Một số điểm đặc trưng:
- Ion kim loại kiềm: Hầu hết các muối kim loại kiềm đều tan trong các bài tập nhận biết thường dùng Phương pháp loại trừ để nhận ra muối của kim loại kiềm. Ngoài ra có thể nhận biết bằng màu ngọn lửa ion kim loại kiềm: muối của Na khi đốt cho ngọn lửa màu vàng, muối của K cho ngọn lửa màu hoa tím hoa cà...
- Ion kim loại kiềm thổ:
Mg2+: dùng ion OH- tạo Mg(OH)2kết tủa trắng.
Ca2+: dùng ion CO32- tạo BaCO3 kết tủa trắng, kết tủa này không tan trong axit HCl.
Ba2+: dùng ion SO42+ tạo BaSO4 kết tủa trắng, kết tủa này không tan trong axit HCl.
- Nhận biết Al3+: Dùng dung dịch kiềm mạnh, thấy tạo kết tủa keo trắng, sau đó kết tủa tan trong dung dịch kiềm dư:
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- → [Al(OH)4]-
- Tách và điều chế các chất:
+ Điều chế các kim loại kiềm, kiềm thổ phải dùng Phương pháp điện phân nóng chảy muối halogenua (muối clorua), do đó sau khi tách riêng phản chuyển các hợp chất của chúng về muối clorua. Ví dụ tách các hợp chất của Mg: chuyển thành Mg(OH)2, lọc tách kết tủa, sau đó cho tác dụng với HCl → MgCl2 −đpnc→ Mg
+ Tác nhôm và các hợp chất của Al: cho tác dung với dung dịch kiềm dư → dung dịch Na[Al(OH)4] −+ CO2 + H2O→) Al(OH)3 −tº→ Al2O3 −đpnc→ Al
Lưu ý: các chất khử thông thường như CO, H2 không khử được các oxit kim loại mạnh như Al2O3,MgO,...
Ví dụ minh họa
Bài 1: Để điều chế được kim loại kiềm người ta dùng phương pháp nào dưới đây?
A. Điện phân muối halogenua hoặc hiđroxit ở dạng nóng chảy.
B. Khử oxi của kim loại kiềm ở nhiệt độ cao.
C. Điện phân dung dịch muối halogenua.
D. Dùng kim loại kiềm mạnh hơn để đẩy kim loại yếu hơn ra khỏi dung dịch muối.
Hướng dẫn:
Đáp án A
Bài 2: Có 4 chất rắn đựng trong 4 lọ riêng biệt không nhãn: Na2CO3, CaCO3, Na2SO4 và CaSO4.H2O. Chỉ dùng cặp hóa chất nào sau đây có thể nhận được cả 4 chất trên?
A. H2O và Na2CO3.
B. H2O và HCl.
C. H2SO4 và BaCl2.
D. H2O và KCl.
Hướng dẫn:
Hòa tan vào nước ta chia làm 2 nhóm. Sau đó dùng HCl để nhận biết chất phản ứng với HCl tạo khí là muối CO3-2
Nhóm 1: Na2SO4 và Na2CO3
Nhóm 2: CaCO3 và CaSO4.H2O
PT: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chú ý: Muối cacbonat giải phóng khí CO2 khi tác dụng với axit.
Bài 3: Chỉ dùng thêm một kim loại phân biệt các dung dịch NaCl, MgCl2, FeCl2, FeCl3, CuSO4, (NH4)2SO4.
Hướng dẫn:
Chia nhỏ các dung dịch thành các phần có đánh số thứ tự. Cho kim loại Ba từ từ tới dư vào các dung dịch trên, các cốc đều có khí thoát ra:
Ba + H2O → Ba(OH)2 + H2↑
Và các hiện tượng sau:
- Cốc có kết tủa đỏ nâu là FeCl3
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2
- Cốc có kết tủa trắng xanh chuyển sang đỏ nâu là FeCl2:
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
- Cốc có kết tủa xanh là CuSO4: CuSO4 + Ba(OH)2 → Cu(OH)2↓ + BaSO4↓
- Cốc có kết tủa trắng không tan và có khí thoát ra có mùi khai là (NH4)2SO4:
(NH4)2SO4 + Ba(OH)2 → 2NH3↑ + BaSO4↓ + 2H2O
- Cốc có kết tủa trắng là MgCl2: MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2↓
- Cốc còn lại là dung dịch NaCl.
Bài 4: Cho các dung dịch đựng trong các lọ mất nhãn sau: NaCl, Na2CO3, Na2SO3, Na2S, HCl. Chỉ dùng một chất nào sau đây có thể nhận biết được cả 5 chất trên?
A. Quì tím B. H2SO4 C. Pb(NO3)2 D. BaCl2
Hướng dẫn:
Thí nghiệm trên từng lượng nhỏ hóa chất.
Cho quỳ tím vào từng dung dịch. HCl làm quì tím hóa đỏ, Na2CO3 làm quì tím hóa xanh.
Cho HCl vào 3 mẫu thử còn lai. Lọ có khí thoát ra có mùi trứng thối là N2S, lọ có khí mùi sốc là Na2SO3, lọ còn lại không hiện tượng là NaCl.
PTHH
2HCl + Na2S → 2NaCl + H2S
2HCl + Na2SO3 → 2NaCl + SO2 + H2O.
B. Bài tập trắc nghiệm
Bài 1: Thuốc thử dùng để nhận biết các dung dịch NaCl, CaCl2, MgCl2 là:
A. NaOH, HCl B. Quì tím, NaOH
C. NaOH, Na2CO3 D. Quì tím, HCl.
Lời giải:
Đáp án: C
- Cho NaOH lần lượt vào các mẫu thử. Có kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Tiếp tục cho Na2CO3 vào 2 mẫu thử còn lại ⇒ Xuất hiện tủa trắng là CaCl2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Bài 2: Thuốc thử dùng để nhận biết Na, Ca, Na2O là:
A. H2O, quỳ tím B. H2O, dung dịch Na2CO3
C. Dung dịch HCl, quì tím D. H2O, dung dịch HCl.
Lời giải:
Đáp án: B
- Lần lượt hòa tan các mẫu thử vào nước: tan và có khí thoát ra là Na và Ca; mẫu tan nhưng không có khí là Na2O.
PTHH: Ca + 2H2O → Ca(OH)2 + H2
Na + H2O → NaOH + 3/2H2
Na2O + H2O → 2NaOH
- Tiếp tục cho Na2CO3 vào dung dịch thu được từ 2 mẫu có khí thoát ra. Mẫu nào xuất hiện kết tủa là Ca(OH)2 ⇒ chất ban đầu là Ca.
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
Bài 3: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. Giấy quỳ tím B. Zn C. Al D. BaCO3
Lời giải:
Đáp án: D
Dùng quì tím: chỉ nhận biết được dung dịch KOH.
- Dùng Zn, Al: không nhận biết được.
- Dùng BaCO3:
+ Cho vào dung dịch KOH không có hiện tượng
+ Cho vào dung dịch HCl có khí bay lên
+ Cho vào dung dịch H2SO4: có khí bay lên và kết tủa trắng
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
Bài 4: Nhận biết Al, Mg, Al2O3 dùng:
A. Dung dịch HCl.
B. Dung dịch HNO3.
C. Dung dịch CuCl2.
D. Dung dịch NaOH.
Lời giải:
Đáp án: D
Lần lượt cho NaOH vào các mẫu thử. Chất rắn tan có khí thoát ra là Al, tan không có khí là Al2O3, không tan là MgO.
PTHH:
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Al2O3 + 2NaOH → NaAlO2 + H2O
Bài 5: Điều chế Na bằng cách:
1. Điện phân nóng chảy NaCl hoặc NaOH.
2. Điện phân dung dịch NaCl.
3. Dùng K đẩy Na khỏi muối.
A. 1 B. 2 C. 3 D. 1, 2
Lời giải:
Đáp án: A
Bài 6: Cho các chất rắn đựng trong các lọ mất nhãn BaO, MgO, Al2O3. Chỉ dùng một hóa chất nào sau đây có thể nhận biết được 3 chất trên?
A. H2O B. HCl C. H2SO4 D. Fe(OH)2
Lời giải:
Đáp án: A
- Hòa tan lần lượt các mẫu vào nước, mẫu chất rắn nào tan là BaO
PTHH: BaO + H2O → Ba(OH)2
- Lấy Ba(OH)2 cho vào 2 chất rắn, chất nào tan ra là Al2O3 còn lại là MgO
PTHH: Ba(OH)2 + Al2O3 + H2O → Ba(AlO2)2 + 2H2O
Bài 7: Phương pháp chung để điều chế kim loại kiềm là:
A. Thủy luyện
B. Điện phân dung dịch
C. Nhiệt luyện
D. Điện phân nóng chảy.
Lời giải:
Đáp án: D
Bài 8: Trong công nghiệp, natri hiđroxit được sản xuất bằng phương pháp:
A. Điện phân dung dịch NaCl, không có màng ngăn điện cực.
B. Điện phân dung dịch NaNO3, không có màng ngăn điện cực.
C. Điện phân dung dịch NaCl, có màng ngăn điện cực.
D. Điện phân NaCl nóng chảy.
Lời giải:
Đáp án: C