Bài tập về Đồng (Cu) và hợp chất của đồng cực hay, có lời giải chi tiết - Hoá học lớp 12
Bài tập về Đồng (Cu) và hợp chất của đồng cực hay, có lời giải chi tiết
Với Bài tập về Đồng (Cu) và hợp chất của đồng cực hay, có lời giải chi tiết Hoá học lớp 12 tổng hợp 30 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Đồng (Cu) và hợp chất của đồng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Bài 1: Cho Cu (z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB.
B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB.
D. ô 29, chu kỳ 4, nhóm IIB.
Lời giải:
Đáp án: A
Cấu hình electron của Cu là 1s22s22p63s23p63d104s1
Vậy Cu ở ô 29 (z = 29), chu kỳ 4 (do có 4 lớp electron), nhóm IB (1 electron hóa trị, nguyên tố d).
Bài 2: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít. B. 0,336 lít.
C. 0,747 lít. D. 1,792 lít.
Lời giải:
Đáp án: A
3Cu (0,05) + 8H+ (0,12 mol) + 2NO3- → 3Cu2+ + 2NO + 4H2O
Sau phản ứng H+ hết đầu tiên
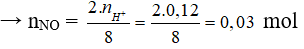
→ VNO = 0,03.22,4 = 0,672 lít.
Bài 3: Cho Cu (z = 29), số electron lớp ngoài cùng của nguyên tử nguyên tố đồng là
A. 1. B. 2.
C. 8. D. 10.
Lời giải:
Đáp án: A
Cấu hình electron của Cu là 1s22s22p63s23p63d104s1
→ Số electron lớp ngoài cùng của đồng là 1.
Bài 4: Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1. B. 2.
C. 3 . D. 4.
Lời giải:
Đáp án: C
1. Sai vì Cu không tác dụng với HCl.
2. Đúng
3. Đúng, Cu + 2FeCl3 → CuCl2 + 2FeCl2
4. Đúng, 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
5. Sai, đồng thuộc nhóm kim loại nặng
6. Sai, có tồn tại 2 chất trên
Bài 5: Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2. B. 3.
C. 4. D. 1 .
Lời giải:
Đáp án: D
2Cu(NO3)2 → 2CuO + 4NO2 (4x) + O2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu = mchất rắn sau + mkhí
→ 6,58 = 4,96 + 46.4x + 32x → x = 0,0075 mol
Dẫn khí X vào nước
O2 (0,0075) + 4NO2 (0,03) + 2H2O → 4HNO3 (0,03 mol)
CM (HNO3) = 0,03: 0,3 = 0,1 → pH = 1.
Bài 6: Đồng thuộc ô 29 trong bảng tuần hoàn, vậy cấu hình electron của Cu+ và Cu2+ lần lượt là
A. [Ar]3d10; [Ar]3d9. B. [Ar]3d94s1; [Ar]3d84s1.
C. [Ar]3d94s1; [Ar]3d9. D. [Ar]3d84s2; [Ar]3d84s1.
Lời giải:
Đáp án: A
Đồng có cấu hình e là [Ar]3d104s1, vậy cấu hình e của Cu+ và Cu2+ lần lượt là:[Ar]3d10; [Ar]3d9.
Bài 7: Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
A. 2,16 gam. B. 0,84 gam.
C. 1,72 gam. D. 1,40 gam.
Lời giải:
Đáp án: D
Fe (0,01) + 2Ag+ → Fe2+ + 2Ag (0,02 mol) (1)
mtăng (1) = 0,02.108 – 0,01.56 = 1,6 gam
Theo bài ra mKL tăng = 101,72 – 100 = 1,72 gam.
Tiếp tục có phản ứng:
Fe (a) + Cu2+ → Fe2+ (a mol) + Cu
mtăng (2) = 64a – 56a = 1,72 – 1,6 → a = 0,015 mol
→ mFe = (0,01 + 0,015).56 = 1,4 gam.
Bài 8: Nhận định nào sau đây là sai?
A. Đồng dẻo, dễ kéo sợi .
B. Đồng là kim loại có màu đen.
C. Đồng có thể dát mỏng hơn giấy viết từ 5 đến 6 lần.
D. Đồng dẫn nhiệt, điện tốt.
Lời giải:
Đáp án: B
Đồng là kim loại có màu đỏ.
Bài 9: Chất nào dùng để phát hiện vết nước trong các chất lỏng ?
A. CaSO4 khan. B. CuSO4 khan.
C. CuSO4.5H2O. D. Cả A và B.
Lời giải:
Đáp án: B
CuSO4 khan dùng để phát hiện vết nước trong chất lỏng.
Bài 10: Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1. B. 3.
C. 2. D. 4.
Lời giải:
Đáp án: C
2HCl + Cu(OH)2 → CuCl2 + 2H2O
4NH3 + Cu(OH)2 → |Cu(NH3)|4(OH)2
Bài 11: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot. B. ure.
C. natri nitrat. D. amoni nitrat.
Lời giải:
Đáp án: D
Amoni nitrat NH4NO3
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
NH4+ + OH- → NH3↑ + H2O
Bài 12: Thành phần chính của quặng cancopirit (pirit đồng) là
A. CuS. B. CuS2.
C. Cu2S. D. CuFeS2.
Lời giải:
Đáp án: D
Cancopirit: CuFeS2.
Bài 13: Cho các mệnh đề sau
(1) Cu2O vừa có tính oxi hoá vừa có tính khử.
(2) CuO vừa có tính oxi hóa vừa có tính khử.
(3) Cu(OH)2 tan dễ dàng trong dung dịch NH3.
(4) CuSO4 khan có thể dùng để phát hiện nước lẫn trong dầu hoả hoặc xăng.
(5) CuSO4 có thể dùng làm khô khí NH3.
Số mô tả sai là
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
Đáp án: B
(1) đúng, do trong Cu2O thì Cu có số oxi hóa +1 trung gian giữa 0 và +2
(2) sai, CuO chỉ có tính oxi hóa.
(3) đúng
(4) đúng,
(5) sai, CuSO4 cho vào khí NH3 ẩm sẽ có phản ứng xảy ra.
Bài 14: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam. B. 8,3 gam.
C. 2,0 gam. D. 4,0 gam
Lời giải:
Đáp án: D
Chỉ có CuO phản ứng với CO
CuO (x) + CO (x) → Cu + CO2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mcr ban đầu + mCO pư = mcr sau + mCO2
→ 9,1 + 28x = 8,3 + 44x → x = 0,05 mol
→ mCuO = 0,05.80 = 4 gam.
Bài 15: Trong các hợp chất, đồng có số oxi hóa phổ biến là
A. +1. B. +2.
C. -2. D. +1 và +2.
Lời giải:
Đáp án: D
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2.
Bài 16: Hợp kim Cu – Zn (45% Zn) được gọi là
A. đồng thau. B. đồng thanh.
C. đồng bạch. D. đuy ra.
Lời giải:
Đáp án: A
Đồng thau là hợp kim Cu – Zn (45% Zn).
Bài 17: Hợp kim Cu – Ni (25% Ni) được gọi là
A. đồng thau. B. đồng thanh.
C. đồng bạch. D. đuy ra.
Lời giải:
Đáp án: C
Đồng bạch là hợp kim Cu – Ni (25% Ni).
Bài 18: Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào ?
A. Tăng. B. Giảm.
C. Không thay đổi. D. không xác định được.
Lời giải:
Đáp án: A
Giả sử có 1 mol Cu tham gia phản ứng
Cu (1) + 2AgNO3 → Cu(NO3)2 + 2Ag↓ (2 mol)
→ khối lượng thanh đồng tăng = 2 × 108 - 64 = 152 gam.
Bài 19: Để loại CuSO4 lẫn trong dung dịch FeSO4, cần dùng thêm lượng dư chất nào sau đây ?
A. Al. B. Fe.
C. Zn. D. Ni.
Lời giải:
Đáp án: B
Fe + CuSO4 → FeSO4 + Cu
Bài 20: Cho Cu tác dụng với từng dung dịch sau: HCl (1), HNO3 (2), AgNO3 (3), Fe(NO3)2 (4), Fe(NO3)3 (5), Na2S (6). Cu phản ứng được với
A. 2, 3, 5, 6. B. 2, 3, 5.
C. 1, 2, 3. D. 2, 3.
Lời giải:
Đáp án: B
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Bài 21: Hòa tan hết 3,04 gam hỗn hợp bột Fe và Cu trong dung dịch HNO3 loãng thu được 0,896 lít khí NO (đktc). Phần trăm của Fe và Cu trong hỗn hợp lần lượt là
A. 63,2% và 36,8%. B. 36,8% và 63,2%.
C. 50% và 50%. D. 36,2% và 63,8%.
Lời giải:
Đáp án:
Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y mol
→ mhh = 3,04 → 56x + 64y = 3,04.
Áp dụng định luật bảo toàn electron ta có:
3.nFe + 2.nCu = 3.nNO → 3x + 2y = 0,12
Giải hệ phương trình được x = 0,02 và y = 0,03
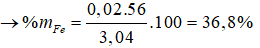
%mCu = 100 – 36,8 = 63,2%.
Bài 22: Trong không khí ẩm, các vật dụng bằng đồng bị bao phủ bởi lớp gỉ màu xanh. Lớp gỉ đồng là
A. (CuOH)2.CuCO3. B. CuCO3.
C. Cu2O. D. CuO.
Lời giải:
Đáp án: A
Bài 23: Nhúng một bản đồng mỏng vào cốc đựng dung dịch H2SO4 loãng, ta không thấy có hiện tượng gì xảy ra. Để cốc này ngoài không khí một thời gian, dung dịch trong cốc dần dần chuyển sang màu xanh. Có thể giải thích hiện tượng này như thế nào?
A. xảy ra hiện tượng ăn mòn hóa học
B. xảy ra hiện tượng ăn mòn điện hóa
C. đồng tác dụng với H2SO4 loãng rất chậm, do đó phải sau một khoảng thời gian dài, ta mới quan sát thấy hiện tượng.
D. đồng tác dụng với H2SO4 loãng khi có mặt oxi không khí.
Lời giải:
Đáp án: D
2Cu + 2H2SO4 + O2 → 2CuSO4 + 2H2O.
Đồng không tác dụng với dung dịch HCl, H2SO4 loãng. Tuy vậy, với sự có mặt của oxi trong không khí, Cu bị oxi hóa thành muối Cu(II).
Bài 24: Cho các tính chất sau:
(a) là kim loại có màu đỏ. (b) là kim loại nhẹ. (c) nóng chảy ở nhiệt độ cao.
(d) tương đối cứng. (e) dễ kéo dài và dát mỏng. (g) dẫn điện tốt.
(h) dẫn nhiệt kém.
Có bao nhiêu tính chất vật lí là tính chất vật lí của kim loại đồng ?
A. 3. B. 4.
C. 5. D. 6.
Lời giải:
Đáp án: B
Tính chất vật lí của kim loại đồng:
- là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025 mm, mỏng hơn giấy viết 5 - 6 lần).
- có độ dẫn điện và dẫn nhiệt rất cao (chỉ kém bạc).
- khối lượng riêng lớn 8,98 g/cm3.
- nhiệt độ nóng chảy cao 1083oC.
→ Có 4 tính chất vật lí là tính chất vật lí của đồng: (a), (c), (e), (g)
Bài 25: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Lời giải:
Đáp án: D
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Dung dịch Cu2+ có màu xanh; khí NO không màu nhưng hóa nâu trong không khí.
Bài 26: Chất lỏng Boocđo là hỗn hợp CuSO4 và vôi tôi trong nước theo một tỉ lệ nhất định, chất lỏng này phải hơi có tính kiềm (vì nếu CuSO4 dư sẽ thấm vào mô thực vật gây hại lớn cho cây). Boocđo là một chất diệt nấm cho cây rất hiệu quả nên được các nhà làm vườn ưa dùng, hơn nữa việc pha chế nó cũng rất đơn giản. Để phát hiện CuSO4 dư nhanh, có thể dùng phản ứng hóa học nào sau đây ?
A. Glixerol tác dụng với CuSO4 trong môi trường kiềm.
B. Sắt tác dụng với CuSO4.
C. Amoniac tác dụng với CuSO4.
D. Bạc tác dụng với CuSO4.
Lời giải:
Đáp án: B
Chất lỏng Boocđo gồm những hạt rất nhỏ muối đồng bazơ sunfat không tan và canxi sunfat.
4CuSO4 + 3Ca(OH)2 → CuSO4.3Cu(OH)2 + 3CaSO4
Để thử nhanh thuốc diệt nấm này tức là phát hiện đồng (II) sunfat dư, người ta dùng đinh sắt: sắt tan ra, có kim loại Cu đỏ xuất hiện.
Fe + CuSO4 → FeSO4 + Cu↓
Bài 27: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl dư, sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư axit nitric đặc, nguội, sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,5. B. 11,5.
C. 12,3. D. 15,6.
Lời giải:
Đáp án: C
Gọi số mol Al và Cu trong m gam hỗn hợp X lần lượt là a và b mol
Trường hợp 1: Cho X vào HCl dư, chỉ có Al phản ứng
2Al (0,1) + 6HCl → 2AlCl3 + 3H2 (0,15 mol)
Trường hợp 2: Cho X vào HNO3 đặc, nguội Al bị thụ động, chỉ có Cu phản ứng
Cu (0,15) + 4HNO3 → Cu(NO3)2 + 2NO2 (0,3 mol) + 2H2O
→ m = 0,1.27 + 0,15.64 = 12,3 gam.
Bài 28: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Phần trăm tổng số nguyên tử của đồng vị 65Cu là
A. 73%. B. 27%.
C. 54%. D. 50%.
Lời giải:
Đáp án: B
Gọi phần trăm số nguyên tử của 2 đồng vị 63Cu và 65Cu lần lượt là x và y (%)
→ x + y = 100
Nguyên tử khối trung bình của đồng là 63,54 → 63x + 65y = 63,54.100
Giải hệ được x = 73 và y = 27.
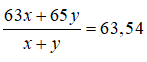
Bài 29: Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl– và y mol SO42–. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là
A. 0,03 và 0,02. B. 0,05 và 0,01.
C. 0,02 và 0,05. D. 0,01 và 0,03.
Lời giải:
Đáp án: A
Bảo toàn điện tích có: 2.0,02 + 0,03 = x + 2y → x + 2y = 0,07
mmuối = mion = 0,02.64 + 0,03.39 + 35,5x + 96y = 5,435 → 35,5x + 96y = 2,985
Giải hệ phương trình được x = 0,03 và y = 0,02.
Bài 30: Tổng hệ số là các số nguyên, tối giản của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 8. B. 10.
C. 11. D. 9.
Lời giải:
Đáp án: B
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Tống hệ số = 1 + 4 + 1 + 2 + 2 = 10.

