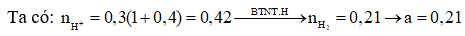Bài tập kim loại tác dụng với HCl, H2SO4 loãng có lời giải - Hoá học lớp 12
Bài tập kim loại tác dụng với HCl, H2SO4 loãng có lời giải
Với Bài tập kim loại tác dụng với HCl, H2SO4 loãng có lời giải Hoá học lớp 12 tổng hợp 50 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập kim loại tác dụng với HCl, H2SO4 loãng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Tài liệu Bài tập kim loại tác dụng với HCl, H2SO4 loãng có lời giải Hóa học lớp 12 chọn lọc, có lời giải với phương pháp giải chi tiết, các dạng bài tập từ cơ bản đến nâng cao có trong đề thi Đại học giúp học sinh ôn thi THPT Quốc gia môn Hóa học đạt kết quả cao.
KIM LOẠI TÁC DỤNG VỚI AXIT HCL, H2SO4 LOÃNG
A. Phương pháp giải
Chú ý: Kim loại tác dụng với axit không có tính oxi hóa mạnh chỉ các kim loại đứng trước hidro trong dãy điện hóa
VD: Fe, Na, Zn,…
Cách 1: Cách giải thông thường: sử dụng phương pháp đại số, thiết lập mối quan hệ giữa dữ kiện bài toán với ẩn số, sau đó giải phương trình hoặc hệ phương trình.
- Cách 2: Cách giải nhanh: Sử dụng các định luật như: Bảo toàn điện tích, bảo toàn khối lượng, bảo toàn nguyên tố ( Kết hợp với phương pháp đại số để giải)
BTNT H: nH+ = 2 nH2
BTKL: m muối = m kim loại + m anion gốc axit
B. Ví dụ minh họa
Ví dụ 1: Hòa tan hoàn toàn 2,76 gam hỗn hợp 2 kim loại Fe và Al vào dd HCl dư, sau phản ứng thu được m gam muối và 2,016 lít khí H2 ở đktc. Giá trị của m là:
A. 9,15 gam B. 8,15 gam
C.11,43 gam D. 12,015gam
Giải:
Cách 1: nH2= 2,016/22,4= 0,09 mol
2Al + 6HCl→ 2AlCl3 + 3H2 (1)
x x 1,5x
Fe + 2HCl→ FeCl2 + H2 (2)
y y y
Theo đầu bài ta có: 27x + 56y = 2,76 (I) và 1,5x + y = 0,09 (II). Giải hệ (I) và (II) ta được:
x =0,04, y= 0,03 => m= 0,04.133,5 + 0,03. 127= 9,15 gam . Vậy đáp án A đúng
Cách 2: Ta luôn có nHCl=2nH2 = 2.0,09=0,18 mol. Vậy theo định luật bảo toàn khối lượng ta có:
2,76 + 0,18.36,5= m + 0,09.2 => m= 9,15 gam→ Vậy đáp án A đúng
Cách 3: Ta có nHCl=2nH2 = 2.0,09=0,18 mol => nCl- = 0,18 mol
mmuối = mkim loại + mCl- = 2,76 + 0,18.35,5 = 9,15 gam
C. Bài tập vận dụng
Bài 1. Hoà tan hoàn toàn 3,22g hỗn hợp X gồm Fe, Mg Zn bằng một lượng vừa đủ H2SO4 loãng thấy thoát 1,344 lít H2 ở đktc và dung dịch chứa m gam muối. Giá trị của m là:
A. 10,27g B.8.98
C.7,25g D. 9,52g
Giải:
Ta có nH2= 1,344/22,4 = 0,06 mol
=>nH2SO4 = nH2 = 0,06 mol
Theo định luật bảo toàn khối lượng:
mKL + mHCl = mmuối + mH2
3,22 + 0,06.98 = mmuối + 0,06.2
mmuối = 8,98gam => Đáp án B
Bài 2. Hòa tan hết 6,3 gam hỗn hợp gồm Mg và Al trong vừa đủ 150 ml dung dịch gồm HCl 1M và H2SO4 1,5M thu được dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
A. 30,225 g B. 33,225g
C. 35,25g D. 37,25g
Giải:
Ta có công thức tính khối lượng muối
mmuối = mKL + mgốc axit
=>mmuối = mKL + mCl- + mSO42-= 6,3 + 0,15.35.5 + 0,225.96 = 3.225 gam
=> Đáp án B
Bài 3.Đốt cháy hết 2,86 gam hỗn hợp kim loại gồm Al, Fe, Cu được 4,14 gam hỗn hợp 3 oxit . Để hoà tan hết hỗn hợp oxit này, phải dùng đúng 0,4 lít dung dịch HCl và thu được dung dịch X. Cô cạn dung dịch X thì khối lượng muối khan là bao nhiêu ? .
A. 9,45 gam B.7,49 gam
C. 8,54 gam D. 6,45 gam
Giải:
Theo ĐL bảo toàn khối lượng:
mO = moxit – mKL = 4,14 – 2,86 = 1,28 gam
=>nO = 1,28/16 = 0,08 mol
Oxit tác dụng với axit tạo ra muối và H2O
=>2nO =2nH2O = nHCl = 0,016 mol
=>nCl- = nHCl = 0,016 mol
Khối lượng muối khan
mmuối = mKL + mgốc axit = 2,86 + 0,16.35.5 = 8,54 gam
=>Đáp án C
Bài 4. Hòa tan m gam hỗn hợp gồm Cu và Fe3O4 trong dung dịch HCl dư sau phản ứng còn lại 8,32 gam chất rắn không tan và dung dịch X. Cô cạn dung dịch X thu được 58,76 gam chất rắn khan. Giá trị của m
A. 31,04 gam B. 38,48 gam
C. 43,84 gam D. 46,16 gam
Giải:
Cu là kim loại đứng sau H trong dãy điện hóa nên Cu không tác dụng với HCl. Khối lượng chất rắn không tan chính là khối lượng Cu.
Ta có mCu = 8,32 gam
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
x 2x x
Chất rắn khan là tổng khối lượng 2 muối của sắt
=>x = 58,76/(2.162,5 + 127) = 0,13 mol
=>mFe3O4 = 0,13.232 = 30,16 gam
Khối lượng hỗn hợp ban đầu: m = mCu + mFe3O4 = 8,32 + 30,16 = 38,48 gam
=>Đáp án B
Bài 5.Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần % theo số mol của hỗn hợp Fe và FeS ban đầu lần lượt là
A. 40% và 60%. B. 50% và 50%.
C. 35% và 65%. D. 45% và 55%.
Giải:
Bảo toàn eletron ta có: nFe = nH2 ; nFeS = nH2S
nX = 2,24/22.4 = 0,1 mol
Hỗn hợp khí có tỉ khối so với hiđro là 9 => nH2= nH2S (phương pháp đường chéo)
=>nH2= nH2S = 0,05 mol
=>nFe = nFeS = 0,05 mol
=>Tỉ lệ % số mol của hỗn hợp ban đầu là 50% và 50%
=>Đáp án B
Bài 6: Cho Fe dư vào trong 200 ml dung dịch X chứa HCl 1M và 0,5M thấy a mol khí thoát ra. Giá trị của a là?
A. 0,20 B. 0,15
C. 0,25 D. 0,30
Giải:
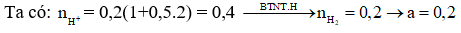
Bài 7: Cho Fe dư vào 200 ml dung dịch X chứa HCl 1M và 1M thấy a mol khí thoát ra. Giá trị của a là?
A. 0,20 B. 0,15
C. 0,25 D. 0,30
Giải:
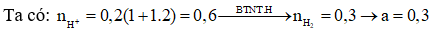
Bài 8: Cho Al dư vào 300 ml dung dịch X chứa HCl 1M và 0,2M thấy a mol khí thoát ra. Giá trị của a là?
A. 0,20 B. 0,15
C. 0,21 D. 0,30
Giải: