Cách giải Bài toán sắt tác dụng với HNO3 (axit nitric) hay, chi tiết - Hoá học lớp 12
Cách giải Bài toán sắt tác dụng với HNO3 (axit nitric) hay, chi tiết
Với Cách giải Bài toán sắt tác dụng với HNO3 (axit nitric) hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Bài toán sắt tác dụng với HNO3 (axit nitric) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

1. Phương pháp
- Khi cho Fe tác dụng với HNO3 trình tự phản ứng xảy ra:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
+ Sản phẩm khử của N+5 phụ thuộc vào nồng độ HNO3:
Với dung dịch HNO3 loãng thường cho sản phầm là NO
Với dung dịch HNO3 đậm đặc thường cho sản phẩm là NO2
+ Nếu Fe dư thì tiếp tục xảy ra phản ứng:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
⇒ Khi cho Fe vào dung dịch HNO3 nếu sau phản ứng Fe dư thì muối sinh ra là muối Fe2+.
* Lưu ý:
+ Khi cho Fe và hỗn hợp kim loại, trong đó có Fe tác dụng hết với dung dịch HNO3 thì:
mmuối nitrar = mKl + mNO3- = mKl + 62.ne nhận
+ Fe bị thụ động hóa trong HNO3 đặc nguội và H2SO4 đặc nguội.
2. Ví dụ minh họa
Ví dụ 1: Cho m (g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (dktc). Giá trị của m là:
A. 70 B. 56
C. 84 D. 112
Lời giải:
Chọn đáp án: D
Giải thích:
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN (trong HNO3) = nN trong Fe(NO3)2 + nN trong NO, NO2
Hay: 1,28 = 2. nFe(NO3)2 + 0,38
⇒ nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy: mFe = 0,5. 56 = m - 0,75m → m = 112 (g)
Ví dụ 2: Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
A. 2,24 B. 5,60
C. 3,36 D. 4,48
Lời giải:
Chọn đáp án: B
Giải thích:
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64x = 12 => x = 0,1 mol
Fe → Fe3+ + 3e
0,1 mol 0,3 mol
Cu → Cu2+ + 2e
0,1 mol 0,2 mol
Mặt khác: dX/H2 = 19 => MX = 38
Đặt x, y là số mol của NO và NO2 thì 30x + 46 y = 38 (x+ y) => x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 => 4x = 0,5 . Vậy x = 0,125 mol
V = 0,125. 2. 22.4 = 5,6 lít
3. Bài tập vận dụng
Câu 1: Cho 20 gam bột Fe vào dung dịch HNO3 và khuấy đến khi phản ứng xong thu V lít khí NO (đkc) và còn 3,2 gam kim loại. Giá trị của V là
A. 2,24 lít
B. 4,48 lít
C. 6,72 lít
D. 5,6 lít
Lời giải:
Chọn đáp án: B
Giải thích:
Fe còn dư nên dung dịch chỉ gồm Fe2+
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
mFe (pư) = 20 – 3,2 = 16,8g => nFe = 0,3 mol
Fe - 2e → Fe2+
N+5 + 3e → N+2 (NO)
BT e => 3nNO = 2nFe = 2. 0,3 = 0,6 mol => nNO = 0,2 mol => V= 4,48l
Câu 2: Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn 18 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1: 1 là: ( biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít
B. 0,6 lít
C. 0,8 lít
D. 1,2 lít
Lời giải:
Chọn đáp án: C
Giải thích:
nFe = nCu = 0,15 mol
- Do thể tích dung dịch HNO3 cần dùng ít nhất → muối Fe2+
→ ∑ ne cho = 2.(0,15 + 0,15) = 0,6 mol
- Theo ĐLBT mol electron: nH+ = nHNO3 = (0,6. 4): 3 = 0,8 mol
→ VHNO3 = 0,8 lít
Câu 3: Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là:
A. 1,92 gam
B. 3,20 gam
C. 0,64 gam
D. 3,84 gam
Lời giải:
Chọn đáp án: A
Giải thích:
nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,1 ← 0,4 → 0,1
Fe (dư) + 2Fe3+ → 3Fe2+
0,02 → 0,04
Cu + 2Fe3+(dư) → Cu2+ + 2Fe2+
0,03 ← 0,06
→ mCu = 0,03. 64 = 1,92 gam
Câu 4: Cho hỗn hợp A gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thấy thoát ra 0,448 lít khí NO duy nhất (đktc). Tính khối lượng muối trong dung dịch thu được.
A. 54g B. 42g
C. 36g D. 32g
Lời giải:
Chọn đáp án: A
Giải thích:
Ta có: nNO = 0,02 mol, nFe ban đầu = 0,0375 mol
N+5 + 3e → N+2
0,06 0,02 mol
Fe → Fe3+ + 3e
0,0375 0,1125 mol
Nếu Fe phản ứng hết, số mol electron nhường = 0,0375. 3 = 0,1125 > 0,06
=> Fe dư, Cu chưa phản ứng với dung dịch HNO3
Fephản ứng → Fe3+ + 3e
0,02 0,06 mol
2Fe+3 + Fe → 3Fe2+
0,02 0,01 0,03 mol
Như vậy sau khi phản ứng kết thúc Fe dư, Cu chưa phản ứng muối tạo ta là Fe(NO3)3
mFe(NO3)2 = 0,03. 180 = 54g
Câu 5: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3 thu được V lít hỗn hợp X gồm(NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối vơi hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 3,36l
B. 4,48l
C. 5,6l
D. 1,2 l
Lời giải:
Chọn đáp án: C
Giải thích:
Ta có: M−X = 38 = (30+46)/2
=> nNO = nNO2
Trong 12 gam hỗn hợp có 0,1 mol Fe và 0,1 mol Cu
Fe → Fe3+ + 3e
Cu → Cu2+ + 2e
=>∑nelectron do chất khử cho = 0,5(mol)
NO2 + 3e → NO
(mol) x 3x x
NO3- +1e → NO2
(mol) x x x
Áp dụng định luật bảo toàn electron: 4x = 0,5 => x = 0,125(mol)
Vậy: V = 0,125. 2. 22,4 = 5,6 l
Câu 6: Cho hỗn hợp gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thấy thoát ra 0,448 lít khí NO(đktc). Tính khối lượng muối thu được trong dung dịch , biết các phản ứng xảy ra hoàn toàn.
A. 4,5g
B. 3,6g
C. 2,4g
D. 5,4g
Lời giải:
Chọn đáp án: D
Giải thích:
Phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (2)
Từ (1) => nFe = nFe(NO3)3 = nNO = 0,448/22,4 = 0,02(mol)
Từ (2) => nFe = 1/2 nFe(NO3)2 = 0,01(mol)
nFe(NO3)2 = 3/2 nFe(NO3)3 = 0,03(mol)
nFe dư = 0,0375 - 0,02 - 0,01 = 0,0075(mol)
Fe dư nên Cu chưa phản ứng.
=> mFe(NO3)3 = 180. 0,03 = 5,4(gam)
Câu 7: Cho 18,5 gam hỗn hợp X gồm Fe và Fe3O4 tác dụng với 200ml dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và 1,46 gam kim loại. Nồng độ mol của dung dịch HNO3 là:
A. 2M
B. 2,4M
C. 2,5M
D. 3,2M
Lời giải:
Chọn đáp án: D
Giải thích:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
x 4x x x
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
y 28y/3 3y y/3
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2
(x+3y)/2 x+3y
Ta có: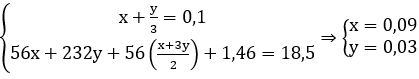
CM = (4x + (28y/3) )/0,2 = 3,2M
Câu 8: Hòa tan hỗn hợp gồm 0,1 mol Fe và a mol Cu vào dung dịch HNO3 loãng dư thu được 5,6 lít hỗn hợp NO và N2 (đktc) có tỷ khối hơi so với H2 là 14,5. Vậy a có giá trị là:
A. 0,6625
B. 0,6225
C. 0,0325
D. 0,165
Lời giải:
Chọn đáp án: A
Giải thích:
Gọi x, y là số mol của N2 và NO trong hỗn hợp.
Ta có: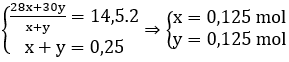
Quá trình cho electron
Fe - 3e → Fe3+
0,1 0,3
Cu - 2e → Cu2+
a 2a
Quá trình nhận electron:
2N+5 + 10e → N2
1,25 0,125
N+5 + 3e → N+2
0,375 0,125
Ta có: ∑ne cho = ∑ne nhận ⇒ 0,3 + 2a = 1,25 + 0,375
⇒ a = 0,6625 mol

