11 phương pháp giải nhanh bài tập Hóa học hữu cơ, vô cơ cực hay, có lời giải chi tiết | Phương pháp giải bài tập Hóa học - Hoá học lớp 12
11 phương pháp giải nhanh bài tập Hóa học hữu cơ, vô cơ cực hay, có lời giải chi tiết | Phương pháp giải bài tập Hóa học
Với 11 phương pháp giải nhanh bài tập Hóa học hữu cơ, vô cơ cực hay, có lời giải chi tiết | Phương pháp giải bài tập Hóa học Hoá học lớp 12 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập giải nhanh bài tập Hóa học hữu cơ, vô cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Phương pháp bảo toàn điện tích
Phương pháp bảo toàn electron
Phương pháp bảo toàn khối lượng
- Phương pháp bảo toàn khối lượng trong hóa học cực hay, có lời giải Xem chi tiết
- Phương pháp bảo toàn khối lượng trong hóa học hữu cơ hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp bảo toàn khối lượng trong hóa học vô cơ hay, chi tiết, có lời giải Xem chi tiết
Phương pháp bảo toàn nguyên tố
- Phương pháp bảo toàn nguyên tố trong hóa học cực hay, có lời giải Xem chi tiết
- Phương pháp bảo toàn nguyên tố trong hóa học hữu cơ hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp bảo toàn nguyên tố trong hóa học vô cơ hay, chi tiết, có lời giải Xem chi tiết
Phương pháp đường chéo
- Phương pháp đường chéo trong hóa học cực hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp đường chéo trong hóa học vô cơ hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp đường chéo trong hóa học hữu cơ hay, chi tiết, có lời giải Xem chi tiết
Phương pháp trung bình
- Phương pháp trung bình trong hóa học cực hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp trung bình trong hóa học hữu cơ hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp trung bình trong hóa học vô cơ hay, chi tiết, có lời giải Xem chi tiết
Phương pháp quy đổi
- Phương pháp quy đổi trong hóa học cực hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp quy đổi trong hóa học hữu cơ hay, chi tiết, có lời giải Xem chi tiết
- Phương pháp quy đổi trong hóa học vô cơ hay, chi tiết, có lời giải Xem chi tiết
Phương pháp tăng giảm khối lượng
- Phương pháp tăng giảm khối lượng trong hóa học cực hay, có lời giải Xem chi tiết
- Phương pháp tăng giảm khối lượng trong hóa học hữu cơ hay, có lời giải Xem chi tiết
- Phương pháp tăng giảm khối lượng trong hóa học vô cơ hay, có lời giải Xem chi tiết
Phương pháp sử dụng phương trình ion thu gọn
Phương pháp chọn đại lượng thích hợp
Phương pháp đồ thị
Phương pháp bảo toàn điện tích trong hóa học
Phương pháp giải
1. Nội dung
+ Nguyên tử, phân tử, dung dịch luôn trung hòa về điện
+ Trong nguyên tử: Số proton = số electron
+ Trong dung dịch: số mol x điện tích âm = số mol x điện tích dương
2. Phạm vi sử dụng
+ Đối với bài toán dung dịch
+ Trong bài toán có xuất hiện các chất điện li mạnh: muối, axit, bazơ
Chú ý: Với phương pháp này thường sử dụng kết hợp với các phương pháp sau:
+ Bảo toàn khối lượng
+ Bảo toàn nguyên tố
+ Viết phương trình ion rút gọn
`Phương pháp này thường chỉ sử dụng với bài toàn vô cơ
Ví dụ minh họa
Ví dụ 1: Một dung dịch có chứa 4 ion với thành phần: 0,01 mol Na+; 0,02 mol Mg2+; 0,015 mol SO42-; x mol Cl-. Gía trị của x là:
A. 0,015
B. 0,035
C. 0,02
D. 0,01
Giải:
Áp dụng định luật bảo toàn điện tích ta có:
nNa+ + 2n Mg2+ = 2 nSO42- + nCl-
⇒ 0,01 + 2.0,02 = 2.0,015 + x
⇒ x = 0,02 ⇒ Đáp án C
Ví dụ 2: Dung dịch A chứa hai cation là Fe2+: 0,1mol và Al3+: 0,2 mol và hai anion là Cl-: x mol và SO42+: y mol. Đem cô cạn dung dịch A thu được 46,9g hỗn hợp muối khan. Gía trị của x, y lần lượt là:
A. 0,6 và 0,1
B. 0,3 và 0,2
C. 0,5 và 0,15
D. 0,2 và 0,3
Giải:
Áp dụng định luật bảo toàn điện tích ta có:
2nFe2+ + 3nAl3+ = nCl- + 2nSO42-
⇒ x + 2y = 0,8 (1)
Khi cô cạn dung dịch: mmuối =∑ mion
⇒ 0,1.56 + 0,2.27 + 35,5x + 96y = 46,9
⇒ 35,5x + 96y = 35,9 (2)
Từ (1)(2) ⇒ x = 0,2 mol; y = 0,3 mol
⇒ Đáp án D
Ví dụ 3: Chia hỗn hợp X gồm hai kim loại có hóa trị không đổi thành 2 phần bằng nhau
Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc)
Phần 2: Nung trong không khí dư thu được 2,84g hỗn hợp rắn chỉ gồm các oxit. Khối lượng hỗn hợp X là:
B. 1,8g
C. 2,4g
D. 3,12g
Giải:
Ta có: Tổng số mol x điện tích dương ( của hai kim loại) trong 2 phần là bằng nhau
⇒Tổng số mol x điện tích âm của 2 phần cũng bằng nhau
O2- (trong oxit) ⇔ 2Cl-
nCl- = nH+ = 2 nH2 = 2. 1,792/22,4 = 0,16 mol
⇒ nO( trong oxit) = 0,08
Trong một phần: mkim loại = moxit – moxi = 2,84 – 0,08.16 = 1,56g
⇒ mX = 2.1,56 = 3,12g ⇒ Đáp án D
Ví dụ 4: Hòa tan hoàn toàn 10g hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 2M. Kết thúc thí nghiệm thu được dung dịch Y và 5,6 lít H2 (đktc). Để kết tủa hoàn toàn cation có trong Y cần vừa đủ 300ml dung dịch NaOH 2M. Thể tịch dung dịch HCl đã dùng là:
A. 0,2 lít
B. 0,24 lít
C. 0,3 lít
D. 0,4 lít
Giải:
nN+ = nOH- = nNaOH = 0,6 mol
Khi cho NaOH vào dung dịch Y ( chứa các ion: Mg2+; Fe2+; H+dư; Cl-) các ion dương sẽ tác dụng với dung dịch NaOH tạo kết tủa.
⇒ Dung dịch sau phản ứng chỉ gồm Na+ và Cl-
⇒ nNa+ = nCl- = 0,6 mol
⇒ nH+ = nCl- = 0,6 mol
⇒ VHCl = 0,6/2 = 0,3 lít ⇒ Đáp án C
Ví dụ 5: Để hòa tan hoàn toàn 20g hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 cần vừa đủ 700ml dung dịch HCl 1M thu được dung dịch X và 3,36 lít H2(đktc). Cho NaOH dư vào dung dịch X rồi lấy toàn bộ kết tủa thu được đem nung trong không khí đến khối lượng không đổi thì lượng chất rắn thu được là:
A. 8g
B. 16g
C. 24g
D. 32g
Giải:
Ta có: nHCl hòa tan Fe = 2n H2 = 0,3 mol
nHCl hòa tan các oxit = 0,7 – 0,3 = 0,4 mol
Theo định luật bảo toàn điện tích ta có:
nO2-(oxit) = ½ n Cl- = 0,2 mol
⇒ mFe (trong X) = moxit – moxi = 20 – 0,2.16 = 16,8g
⇒ nFe = 0,3 mol
Bảo toàn nguyên tố ta có: nFe2O3 = ½ nFe = 0,15mol
⇒ mc/rắn = mFe2O3 = 0,15. 160 = 24g
⇒ Đáp án C
Ví dụ 6: Hòa tan hoàn toàn 15,6g hỗn hợp gồm Al và Al2O3 trong 500ml dung dịch NaOH 1M thu được 6,72 lít H2 ( đktc) và dung dịch X. Thể tích HCl 2M tối thiểu cần cho vào X để thu được lượng kết tủa lớn nhất là:
A. 0,175 lít
B. 0,25 lít
C. 0,125 lít
D. 0,52 lít
Giải:
Dung dịch X chứa các ion Na+; AlO2-; OH- dư ( có thể có)
Áp dụng định luật bảo toàn điện tích: nAlO2- + nOH- = nNa+ = 0,5
Khi cho HCl vào dung dịch X:
H+ + OH- → H2O (1)
H+ + AlO2- + H2O → Al(OH)3 (2)
3H+ + Al(OH)3 → Al3+ + 3H2O (3)
Để kết tủa lớn nhất ⇒ không xảy ra phản ứng (3)
⇒ nH+ = nAlO2- + nOH- = 0,5 mol
⇒ VHCl = 0,5/2 = 0,25 (lít) ⇒ Đáp án B
Ví dụ 7: Cho hỗn hợp X gồm X mol FeS2 và 0,045 mol Cu2S tác dụng vừa đủ với HNO3 loãng đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Gía trị của x là:
A. 0,045
B. 0,09
C. 0,135
D. 0,18
Giải:
Áp dụng bảo toàn nguyên tố:
Fe3+: x mol; Cu2+: 0,09 mol; SO42-: (x + 0,045) mol
Áp dụng định luật bảo toàn điện tích trong dung dịch chỉ chứa muối sunfat ta có:
3nFe3+ + 2nCu2+ = 2nSO42-
⇒ 3x + 2.0,09 = 2.(x + 0,045) ⇒ x = 0,09
⇒ Đáp án B
Ví dụ 8: Cho m gam hỗn hợp Cu, Zn, Mg tác dụng hoàn toàn với dung dịch HNO3 loãng, dư. Cô cạn cẩn thận dung dịch thu được sau phản ứng thu được (m + 62) gam muối khan. Nung nóng hỗn hợp muối khan trên đến khối lượng không đổi thu được chất rắn có khối lượng là:
A. (m + 4) gam
B. (m + 8) gam
C. (m + 16) gam
D. (m + 32) gam
Giải:
Kim loại + HNO3 → Muối nitrat
Ta có: mmuối – mkim loại = m NO3- = 62g
n NO3- = 1 mol
Muối nitrat ( Cu, Zn, Mg) Oxit
Bảo toàn điện tích ta có: n NO3- (muối) =2 nO2-(oxit) ( cùng = số mol cation)
⇒ nO ( oxit) = 0,5 mol
⇒ mc/rắn = mkim loại + moxi = m + 0,5.16 = m + 8 (gam)
⇒ Đáp án B
Ví dụ 9: Dung dịch X chứa 0,025 mol CO32-; 0,1 mol Na+; 0,25 mol NH4+ và 0,3 mol Cl-. Cho 270ml dung dịch Ba(OH)2 0,2M vào đun nóng nhẹ (giả sử H2O bay hơi không đáng kể). Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau quá trình phản ứng giảm đi là:
A. 4,215g
B. 5,296g
C. 6,761g
D. 7,015g
Giải:
n Ba(OH)2 = 0,054 mol ⇒ nBa2+ = 0,054 mol; nOH- = 0,108 mol
CO32- + Ba2+ → BaCO3↓
NH4+ + OH- → NH3 + H2O
Ta có: nBa2+ > nCO32- ⇒ nBaCO3 = 0,025 mol
n NH4+ > n OH- ⇒ nNH3 = nOH- = 0,108 mol
Khối lượng dung dịch X và dung dịch Ba(OH)2 giảm đi = mNH3 + mBaCO3
= 0,025.197 + 0,108.17 = 6,761g
⇒ Đáp án C
Ví dụ 10: Trộn 100ml dung dịch AlCl3 1M với 200ml dung dịch NaOH 1,8M đến khi phản ứng hoàn toàn thì lượng kết tủa thu được là:
A. 3,12g
B. 6,24g
C. 1,06g
D. 2,08g
Giải:
n Al(3+ = 0,1 mol; n OH- = 0,36 mol
Al(3+ + 3OH- → Al(OH)3
Ta có n Al(3+ < 3 n OH- ⇒ OH- dư;
n OH- dư = 0,36 – 0,1.3 = 0,06
OH- + Al(OH)3 → AlO2- + 2H2O
n Al(OH)3 > n OH- dư ⇒ Al(OH)3 tan một phần
⇒ nAl(OH)3 không tan = 0,1 – 0,06 = 0,04 mol
mkết tủa = mAl(OH)3 = 0,04 . 78 = 3,12g
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Dung dịch X chứa a mol Na+; b mol Mg2+; c mol Cl- và d mol SO42-. Biểu thức liên hệ giữa a, b, c, d là:
A. a + 2b = c + 2d
B. a + 2b = c + d
C. a + b = c + d
D. 2a + b = 2c + d
Lời giải:
Áp dụng định luật bảo toàn điện tích ta có:
nNa+ + 2nMg2+ = nCl- + 2 nSO42-
⇒ a + 2b = c + 2d
⇒ Đáp án A
Bài 2: Dung dịch Y chứa Ca2+ 0,1 mol, Mg2+ 0,3 mol, Cl- 0,4 mol, HCO3- y mol. Khi cô cạn dung dịch Y thì lượng muối khan thu được là:
A. 37,4g
B. 49,8g
C. 25,4g
D. 30,5g
Lời giải:
Áp dụng định luật bảo toàn điện tích ta có:
nHCO3- = 2nCa2+ + 2n Mg2+ - nCl- = 0,2 + 0,6 – 0,4 = 0,4 mol
m muối = m HCO3- + mCa2+ + mMg2+ + mCl- = 0,1.40 + 0,3.24 + 0,4.35,5 + 0,4.61
m muối = 49,8g ⇒ Đáp án B
Bài 3: Hòa tan hoàn toàn 10g hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 2M.Kết thúc thí nghiệm thu được dung dịch Y và 5,6l khí H2 (đktc). Để kết tủa hoàn toàn các cation có trong Y cần vừa đủ 300ml NaOH 2M.Thể tích dungdịch HCl đã dùng là:
A. 0,2 lít
B. 0,24 lít
C. 0,3 lít
D. 0,4 lít
Khối lượng kết tủa thu được là:
A. 20,2g
B. 18,5g
C. 16,25
D. 13,5g
Lời giải:
nNa+ = nOH- = nNaOH = 0,6M
X + NaOH → dung dịch Y(Mg2+;Fe2+;H+ dư;Cl-)
NaOH + Y: Mg2+; Fe2+ kết tủa với OH- .
⇒ dung dịch thu được sau phản ứng chỉ chứa Na+ và Cl-.
⇒ nCl- = nNa+=0,6⇒ VHCl=0,6: 2= 0,3lít ⇒ Đáp án C
nHCl đã dùng = 0,6mol
nH2 = 0,25 mol ⇒ nHCl pư kim loại = 2nH2 = 0,5mol
⇒ nNaOH pư HCl = n HCl dư = 0,6 – 0,5 = 0,1 mol
nNaOH tạo kết tủa với kim loại = 0,6 – 0,1 = 0,5 mol
mkết tuả = mKL + mOH- = 10 + 0,5.17 = 18,5g ⇒ Đáp án B
Bài 4: Cho hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Al và Al2O3 trong 500 dung dịch NaOH 1M thu được 6,72 lít H2 (đktc)Và dung dịch X. Thể tích HCl 2M tối thiểu cần cho vào X để thu được lượng kết tủa lớn nhất:
A. 0,175 lít.
B. 0,25 lít.
C. 0,25 lít.
D. 0,52 lít.
Lời giải:
Dung dịch X chứa các ion Na+ ; AlO2- ; OH- dư (có thể). Áp dụng định luật Bảo toàn điện tích:
n AlO2- + n OH- = n Na+ = 0,5
Khi cho HCl vaof dung dịch X:
H+ + OH- → H2O (1)
H+ + AlO2- + H2O → Al(OH)3 ↓ (2)
3H+ + Al(OH)3 → Al3+ + 3H2O (3)
Để kết tủa là lớn nhất, thì không xảy ra (3) và n H+ = n AlO2- + n OH- = 0,5 mol
⇒ VHCl = 0,5/2 = 0,25 (lít) ⇒ Đáp án C
Bài 5: Một dung dịch X chứa 0,02mol Cu2+; 0,03mol K+; x mol Cl- và y mol SO42- Tổng khối lượng các muối tan trong dung dịch là 5,435g. Giá trị của x và y lần lượt là :
A . 0,01 và 0,03
B. 0,02 và 0,05
C. 0,05 và 0,01
D. 0,03 và 0,02
Lời giải:
Bảo toàn điện tích ta có:
2nCu2+ + nK+ = nCl- + 2nSO42-
⇒ x + 2y = 0,07 mol (1)
mmuối = mCu2+ + mK+ + mCl- + mSO42- = 5,435
⇒ 35,5x + 96y = 2,985 (2)
Từ (1)(2) ⇒ x = 0,03; y = 0,02
⇒ Đáp án D
Bài 6: Dung dịch X chứa các ion: Fe3+, SO42-, NH4+, Cl-. Chia dung dịch X thành 2 phần bằng nhau:
+ Phần 1: Tác dụng với lượng dư dung dịch NaOH, đun nóng thu được 0,672 lít khí ( ở đktc) và 1,07g kết tủa
+ Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66g kết tủa
Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là ( quá trình cô cạn chỉ có bay hơi nước)
A. 3,73g
B. 7,04g
C. 7,46g
D. 3,52g
Lời giải:
Phần 1:
0,672l khí là khí NH3; n NH3 = n NH4+ = 0,03 mol
1,07g kết tuả là Fe(OH)3; nFe(OH)3 = nFe3+ = 0,01 mol
Phần 2:
4,66g kết tủa là BaSO4; nBaSO4 = n SO42- = 0,02 mol
Áp dụng định luật bảo toàn điện tích ta có:
nCl- = 3nFe3+ + nNH4+ - 2nSO42- = 0,03 + 0,03 – 0,04 = 0,02 mol
mmuối = 2.(56.0,01 + 0,03.18 + 0,02.96 + 0,02.35,5) = 7,46g
⇒ Đáp án C
Bài 7: Hòa tan hoàn toàn 5,94g hỗn hợp hai muối clorua của 2 kim loại nhóm IIA vào nước được 100ml dung dịch X. Để làm kết tủa hết ion Cl- có trong dung dịch X trên ta cho toàn bộ lượng dung dịch X trên tác dụng với dung dịch AgNO3. Kết thúc thí nghiệm, thu được dung dịch Y và 17,22g kết tủa. Khối lượng muối khan thu được khi cô cạn dung dịch Y là:
A. 4,86g
B. 5,4g
C. 7,53g
D. 9,12g
Lời giải:
17,22g kết tủa là AgCl; nAgCl = 0,12 mol
⇒ nCl- = 0,12 mol
Áp dụng định luật bảo toàn điện tích ta có:
nCl- = n NO3- = 0,12 mol( bằng số mol điện tích của cation)
mcation kim loại = mmuối clorua – mCl- = 5,94 – 0,12.35,5 = 1,68g
mmuối nitrat (Y) = mkim loại + mNO3- = 1,68 + 0,12.62 = 9,12g
⇒ Đáp án D
Bài 8: Trộn dung dịch chứa Ba2+; OH- 0,06mol và Na+ 0,02 mol với dung dịch chứa HCO3- 0,04 mol; CO32- 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn 2 dung dịch trên là:
A. 3,94g
B. 5,91g
C. 7,88g
D. 1,71g
Lời giải:
Bảo toàn điện tích với dung dịch chứa Ba2+; OH- 0,06mol và Na+ 0,02 mol
⇒ nBa2+ =(0,06-0,02)/2 = 0,02 mol
Bảo toàn điện tích với dung dịch chứa HCO3- 0,04 mol; CO32- 0,03 mol và Na+
⇒ nNa+ = 0,04 + 0,03 = 0,07 mol
Khi trộn 2 dung dịch vào ta có:
HCO3- + OH- → CO32- + H2O
nOH- > nHCO3- ⇒ OH- dư
nCO32- sinh ra = nHCO3- = 0,04 mol
∑n CO32- = 0,03 + 0,04 = 0,07 mol
Ba2+ + CO32- → BaCO3 ↓
n Ba2+ < n CO32- ⇒ nBaCO3 = n Ba2+ = 0,02 mol
mkết tủa = 0,02. 197 = 3,94g ⇒ Đáp án A
Bài 9: Cho 24,4g hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2 sau phản ứng thu được 39,4g kết tuả. Lọc tách kết tủa, cô cạn dung dịch thu được bao nhiêu gam muối clorua khan.
A. 2,66g
B. 22,6g
C. 26,6g
D. 6,26g
Lời giải:
mkết tủa = m BaCO3 = 39,4g ⇒ n BaCO3 = 0,2 mol
⇒ n CO32- = 0,2 mol
m cation kim loại = m muối - mCO32- = 24,4 – 0,2.60 = 12,4g
Bảo toàn điện tích ta có:
2nCO32- = nCl- = 0,4( bằng số mol điện tích cation)
mmuối clorua = mkim loại + mCl- = 12,4 + 0,4.35,5 = 26,6g
⇒ Đáp án C
Bài 10: Hòa tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và x mol Cu2S vào dung dịch HNO3 vừa đủ, thu được dung dịch X chỉ chứa 2 muối sunfat của các kim loại và giải phóng khí NO duy nhất. Gía trị của x là:
A. 0,03
B. 0,045
C. 0,06
D. 0,09
Lời giải:
Dung dịch X chỉ chứa 2 muối là: Fe2(SO4)3 và CuSO4
n FeS2 = ½ n Fe2(SO4)3 = 0,06mol
n CuSO4 = 2n Cu2S = 2x mol
Bảo toàn nguyên tố S: 0,12.2 + x = 0,06.3 + 2x
⇒ x = 0,06
⇒ Đáp án C
Phương pháp bảo toàn electron trong hóa học
Phương pháp giải
1. Nội dung
Trong phản ứng oxi hóa khử:
Số electron nhường = Số electron nhận
Số mol electron nhường = Số mol electron nhận
2. Phạm vi sử dụngM
+ Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ
+ Khi gặp bài toán có sử dụng HNO3, H2SO4 đặc nóng
Chú ý:
+ Xác định chính xác chất khử, chất oxi hóa ( dựa vào sự thay đổi số oxi hóa của các nguyên tử trong các chất)
+ Có thể áp dụng bảo toàn e cho một số phương trình, nhiều phương trình hoặc toàn bộ quá trình
+ Xác định các chất nhường và nhận e. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố
+ Khi áp dụng phương pháp bảo toàn e thường sử dụng kèm các phương pháp bảo toàn khác ( khối lượng, nguyên tố)
Ví dụ minh họa
Ví dụ 1: Đốt 17,88g hỗn hợp X gồm Al và Fe trong khí Cl2 thu được hỗn hợp chất rắn Y. Cho Y vào nước dư, thu được dung dịch Z và 2,4 gam kim loại. Dung dịch Z tác dụng tối đa với 0,228 mol KMnO4 trong dung dịch H2SO4 (không tạo SO2). Phần trăm khối lượng Fe trong hỗn hợp là:
A. 72,91%.
B. 64%
C. 66,67%
D. 69,8%
Giải:
Đặt x, y lần lượt là số mol của Fe và Al
⇒ 56a + 27b = 17,88
Vì trước và sau chuỗi các phản ứng đều là khí Cl2
⇒ Ta quy đổi hỗn hợp muối thành Fe, Al và Cl2
Bảo toàn electron ta có: ne cho = ne nhận
⇒3nFe phản ứng + 3nAl = 5nKMnO4
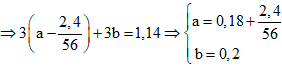
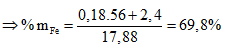
⇒ Đáp án D
Ví dụ 2: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗikhí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là
A. 63% và 37%.
B. 36% và 64%
C. 50% và 50%.
D. 46% và 54%.
Giải
Đặt 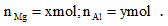
Ta có: 24x + 27y = 15 (1)
Các quá trình nhường electron:
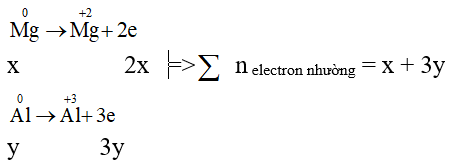
Các quá trình nhận electron:

⇒Ví dụ 3: Đốt cháy 5,6g Fe bằng oxi không khí, sau phản ứng thu được 6,8g hỗn hợp các chất rắn. Hòa tan hoàn toàn hỗn hợp chất rắn bằng dung dịch HNO3 dư. Sản phẩm là Fe(NO3)3 , V lít khí NO ở đktc và nước. Tính V?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 5,6 lít.
Giải
Nhận thấy sau khi qua HNO3 thì tất cả Fe đều chuyển về Fe3+ . Như vậy trạng thái đầu là Fe, trạng thái cuối là Fe3+

⇒ Đáp án B
Ví dụ 4: Cho 33,35 gam hỗn hợp A gồm Fe3O4, Fe(NO3)3,Cu tác dụng hoàn toàn với dung dịch chứa 0.414 mol H2SO4 (loãng) thì thu được khí NO duy nhất và dung dịch B chỉ chứa 2 muối. Cô cạn B thu được bao nhiêu gam muối khan?
A. 64,400 hoặc 61,520.
B. 65,976 hoặc 61,520.
C. 73,122 hoặc 64,400.
D. 65,976 hoặc 75,922.
Giải
Gọi x, y, z là số mol của Fe3O4,Fe(NO3)3 , Cu có trong hỗn hợp A.
232x + 242y + 64z = 33,35 (l).
A + dd H2S04 → dd B chứa 2 muối ⇒ có 2 trường hợp xảy ra.
+Trường hợp 1: B chứa FeSO4 và CuSO4.
Các quá trình nhường và nhận electron:
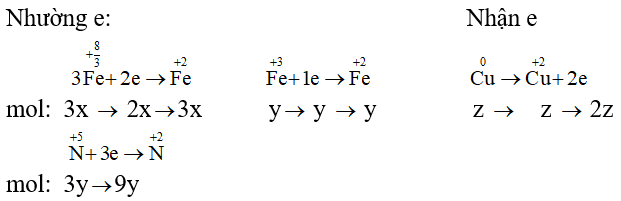
Áp dụng định luật bảo toàn electron ta có: 2x + y + 9y = 2z ⇒ x + 5y - z = 0 (2)
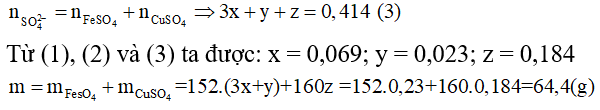
+Trường hợp 2: B chứa Fe2(S04)3 và CuSO4.
Các quá trình nhường và nhận electron:
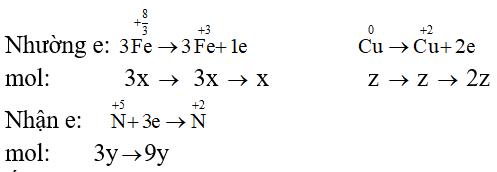
Áp dụng định luật bảo toàn electron ta có: x + 2z = 9y
⇒ x - 9y + 2z = 0 (4)
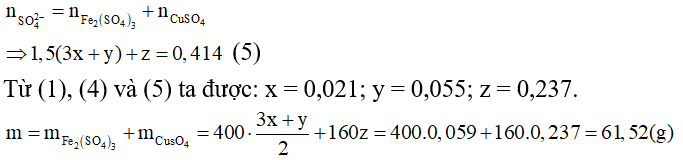
⇒ Đáp án A.
Ví dụ 5: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là:
A. NO và Mg
B. N2O và Al
C. N2O và Fe
D. NO2 và Al
Giải
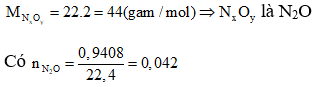
Gọi n là hóa trị của kim loại M. Các quá trình nhuờng và nhận electron:
Quá trình nhường electron: 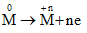
Quá trình nhận electron: 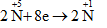
Áp dụng định luật bảo toàn mol electron, ta có: n.nM = 8nN2O
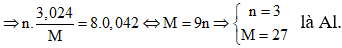
⇒ Đáp án B.
Ví dụ 6: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Giải
Dung dịch H2SO4 đậm đặc vừa là chất oxi hóa vừa là môi trường.
Gọi a là số oxi hóa của S trong X.

⇒ Đáp án C.
Ví dụ 7: Hoà tan hoàn toàn 1,2 gam kim loại M vào dung dịch HNO3 dư thu được 0,224 lít khí N2 (sản phẩm khử duy nhất) ở (đktc). Kim loại M là:
A. Mg.
B. Fe.
C. Al.
D. Cu.
Giải
Các quá trình nhường và nhận electron:
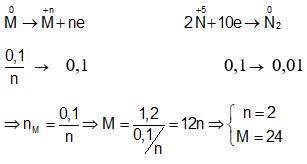
⇒ Đáp án A
Ví dụ 8: Trộn 0,81 gam bột nhôm với bột Fe2O3 và CuO rồi đốt nóng để tiến hành phản ứng nhiệt nhôm thu được hỗn hợp
A. Hoà tan hoàn toàn A trong dung dịch HNO3 đun nóng thu được V lít khí NO (sản phẩm khử duy nhất) ở đktc. Giá trị của V là:
A. 0,224 lít.
B. 0,672 lít.
C. 2,24 lít.
D. 6,72 lít.
Giải
Tóm tắt theo sơ đồ:
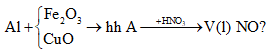
Như vậy, thực chất trong bài toán này toàn bộ quá trình chỉ có quá trình cho và nhận electron của nguyên tử Al và N.
Các quá trình nhường và nhận electron như sau:
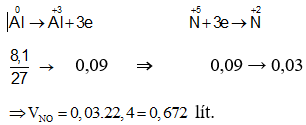
⇒ Đáp án D.
Ví dụ 9: Điện phân dung dịch chứa m gam hỗn họp 2 muối CuSO4 và NaCl bằng điện cực trơ, có màng ngăn đến khi nước bị điện phân ở cả 2 điện cực thì ngừng điện phân. Dung dịch sau điện phân hoà tan vừa đủ 1,16 gam Fe3O4 và ở anot của bình điện phân có 448ml khí bay ra (đktc). Khối lượng dung dịch giảm sau khi điện phân là:
A. 7,10.
B. 1,03.
C. 8,60.
D. 2,95.
Giải:
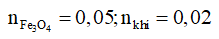
Vì dung dịch sau điện phân hòa tan được Fe3O4 nên dung dịch sau điện phân có chứa H+.
Thứ tự các phản ứng xảy ra như sau:
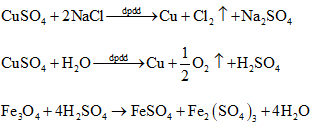
Các bạn có thể viết các phương trình phản ứng như trên để dễ hiểu quá trình phản ứng và tính toán theo yêu cầu đề bài. Tuy nhiên, các bạn có thể rút ngắn quá trình tính toán mà không cần viết phương trình phản ứng như sau:
Ta có các bán phản ứng:

⇒ Đáp án D
Ví dụ 10: Cho 39,2 gam hỗn hợp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu tác dụng vừa đủ với HNO3 nồng độ a (mol/lít), thu được 0,2 mol NO (sản phẩm khử duy nhất). Giá trị của a là
A. 2,0
B. 1,5
C. 3,0
D. 1,0
Giải:
Coi hỗn hợp gồm Fe (x mol); Cu (y mol) và 0,45 mol O
⇒ 56x + 64y + 7,2 = 39,2 (l)
Áp dụng định luật bảo toàn electron ta có:
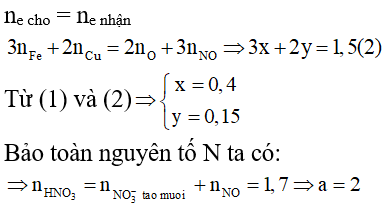
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Đốt cháy hỗn hợp gồm l,92g Mg và 4,48g Fe với hỗn hợp khí X gồm O2 và Cl2. Sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua ( không còn khí dư). Hòa tan Y bằng 120ml dung dịch HCl 2M (vừa đủ) thu được dung dịch Z. Cho AgNO3 (dư) vào Z thu được 56,69g kết tủa. Phần trăm thể tích khí Cl2 trong hỗn hợp X là.
A. 51,72%
B. 76,70%
C. 53,85%
D. 56,36%
Lời giải:

⇒ Đáp án C
Bài 2: Cho 61,2g hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn thu được 3,361 NO (sản phẩm khử duy nhất, đktc), dung dịch Y và còn lại 2,4g kim loại. Cô cạn dung dịch Y thu được m g muối khan. Giá trị của m là:
A. 151,5
B. 97,5
C. 108,9
D. 137,1
Lời giải:
nNO = 0,15 (mol), kim loại còn lại sau phản ứng là Cu.
nCu dư = 0,0375(mol)
nX phản ứng = 61,2 - 2,4 = 58,8 (g)
Đặt x và y lần lượt là số mol Cu và Fe3O4.
Quy Fe3O4 thành hỗn hợp FeO và Fe2O3 có tỉ lệ mol 1:1
Theo khối lượng X ⇒ 64x + 232y = 58,8
Bảo toàn electron ta có: ne cho = ne nhận
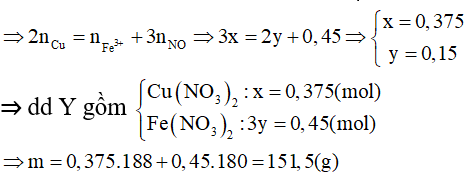
⇒ Đáp án D
Bài 3: Nhiệt phân 50,56g KMnO4 sau một thời gian thu được 46,72 gam chất rắn. Cho toàn bộ lượng khí sinh ra phản ứng hết với hỗn hợp X gồm Mg,Fe thu được hỗn hợp Y nặng 13,04gam. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch H2SO4 đặc nóng dư thu được 1,344 lít SO2 (đktc).Hỏi % khối lượng Mg trong X là:
A. 52,17%
B. 46,15%
C. 28,15%
D. 39,13%
Lời giải:

⇒ Đáp án D
Bài 4: Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20g chất rắn Z và dung dịch E; cho NaOH dư vào dung dịch E, lọc kết tủa, nung ngoài không khí nhận được 8,4g hỗn hợp 2 oxit. Nồng độ mol của AgNO3 và Cu(NO3)2 lần lượt là:
A. 0,24M và 0,5M
B. 0,12M và 0,36M
C. 0,12M và 0,3M
D. 0,24M và 0,6M
Lời giải:
AgNO3 và Cu(NO3)2 phản ứng hết
⇒ Fe còn dư hoặc phản ứng vừa đủ.
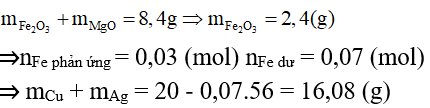
Đặt x và y lần lượt là số mol của Ag và Cu
⇒108x + 64y = 16,08
Bảo toàn electron ta có: ne cho = ne nhận
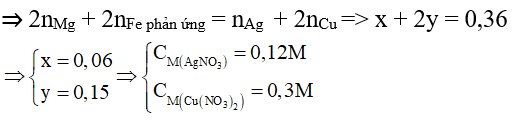
⇒ Đáp án C
Bài 5: Dẫn luồng khí CO đi qua hỗn hợp gồm CuO, Fe2O3, Al2O3và ZnO đun nóng, sau một thời gian thu được chất rắn X và hỗn hợp khí Y. Cho Y lội chậm qua bình đựng dung dịch Ba(OH)2 dư, kết thúc phản ứng thu được 49,25g kết tủa. Cho toàn bộ X phản ứng vói lượng dư dung dịch H2SO4 đặc nóng, kết thúc phản ứng thu được V lít SO2 (sản phẩm khử duy nhất,đktc). Giá trị của V là:
A. 4,48 lít
B. 3,36 lít
C. 6,72 lít
D. 5,6 lít
Lời giải:
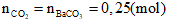
Bảo toàn electron cho quá trình khử Oxit của CO ta có (l)
ne cho = ne nhận ne nhận
Bảo toàn e cho quá trình Oxi hóa bởi H2SO4 (2)
⇒ ne cho = ne nhận ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
⇒ ne nhận = ne cho
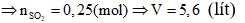
⇒ Đáp án D
Bài 6: Hòa tan hoàn toàn 30,4 g chất rắn X gồm Cu, CuS, Cu2S. và S bằng HNO3 dư, thoát ra 20,16 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm Ba(OH)2 dư vào Y thu m gam kết tủa. Giá trị của m là:
A. 119,5 g
B. 112 g
C. 115,9 g
D. 110,95 g
Lời giải:
Coi hỗn hợp chỉ gồm Cu (a mol) và S (b mol)
⇒ 64a + 32b = 30,4
Bảo toàn electron ta có: 2nCu + 6nS = 3nNO
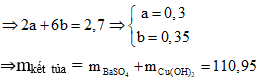
⇒ Đáp án D
Bài 7: Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của a là
A. 0,15
B. 0,18.
C. 0,24
D. 0,26
Lời giải:
Sau t giây: nkhí anot = 0,11 mol
nCl2 = ½ nCl- = 0,1 mol < 0,11 mol ⇒ Cl- điện phân hết và H2O điện phân sinh ra O2 ở anot;
nO2 = 0,11 – 0,1= 0,01
Ở anot:

⇒ Đáp án A
Bài 8: Cho 61,2g hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng, khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn thu được 3,361 NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y và 2,4g kim loại. Cô cạn Y thu được m gam muối khan. Giá trị của m là
A. 137,1
B. 151,5
C. 97,5
D. 108,9
Lời giải:
Quy đổi X thành hỗn hợp các đơn chất với: Cu (x mol); Fe ( 1,5y mol); O2 (y mol)
⇒ 64x + 116y = 61,2 - 2,4 = 58,8 (l)
Bảo toàn electron ta có: ne cho = ne nhận
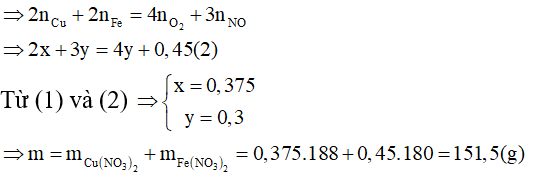
⇒ Đáp án B
Bài 9: Cho m gam hỗn hợp X gồm Fe2O3; CuO; MgO; FeO; Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung nóng 2m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca(OH)2dư thu được 70 g kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc nóng, dư thu được V khí NO2 (là sản phẩm khử duy nhất ở đktc). Giá trị của V là:
A. 44,8 lít
B. 22,4 lít
C. 17,92 lít
D. 89,6 lít
Lời giải:
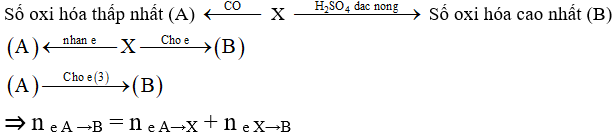
Với m gam X + H2SO4 (đặc nóng):
Bảo toàn e ta có ne cho = ne nhận = = 0,3(mol) = ne X→B
Với 2m gam X phản ứng với CO:
⇒ Bảo toàn electron ta có:
ne cho = ne nhận = = 0,14(mol)
⇒ Với m gam X phản ứng với CO có:
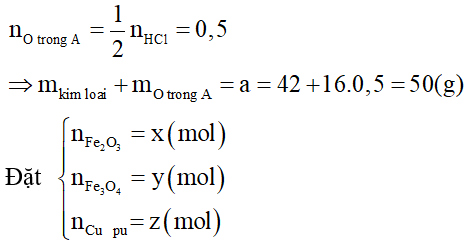
⇒ V = 2.22.4 = 44,8 lít ⇒ Đáp án A
Bài 10: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác khử hoàn toàn a gam hỗn hợp A bằng H2 thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A.
A. 44,8%
B. 50%
C. 32%
D. 25,6%
Lời giải:
Còn lại 1 phần chất rắn không tan ⇒ Cu dư
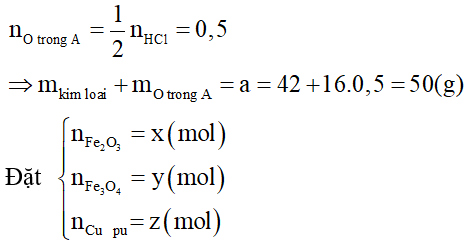
Bảo toàn điện tích ta có: nHCl = 2nO trong A = 6x + 8y (1)
Bảo toàn khối lượng ta có: 160x + 232y + 64z = 50 – 0,256.50 = 37,2g (2)
Cu + 2Fe3+ → Cu2+ +2 Fe2+
Cu + 3Fe+8/3 → Cu2+ + 3Fe2+
Bảo toàn e ta có: x + y = z (3)
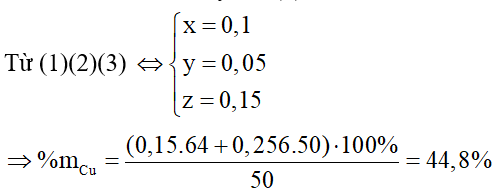
⇒ Đáp án A
Phương pháp bảo toàn khối lượng trong hóa học
Phương pháp giải
1. Nội dung
mtham gia = msản phẩm
Đối với bài toán sử dụng các chất dư sau phản ứng ta có:
mtrước pư = msau pư
Chú ý: Đối với các phản ứng tạo thành chất kết tủa, bay hơi, khối lượng dung dịch sẽ thay đổi sau phản ứng:
mdd sau phản ứng = mdd trước phản ứng + mchất tan – mkết tủa – mbay hơi
2. Phạm vi sử dụng
Thường sử dụng phương pháp bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban đầu ( tham gia) tính khối lượng chất tạo thành sản phẩm hoặc ngược lại
+ Trong bài toán có n chất mà chúng ta biết khối lượng của (n-1) chất ta sẽ tính được khối lượng chất còn lại
+ Những bài toán ta không thể xác định được số mol do không biết được phân tử khối của các chất
Ví dụ minh họa
Ví dụ 1: Cho 23,4 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 13,8 gam Na, thu được 36,75 gam chất rắn. Hai ancol đó là
A. C2H5OH và C3H7OH
B. C3H7OH và C4H9OH
C. C3H5OH và C4H7OH
D. CH3OH và C2H5OH
Giải:
Áp dụng định luật bảo toàn khối lượng, ta có:
mhh acol + mNa = mc/rắn + mH2
⇒ mH2 = mhh acol + mNa - mc/rắn = 23,4 + 13,8 – 36,75 = 0,45g
⇒ nH2 = 0,45/2 = 0,225 mol
⇒ nhỗn hợp ancol = 2 nH2= 2.0,225 = 0,45(mol)
M−ancol = 23,4/0,45 = 52 ⇒ 2 ancol là: C2H5OH và C3H7OH
⇒ Đáp án A
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Ngộ nhận Na tham gia phản ứng hết từ nNa ⇒ nH2 ⇒M−ancol ⇒ Đáp án D
+ Ngộ nhận chất rắn chỉ gồm muối RONa, không tính Na dư và sử dụng phương pháp tăng giảm khối lượng giữa ancol và muối ⇒ Đáp án D
Ví dụ 2: Nhiệt phân hoàn toàn m gam hỗn hợp X gồm CaCO3 và Na2CO3 thu được 11,6 gam chất rắn và 2,24 lít khí (đktc). Thành phần phần trăm khối lượng CaCO3 trong X là
A. 6,25%.
B. 8,62%.
C. 50,2%
D. 62,5%.
Giải:
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mc/rắn + mCO2= 11,6 + 0,1.44 = 16g
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
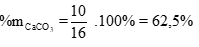
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Na2CO3 không bị nhiệt phân nhưng lại viết phương trình nhiệt phân và tính số mol khí CO2 được sinh ra từ nhiệt phân muối Na2CO3 và chất rắn gồm CaO; Na2O
Ví dụ 3: Hòa tan hoàn toàn 3,9g kali vào 36,2 gam nước thu được dung dịch có nồng độ là:
A. 15,47%
B. 13,97%
C. 14,0%
D. 4,04%
Giải:

Chú ý:
Bài toán này thường mắc lỗi ở việc tính khối lượng dung dịch, quên không trừ đi khối lượng của khí H2 bay đi
Ví dụ 4: X là một α-amonoaxit, phân tử chứa một nhóm –NH2 và một nhóm –COOH. Cho 0,89g X phản ứng vừa đủ với HCl thu được 1,255g muối. Công thức cấu tạo của X là:
A. CH2 = C(NH2) – COOH
B. H2N-CH = CH – COOH
C. CH3 – CH(NH2) – COOH
D. H2N – CH2 – CH2 – COOH
Giải:
HOOC – R – NH2 + HCl → HOOC – R – NH3Cl
Áp dụng định luật bảo toàn khối lượng: mHCl = mmuối – maminoaxit = 0,365g
⇒ nHCl = naminoaxit = 0,01 mol
⇒ Maminoaxit = 0,89: 0,01 = 89
X là α-amonoaxit ⇒ X là: CHm3 – CH(NH2) – COOH ⇒ Đáp án C
Với bài toán trên nếu không sử dụng định luật bảo toàn khối lượng quy ra số mol axit mà việc tính toán dựa trên tỉ lệ giữa muối và aminoaxit để tìm ra khối lượng phân tử của aminoaxit thì việc tính toán rất phứ tập
Ví dụ 5: Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng CO đi qua ống sứ đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 gam chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Tính giá trị m.
A. 105,6 gam.
B. 35,2 gam.
C. 70,4 gam.
D. 140,8 gam.
Giải:
Khí B gồm: COdư ( x mol) và CO2 (y mol)
nB = x + y = 0,5 mol (1)
MB = 20,4.2 = 40,8g ⇒ mB = 40,8.0,5 = 20,4g
⇒ 28x + 44y = 20,4g (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,4 mol
Ta có: nCO pư = nCO2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng:
mX + mCO = mA + mCO2
⇒ mCOX = mCOA + mCOCO2 - mCO2 = 64 + 0,4.44 – 0,4.28 = 70,4g
⇒ Đáp án C
Nếu không sử dụng định luật bảo toàn khối lượng để quy ra số mol CO2 và CO pư mà việc tính toán dựa trên đặt ẩn số mol của các oxit thì việc giải ra kết quả rất phức tạp và liên quan đến việc sử dụng toán học khá nhiều
Ví dụ 6: Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4; 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là:
A. 0,3
B. 0,2
C. 0,4
D. 0,1
Giải:
MY = 11.2 = 22
mX = 0,1.26 + 0,2,28 + 0,3.2 = 8,8g
Áp dụng định luật bảo toàn khối lượng:
mX = mY = 8,8g ⇒ nY = 8,8: 22 = 0,4 mol
nkhí giảm = nH2 pư = nX – nY = 0,6 – 0,4 = 0,2 mol
Ta có: n = nH2 pư + nBr2 = 2nC2H2 + nC2H4 = 0,4 mol
⇒ nBr2 = 0,4 – 0,2 = 0,2 mol = a
⇒ Đáp án B
Việc áp đụng định luật bảo toàn khối lượng để thiết lập mối quan hệ số mol trước và sau phản ứng đã giúp cho bài toán thu gọn các bước giải và việc giải toán đơn giản hơn thay vì đặt ẩn các mol chất khí sau phản ứng để giải hệ
Bài tập tự luyện
Bài 1: Anđêhit mạch hở A tác dụng với H2 theo tỷ lệ mol nA:nH2=1:2 và tráng gương theo tỷ lệ mol nA:nH2=1:2. Đốt cháy hoàn toàn m gam A cần vừa đúng V lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được a gam kết tủa. liên hệ giữa m với V và a là:
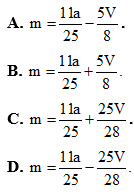
Lời giải:
Theo giả thiết, có A là anđehit 2 chức no mạch hở có công thức phân từ tổng quát là CnH2n-2O2.
Phương trình đốt cháy:
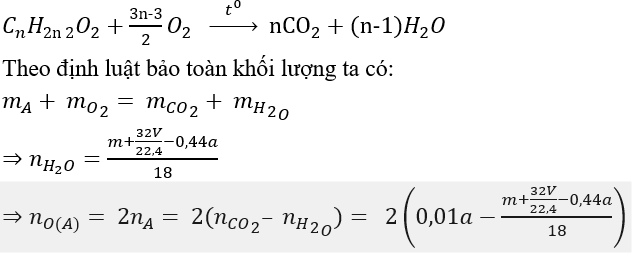
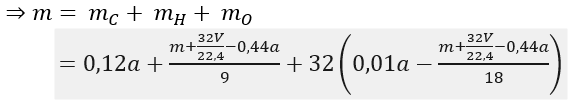
Bài 2: Có 500 ml dung dịch X chứa các ion: K+, HCO3-, Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 g.
B. 14,175 g.
C. 11,850 g.
D. 10,062 g.
Lời giải:
Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol k+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình:
2HCO3- ⇒ CO32- + CO2 + H2O.
Do đó nCO32- = 0,0375
Vậy khối lượng chất rắn khan thu được là: mK+ + mBa2+ + mCO32- + mCl- = 11,85 (gam)
⇒ Đáp án C
Bài 3: Thực hiện tổng hợp tetrapeptit từ 3,0 mol glyxin; 4,0 mol alanin và 6,0 mol valin. Biết phản ứng xảy ra hoàn toàn. Khối lượng tetrapeptit thu được là
A. 1510,5 g.
B. 1120,5 g.
C. 1049,5 g.
D. 1107,5 g.
Lời giải:
Cứ 4 phân tử amino axit kết hợp với nhau để tạo ra tetrapeptit thì giải phóng ra 3 phân tử nước.
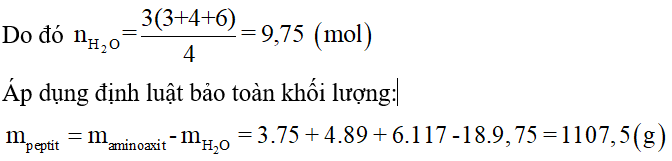
⇒ Đáp án D
Bài 4: Cho m gam butan qua xúc tác (ở nhiệt độ thích hợp), thu được hỗn hợp gồm 5 hiđrocacbon. Cho hỗn hợp khí này sục qua bình đựng dung dịch nước brom dư thì lượng brom tham gia phản ứng là 25,6 gam và sau thí nghiệm bình brom tăng 5,32 gam. Hỗn hợp khí còn lại sau khi qua dung dịch nước brom có tỉ khối so với metan là 1,9625. Giá trị của m là
A.17,4.
B.8,7.
C.5,8.
D.11,6.
Lời giải:
Phương trình phản ứng:
C4H10 ⇒ CH4 + C3H6
C4H10 ⇒C2H4+C2H6
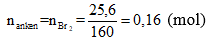
Gọi x là số mol butan còn dư. Số mol khí thoát ra khỏi bình bằng số mol butan ban đầu.
Khi đó: khối lượng khí đi ra khỏi bình là:
m = mbutan ban đầu - mkhí bị hấp thụ = 58.(x +0,16) - 5,32.
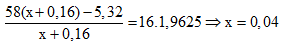
⇒mbutan ban đầu = 58(l + x) = 11,6(g) ⇒ Đáp án D
Bài 5: Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20 gam chất rắn Z và dung dịch E; cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa nung ngoài không khí nhận được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là
A. 0,24M và 0,5M.
B. 0,12M và 0,36M
C. 0,12M và 0,3M.
D. 0,24M và 0,6M.
Lời giải:
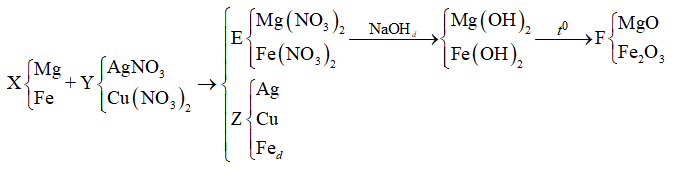
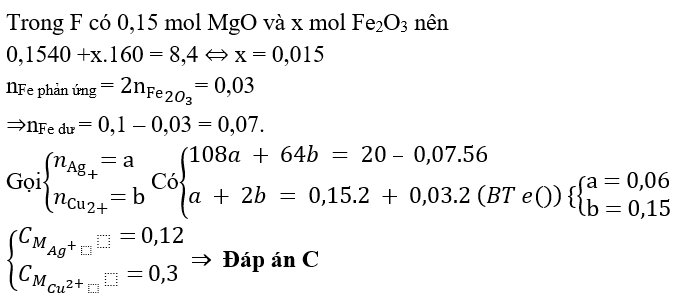
Bài 6: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là
A. 10,8 và 4,48.
B. 17,8 và 4,48.
C. 17,8 và 2,24.
D. 10,8 và 2,24.
Lời giải:
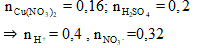
Vì thu được hỗn hợp bột kim loại nên Fe còn dư sau các phản ứng, trong dung dịch chứa Fe2+.
Coi các quá trình phản ứng xảy ra như sau:
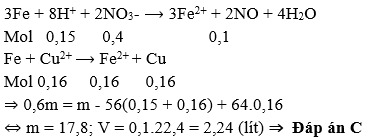
Bài 7: Cho 3,6 gam axit cacboxylic no, đơn chức X tác dụng hoàn toàn vói 500 ml dung dịch gồm KOH 0,12M và NaOH 0,12M. Cô cạn dung dịch thu được 8,28 gam hỗn hợp chất rắn khan. Công thức phân tử của X là
A.C3H7COOH.
B.HCOOH.
C.C2H5COOH.
D.CH3COOH.
Lời giải:
nNaOH = 0,06; nKOH =0,06
Có RCOOH + MOH ⇒ RCOOM + H2O
Theo định luật bảo toàn khối lượng ta có:
mX +mNaOH + mKOH = mrắn khan + mH2O
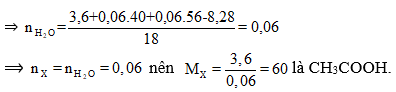
Đáp án D
Bài 8: Cho 37,95g hỗn hợp hai muối MgCO3 và RCO3 vào 100ml dd H2SO4 loãng thấy có 1,12 lít CO2 (đktc) thoát ra, dung dịch A và chất rắn
B. Cô cạn dung dịch A thu được 4g muối khan. Nung chất rắn B đến khối lượng không đổi thì thu được rắn B1 và 4,48 lít CO2 (đktc). Biết trong hỗn hợp đầu có tỉ lệ nRCO3: nMgCO3 = 3:2. Khối lượng chất rắn B1 và nguyên tố R là
A. 27,85g va Ba.
B. 26,95g và Ca.
C. 27,85g và Ca.
D. 26,95g và Ba.
Lời giải:
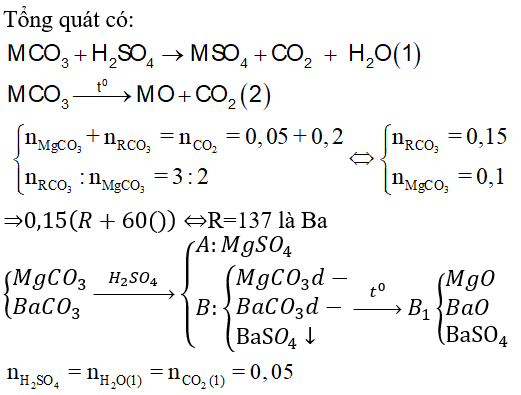
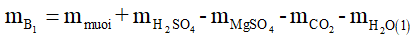
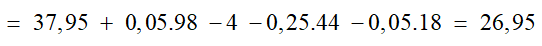
⇒ Đáp án D
Bài 9: Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml H2O (lỏng). Tính thành phân trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
A. 60,0% C2H5OH; 40,0% CH3COOH và hiệu suất 75%.
B. 45,0% C2H5OH; 55,0% CH3COOH và hiệu suất 60%.
C. 55,3% C2H5OH; 44,7% CH3COOH và hiệu suất 80%.
D. 53,5% C2H5OH; 46,5% CH3COOH và hiệu suất 80%.
Lời giải:
Gọi nC2H5OH = x ; nCH3COOH = y . Đốt cháy sản phẩm cũng như đốt hỗn hợp ban đầu, theo định luật bảo toàn nguyên tố H ta có: 6nC2H5OH + 4nCH3COOH = 2nH2O
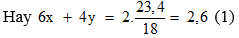
Phương trình theo khối lượng: 46x+60y = 25,8 (2)
Từ (1) và (2) suy ra x = 0,3;y = 0,2
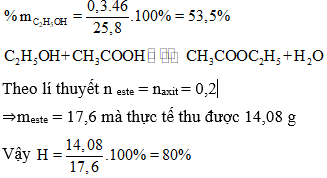
⇒ Đáp án D
Bài 10: Lấy V (ml) dung dịch H3PO4 35% (d = 1,25 g/ml) đem trộn với 200 ml dung dịch KOH 1M thu được dung dịch chứa 14,95 (g) muối. Giá trị V là:
A. 18,48 (ml).
B. 16,8 (ml).
C. 25(ml).
D. 33,6 (ml).
Lời giải:
Dung dịch chỉ chứa muối nên KOH và H3PO4 hết.
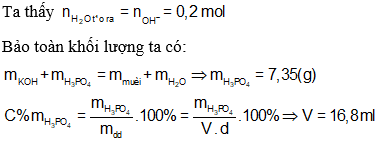
⇒ Đáp án D


