4 dạng bài tập về Amino axit trong đề thi Đại học có giải chi tiết - Hoá học lớp 12
4 dạng bài tập về Amino axit trong đề thi Đại học có giải chi tiết
Với 4 dạng bài tập về Amino axit trong đề thi Đại học có giải chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Amino axit từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

- Công thức chung của amino axit: (H2N)x – R – (COOH)y
- Lưỡng tính: Vừa mang tính axit; vừa mang tính bazơ
Dạng 1: Bài tập đốt cháy amino axit
Phương pháp:
CxHyOzNt + (x + y/4 - z/2) O2 → xCO2 + y/2H2O + 1/2N2
Hoặc có thể viết: (H2N)a – CxHy – (COOH)b
Chú ý:
CTTQ amino axit đơn chức có 1 nhóm -NH2; 1 nhóm –COOH: CnH2n+1O2N
Ví dụ 1 : Amino axit X chứa một nhóm amin bậc I trong phân tử. Đốt cháy hoàn toàn một lượng X thu được VCO2: VN2 = 4:1. Công thức cấu tạo của X là:
A. HOOC – CH2CH(NH2)COOH
C. H2NCH2COOH
B. H2NCH2CH2COOH
D. H2NCH2CH2CH2COOH
Hướng dẫn giải :
Công thức của aminoaxit X có dạng: H2N – CxHy(COOH)n
Phản ứng: H2N – CxHy(COOH)n → (n + x)CO2 + 1/2 N2
Ta có :
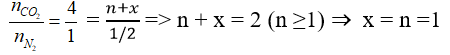
Vậy X là: H2N – CH2COOH
→ Đáp án C
Ví dụ 2 : Đốt cháy hoàn toàn 8,7 g amino axit A (chứa 1 nhóm -COOH) thì thu được 0,3 mol CO2; 0,25mol H2O và 11,2 lít N2 (đktc). Công thức cấu tạo của A là:
A. CH3- CH2 (NH2)-COOH
B. CH3- CH2 (NH2)-COOH
C. CH3 – CH2 – CH2(NH2) - COOH
D. Cả A và B
Hướng dẫn giải :
CTPT: CxHyO2Nt , nN2 = 0,05 mol
mO (A) = mA – mC – mH – mN = 8,7 – 0,3.12 – 0,25.2 – 0,05.2.14 = 3,2
⇒ nO(A) = 0,2
A chỉ chứa 1 nhóm -COOH
⇒ nA = nO: 2 = 0,1 mol
nCO2 = x.nA = 0,1x = 0,3 ⇒ x =3
nH2O = (y/2).nA= 0,05y = 0,25 ⇒ y = 5
nN2 = (t/2).nA = 0,05t = 0,05 ⇒ t = 1
⇒ CTPT C3H5O2N
CTCT A: CH3- CH2(NH2)-COOH ; H2N- CH2 – CH2 - COOH
→ Đáp án D
Dạng 2: Dẫn xuất amino axit
Phương pháp:
Đối với công thức CxHyOzNt có các dạng:
- Amino axit NH2 – R – COOH
- Este của amino axit NH2RCOOR’
- Muối amoni của NH3 hoặc amin (bậc I): RCOONH4 ( RCOOH + NH3 ) hoặc RCOONH3R’ (RCOOH + R’NH2 )
- Hợp chất nitro R-NO2
Ví dụ 1 : Ứng với C3H7NO2 có bao nhiêu đồng phân?
A. 2 B. 3 C. 5 D.6
Hướng dẫn giải :
+ Amino axit: H2N – CH2 – CH2 – COOH; CH3 – CH(NH2) – COOH
+ Este của amino axit: H2N – CH2 – COOCH3
+ Muối: CH2 = CH – COONH4; HCOONH3CH=CH2
+ Hợp chất nitro: CH3 – CH2 – CH2 – NO2
→ Đáp án D
Ví dụ 2 : Hợp chất X mạch hở có công thức phân tử C4H9NO2. Cho 10,3 gam X phản ứng vừa đủ với dung dịch NaOH sinh ra khí Y và dung dịch Z. Khí Y nặng hơn không khí và làm giấy quì tím ẩm chuyển thành màu xanh. Dung dịch Z có khả năng làm mất màu nước Brom. Cô cạn Z thu m gam muối khan. Giá trị m là?
A. 10,8 B. 9,4 C. 8,2 D. 9,6
Hướng dẫn giải :
X tác dụng NaOH tạo khí Y nên X: R1COOH3NR2
Dung dịch Z làm mất màu nước Brom nên R1 có liên kết đôi C=C, suy ra R1 ≥ 27 (1)
Khí Y làm giấy quỳ tím ẩm hóa xanh nên Y: R2NH2 và MY > 29 =>R2 + 16 > 29
⇒ R2 >13 (2)
Ta có: MX = R1 + R2 + 67 = 103 suy ra R1 + R2 = 42 (3)
Từ (1), (2), (3) R1= 27: CH2=CH- và R2 = 15: CH3-
CH2=CH-COOH3NCH3 + NaOH → CH2=CH-COONa + CH3NH2 + H2O
0,1mol → 0,1 mol
Giá trị m = 0,1.94 = 9,4 gam
→ Đáp án B
Dạng 3: Amino axit tác dụng với axit hoặc bazơ
Phương pháp:

Ví dụ 1 : X là một amino axit. Khi cho 0,01 mol X tác dụng với HCl thì dùng hết 80ml dung dịch HCl 0,125M và thu được 1,835g muối khan. Còn khi cho 0,01mol X tác dụng với dung dịch NaOH thì cần dùng 25g dung dịch NaOH 3,2%. Công thức cấu tạo của X là:
A. H2N – C3H6 – COOH
B. H2N – C2H4 – COOH
C. H2N – C3H5(COOH)2
D.(H2N)2C3H5 – COOH
Hướng dẫn giải :
nHCl = 0,01 = na.a⇒ X có 1 nhóm –NH2
nNaOH = 0,02 mol = 2nX ⇒X có 2 nhóm –COOH
X có dạng: H2N – R – (COOH)2
nmuối = nHCl = 0,01 ⇒ H2N – R – (COONa)2 = 1,835: 0,01 ⇒R =41(-C3H5)
→ Đáp án D
Ví dụ 2 : Cho 10,3 gam aminoaxit X tác dụng với HCl dư thu được 13,95 gam muối. Mặt khác, cho 10,3 gam amino axit X tác dụng với NaOH (vừa đủ) thu được 12,5 gam muối. Vậy công thức của aminoaxit là:
A. H2N-C3H6-COOH
B. H2N-(CH2)4CH(NH2)-COOH
C. H2N-C2H4-COOH
D. HOOC-(CH2)2-CH(NH2)-COOH
Hướng dẫn giải :
X + HCl:
Áp dụng định luật bảo toàn khối lượng: mHCl = mmuối – mX = 3,65
nHCl = n -NH2 =0,1 mol
X + NaOH:
nNaOH = n–COOH = (mmuối – ma.a)/22 = 0,1
n–NH2 = n –COOH ⇒ Dựa vào đáp án amino axit đơn chức chỉ chứa 1 nhóm – COOH và 1 nhóm – NH2
⇒ na.a = nHCl = 0,1 ⇒ MX = 10,3: 0,1 = 103 ⇒ X là: H2N – C3H6 –COOH
→ Đáp án A
Dạng 4: Amino axit tác dụng với axit sau đó lẫy hỗn hợp tác dụng với bazơ và ngược lại
Phương pháp:
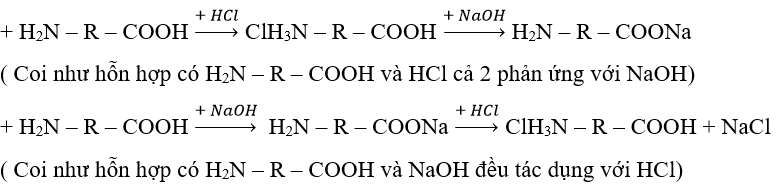
Ví dụ 1 : Cho amino axit X tác dụng vừa đủ với 16,6 ml dung dịch HCl 20% (d = 1,1 g/ml) thu được muối Y. Y tác dụng vừa đủ với 400 ml dung dịch NaOH 0,5M thu được dung dịch Z. Cô cạn cẩn thận dung dịch Z thu được 15,55 gam muối khan. Công thức của X là:
A. H2N-C2H4-COOH
B. H2N-CH2-COOH
C. H2N-C3H6-COOH
D. H2N-C3H4-COOH
Hướng dẫn giải :
nHCl = 0,1 mol; nNaOH = 0,2 mol
⇒ na.a = 0,2 – 0,1 = 0,1
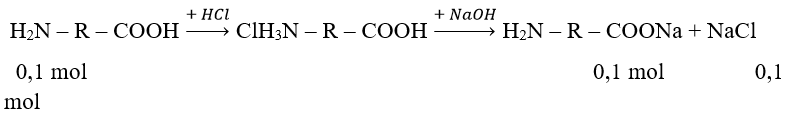
m (H2N – R – COONa) = 15,55 – 0,1.58,5 = 9,7
M (H2N – R – COONa) = 9,7: 0,1 = 97
R = 14 (-CH2-)
→ Đáp án A
Ví dụ 2 : Cho 0,1 mol amino axit X tác dụng vừa đủ với 100ml NaOH 1M thu được chất hữu cơ Y. Cho Y tác dụng với dung dịch HCl thu được 18,4g muối. Vậy công thức của amino axit X là:
A. H2N – CH2 – CH2 – COOH
B. CH3 – CH(NH2) – COOH
C. H2N – CH2 – COOH
D. HOOC – CH2 – CH2 – CH(NH2) – COOH
Hướng dẫn giải :
nNaOH = na.a ⇒ X chỉ chứa 1 nhóm –COOH ( kết hợp với đáp án X chỉ có 1 –NH2)
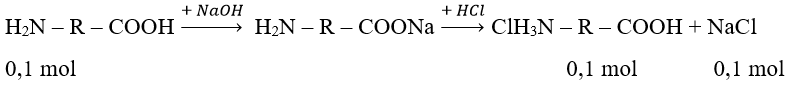
Muối gồm: ClH3N – R – COOH (0,1 mol); NaCl (0,1 mol)
⇒ m(ClH3N – R – COOH) = 18,4 – 0,1.58,5 = 12,55
⇒ M (ClH3N – R – COOH) = 12,55: 0,1 = 125,5
⇒ R = 28 ( - CH2 – CH2 - )
⇒ X là: H2N – CH2 – CH2 – COOH
→ Đáp án A

