Phương pháp sử dụng phương trình ion thu gọn trong hóa học cực hay, có lời giải - Hoá học lớp 12
Phương pháp sử dụng phương trình ion thu gọn trong hóa học cực hay, có lời giải
Với Phương pháp sử dụng phương trình ion thu gọn trong hóa học cực hay, có lời giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập sử dụng phương trình ion thu gọn trong hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Phương pháp giải
1. Nội dung
Phương trình hóa học thường được viết dưới hai dạng là phương trình hóa học ở dạng phân tử và dạng ion rút gọn. Ngoài việc thể hiện đúng bản chất của phản ứng hóa học, phương trình ion thu gọn còn giúp giải nhanh rất nhiều dạng bài tập khóa học không thể giải theo các phương trình hóa học ở dạng phân tử.
2. Phạm vi sử dụng
Vì để rút gọn phương trình phân tử thành phương trình ion rút gọn ta sử dụng cho các chất điện li mạnh, do vậy phương pháp này áp dụng chủ yếu cho các chất axit bazơ, muối trong vô cơ ( các chất hữu cơ thường là chất điện li yếu)
+ Phản ứng axit, bazơ và xác định pH của dung dịch
+ Bài toán CO2 , SO2 tác dụng với dung dịch bazơ
+ Bài toán liên quan tới oxit, hiđroxit lưỡng tính
+ Bài toán chất khử tác dụng với dung dịch chứa H+ và NO3-
+ Các phản ứng ở dạng ion thu gọn tạo ra chất kết tủa, chất dễ bay hơi, chất điện li yếu
Ví dụ minh họa
Ví dụ 1: Khi cho 41,4 gam X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư), sau phản ứng được 16 gam chất rắn. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm, phải dùng 10,8 gam Al. Phần trăm khối lượng của Cr2O3 trong X là (H= 100%)
A. 50,67%.
B. 20,33%.
C. 66,67%.
D. 36,71%.
Giải:
Khi cho X vào dung dịch NaOH đặc, dư có các phản ứng:
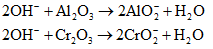
Do đó 16 gam chất rắn còn lại sau phản ứng là khối lượng của Fe2O3. Ta có: nFe2O3 = 0,1 , nAl = 0,4 .
Các phản ứng nhiệt nhôm diễn ra:
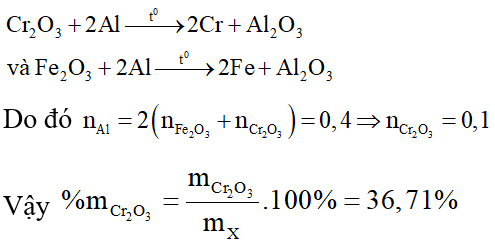
⇒Đáp án D
Ví dụ 2: Cho m gam Fe vào bình chứa dung dịch gồm H2SO4 và HNO3, thu được dung dịch X và 1,12 lít khí NO. Thêm tiếp dung dịch H2SO4 dư vào bình thu được 0,448 lít khí NO và dung dịch Y. Biết trong cả hai trường hợp khí NO là sản phẩm khử duy nhất, đo ở điều kiện tiêu chuẩn. Dung dịch Y hòa tan vừa hết 2,08 gam Cu (không tạo thành sản phẩm khử của N+5 ). Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là:
A. 3,92
B. 2,40
C. 4,20
D. 4,06
Giải:

Khi cho Fe vào dung dịch chứa H2SO4 và HNO3 chỉ thu được khí NO, khi đó sau khi một phần Fe phản ứng với H+ và tạo Fe3+ thì lượng Fe còn lại phản ứng với Fe3+ được Fe2+. Do đó dung dịch X chứa Fe2+ và Fe3+ :
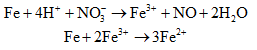
Khi cho thêm tiếp H2SO4 dư vào dung dịch X thì trong dung dịch có thêm H+, khi đó một phần Fe2+ trong dung dịch phản ứng với H+ (mới cung cấp thêm) và NO3- lại thu được Fe3+, phản ứng diễn ra cho đến khi NO3- trong dung dịch hết (điều này cũng cho biết lí do vì sao khi cho Cu vào dung dịch Y thì không tạo thành sản phẩm khử của N+5: do trong dung dịch có H+ nhưng không có NO3-):
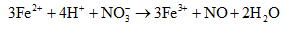
Do đó dung dịch X và dung dịch Y đều chứa Fe2+ và Fe3+ nhưng số mol của hai ion này trong hai dung dịch là khác nhau.
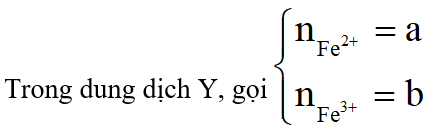
Theo định luật bảo toàn mol electron áp dụng cho toàn bộ quá trình từ hòa tan Fe đến khi thu được dung dịch Y, ta có:
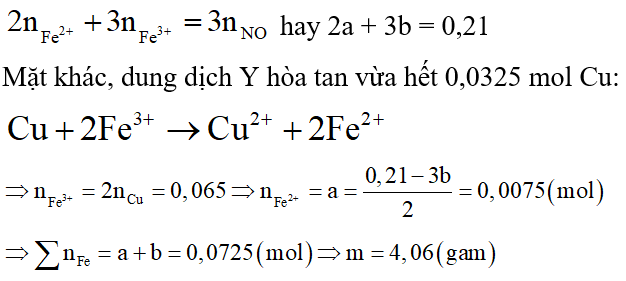
⇒Đáp án D
Ví dụ 3: Hòa tan hết 2,08 gam hỗn hợp Fe và Cu bằng dung dịch HNO3 thu được dung dịch X và 672 ml khí NO (đktc). Thêm từ từ 1,2 gam Mg vào dung dịch X đến khi phản ứng hoàn toàn thu được 224ml khí NO (đktc), dung dịch Y và m gam chất rắn không tan. Biết trong các thí nghiệm trên NO là sản phẩm khử duy nhất. Giá trị của m là
A. 1,71
B. 1,52
C. 1,44
D. 0,84
Giải:
Vì khi cho Mg vào dung dịch X thì vẫn thu được khí NO nên trong dung dịch X có HNO3 dư.
Khi trong dung dịch X có HNO3 dư thì cả Fe và Cu đều tan hết và được đưa lên mức số oxi hóa tối đa, lần lượt là +3 và +2.

Do đó chất rắn thu được sau phản ứng gồm 0,015 mol Cu và 0,01 mol Fe.
Vậy m = m Fe + m Cu = 1,52 (gam)
⇒ Đáp án B
Ví dụ 4: Chia 30,4 gam hỗn hợp gồm Fe và Cu thành hai phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan phần 2 trong 550ml dung dịch AgNO3 1M, kết thúc phản ứng thu được dung dịch Y. Nồng độ mol của Fe(NO3)2 trong dung dịch Y (coi thể tích dung dịch không đổi trong quá trình xảy ra phản ứng) là:
A. 0,181M.
B. 0,363M.
C. 0,182M.
D. 0,091M.
Giải:
Khối lượng mỗi phần của hỗn hợp kim loại là 15,2 gam.
Trong mỗi phần, gọi
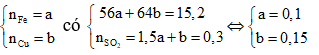
Khi hòa tan phần 2 vào dung dịch chứa 0,55 mol AgNO3:

⇒ Đáp án D
Ví dụ 5: Hấp thụ hoàn toàn 4,48l khí CO2 ở (đktc) vào 500ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Gía trị của m là:
A. 19,70
B. 17,73
C. 9,85
D. 11,82
Giải:
n CO2 = 0,2 mol; n OH- = n NaOH + 2n Ba(OH)2 = 0,25 mol
1 < n OH-: n CO2 < 2 ⇒ Tạo hỗn hợp muối CO32- và HCO3-
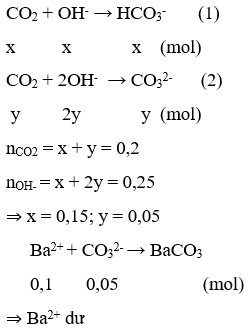
⇒ n BaCO3 = n CO32- = 0,05⇒ m = 0,05 .197 = 9,85g
⇒ Đáp án C
Ví dụ 6: Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chưa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
A. 0,03
B. 0,01
C. 0,02
D.0,015
Giải:
n HCl = 0,03 mol; n Na2CO3 = 0,02 mol; n NaHCO3 = 0,02 mol
Khi cho từ từ HCl vào dung dịch xảy ra phản ứng theo thứ tự:
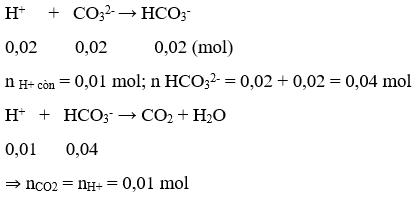
⇒ Đáp án B
Ví dụ 7: Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7.
B. 2.
C. 1.
D. 6.
Giải:

Ví dụ 8: Cho 6,72g Fe vào 400ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO ( sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hòa tan tối đa được m gam Cu. Gía trị m là:
A. 1,92
B. 0,64
C. 3,84
D. 3,20
Giải:
n Fe = 0,12 mol; n HNO3 = 0,4 mol
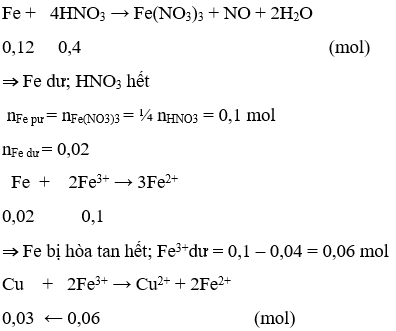
m Cu = 1,92g ⇒ Đáp án A
Ví dụ 9: Hỗn hợp X gồm Cu và kim loại M hóa trị II. Cho X tác dụng với dung dịch HCl dư thu được 11,2l khí (đktc), chất rắn Y nặng 10g và dung dịch Z. Thêm NaOH dư vào Z thu được kết tủa T. Nung T đến khối lượng không đổi thu được 20g chất rắn. Kim loại M và khối lượng hỗn hợp X là:
A. Mg và 30g
B. Mg và 22g
C. Fe và 38g
D. Zn và 42,5g
Giải:
Cu không tác tụng với HCl
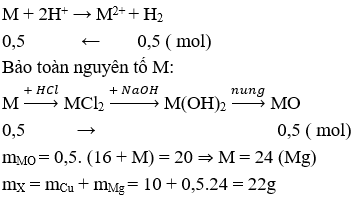
⇒ Đáp án B
Ví dụ 10: Hòa tan hoàn toàn 5,91 gam NaCl và KBr vào 100 ml dung dịch hỗn hợp Cu(NO3)2 0,1M và AgNO3 a mol/l, thu được 11,38 gam kết tủa. Cho miếng kẽm vào dung dịch Y, sau khi phản ứng xong lấy miếng kẽm ra khỏi dung dịch, thấy khối lượng miếng kẽm tăng 1,1225 gam. Giá trị của a là:
A. 0,85
B. 0,5
C. 0,775
D. 0,7
Giải:
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+ . Do AgNO3 dư nên đặt nNaCl = x, nKBr = y;
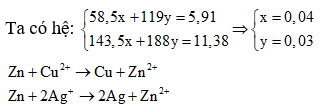
Gọi khối lượng thanh kẽm là m. Đặt n Zn phản ứng với Ag+ là b, sử dụng phương pháp tăng giảm khối lượng ta được:
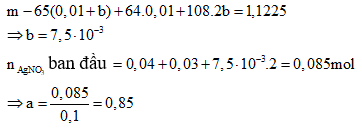
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Cho 50g dung dịch A chứa 1 muối halogen kim loại hóa trị II tác dụng với dung dịch AgNO3 dư thì thu được 9,40g kết tủa. Mặt khác, dùng 150g dung dịch A trên phản ứng với dung dịch Na2CO3 dư thì thu được 6,30g kết tủa. Lọc kết tủa đem nung đến khối lượng không đổi, khí thoát ra cho vào 80g dung dịch KOH 14,50%. Sau phản ứng nồng độ dung dịch KOH giảm còn 3,80%. Xác định công thức phân tử của muối halogen trên.
A. CaCl2
B. BaI2
C. MgBr2
D. BaCl2
Lời giải:
Hướng dẫn giải:
Gọi công thức muối cần tìm là MX2
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
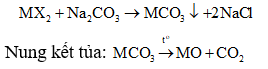
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
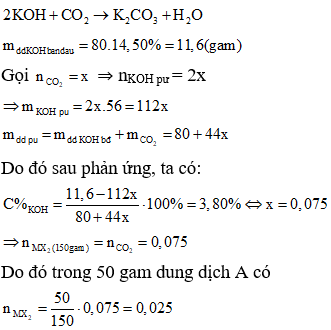
Khi cho dung dịch A tác dụng với dung dịch AgNO3:
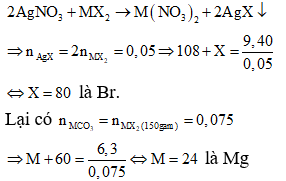
Vậy công thức của muối cần tìm là MgBr2.
⇒ Đáp án C
Bài 2: Hỗn hợp X chứa đồng thời hai muối natri của hai halogen liên tiếp trong bảng tuần hoàn. Lấy một lượng X cho tác dụng vừa đủ với 100 ml dung dịch AgNO3 1M thì thu được 15 gam kết tủa. Công thức phân tử của hai muối trong X là:
A. NaF và NaCl
B. NaBr và NaI
C. NaCl và NaI
D. NaCl và NaBr
Lời giải:
Hướng dẫn giải:
nAgNO3 = 0,1 (mol)
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
Đặt công thức chung của hai muối là
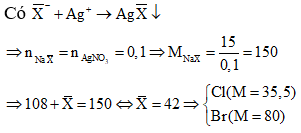
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
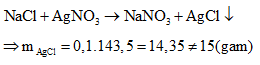
Do đó trường hợp này không thỏa mãn.
⇒ Đáp án D
Bài 3: Một hỗn hợp X gồm 3 muối halogenua của kim loại natri nặng 6,23 gam hòa tan hoàn toàn trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng được 3,0525 gam muối khan B. Lấy một nửa lượng muối này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 3,22875 gam kết tủa. Hỗn hợp X ban đầu không có muối:
A. NaF
B. NaCl
C. NaBr
D. Đ/a khác
Lời giải:
Hướng dẫn giải:
Giả sử lượng muối khan B thu được sau khi cho clo dư vào dung dịch A chỉ có NaCl.
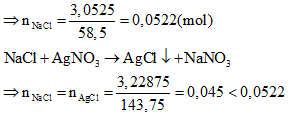
Do đó muối khan B thu được ngoài NaCl còn có NaF.
Vậy trong hỗn hợp X chứa NaF với 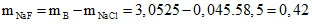
Gọi công thức chung của hai muối halogen còn lại là NaY
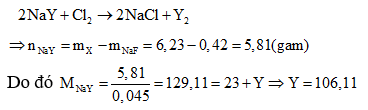
Do đó cần có một halogen có nguyên tử khối lớn hơn 106, 11
Khi đó halogen này chỉ có thể là I.
Suy ra công thức của muối thứ hai là NaI.
Do đó có 2 trường hợp:
+) Trường hợp 1: Hỗn hợp X chứa NaF, NaCl và NaI.
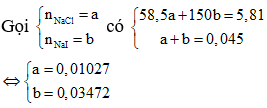
+) Trường hợp 2: Hỗn hợp X chứa NaF, NaBr và NaI
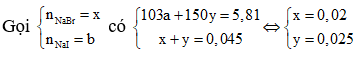
Do đó cả hai trường hợp đều thỏa mãn.
⇒ Đáp án D
Bài 4: Cho 270ml dung dịch Ba(OH)2 0,2M vào dung dịch X chứa 0,025 mol CO32- ; 0,1 mol Na+; 0,25 mol NH4+ và 0,3 mol Cl- và đun nóng nhẹ ( giả sử H2O bay hơi không đáng kể). Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau phản ứng giảm đi bao nhiêu gam:
A. 4,215g
B. 5,296g
C. 6,761g
D. 7,015g
Lời giải:
Hướng dẫn giải:

⇒ Đáp án C
Bài 5: Cho hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Al và Al2O3 trong 500 dung dịch NaOH 1M thu được 6,72 lít H2 (đktc)Và dung dịch X. Thể tích HCl 2M tối thiểu cần cho vào X để thu được lượng kết tủa lớn nhất:
A. 0,175 lít.
B. 0,25 lít.
C. 0,25 lít.
D. 0,52 lít.
Lời giải:
Hướng dẫn giải:
Dung dịch X chứa các ion Na+ ; AlO2- ; OH- dư (có thể). Áp dụng định luật Bảo toàn điện tích:
n AlO2- + n OH- = n Na+ = 0,5
Khi cho HCl vào dung dịch X:
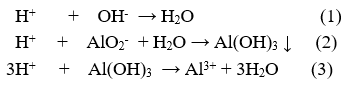
Để kết tủa là lớn nhất, thì không xảy ra (3) và n H+ = n AlO2- + n OH- = 0,5 mol
⇒ V HCl = 0,5/2 = 0,25 (lít) ⇒ Đáp án C
Bài 6: Nhỏ từ từ từng giọt cho đến hết 300 ml dung dịch NaHCO3 0,1M; K2CO3 0,2M vào 100 ml dung dịch HCl 0,2M; NaHSO4 0,6M và khuấy đều thu được V lít CO2 thoát ra (đktc) và dung dịch X. Thêm vào dung dịch X 100 ml dung dịch KOH 0,6M; BaCl2 1,5M thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V và m là:
A. 1,0752 và 22,254.
B. 0,448 và 25,8.
C. 0,448 và 11,82.
D. 1,0752 và 20,678.
Lời giải:
Hướng dẫn giải:
Chú ý đổ từ từ muối Na2CO3 và NaHCO3 vào dung dịch H2SO4 thì xảy ra đồng thời các phương trình ( HSO4- coi như chất điện ly hoàn toàn tạo ra SO42- và H+)
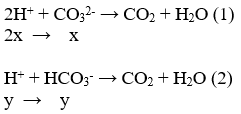
Ta có 2x+ y = 0,08 mol
Vì phản ứng xảy ra đồng thời nên x: y = n CO32-: n HCO3- = 0,06: 0,03 = 2:1
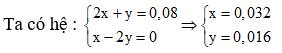
Vậy n CO2 = 0,032 + 0,016 = 0,048 mol ⇒ V= 1,0752 l
Vậy dung dịch X chứa: HCO3- dư: 0,014 mol; CO32- :0,028 mol; SO42-:0,06 mol
Khi cho 0,15 mol BaCl2 và 0,06 mol KOH vào dung dịch X xảy ra các pt sau:
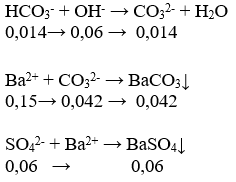
Vậy m kết tủa = 0,06×233+ 0,042×197 = 22,254 gam
⇒ Đáp án A
Bài 7: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,0M và KHCO3 1,5M. Nhỏ từ từ từng giọt và khuấy đều cho đến hết 250 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc) đồng thời thu được dung dịch Y. Cho lượng dư dung dịch Ca(OH)2 vào dung dịch Y thu được a gam chất kết tủa. Giá trị của a là
A. 15,0.
B. 10,0.
C. 25,0.
D. 12,5.
Hướng dẫn giải:
Lời giải:
Phương trình phản ứng:
H+ + CO32- → HCO3- (1)
n CO32- = 0,1 mol < n H+= 0,25 mol ⇒ sau phản ứng (1) thì H+ dư = 0,15 mol,
∑n HCO3- = 0,25 mol
H+ + HCO3- → CO2 + H2O (2)
Vì n H+ < n HCO3- ⇒ dung dịch X có chứa HCO3- dư = 0,25 -0,15 = 0,1 mol
Khi cho Ca(OH)2 vào dung dịch X :
OH- + HCO3- → CO32- + H2O
n CO32- = n HCO3- = 0,1 mol
⇒ m kết tủa = 0,1×100 = 10 gam ⇒ Đáp án B
Bài 8: Cho một hợp kim Na – Ba tác dụng với nước ( dư) thu được dung dịch C và 3,36 lít H2 ( ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hòa dung dịch X là:
A. 150ml
B. 75ml
C. 60ml
D. 30ml
Lời giải:
Hướng dẫn giải:
Na + H2O → NaOH + ½ H2
Ba + H2O → Ba(OH)2 + H2
Ta có: n OH- = 2n H2 = 0,3 mol
Khi cho axit vào ta có:
H+ + OH- → H2O
n H+ = n OH- = 0,3 mol ⇒ n H2SO4 = 0,15 mol
⇒ V H2SO4 =0,15/2= 0,075l = 75ml
⇒ Đáp án B
Bài 9: Có ba dung dịch riêng biệt: H2SO4 1M; KNO3 1M; HNO3 1M được đánh số ngẫu nhiên là (1), (2), (3).
- Trộn 5 ml dung dịch (1) với 5 ml dung dịch (2), thêm bột Cu dư, thu được V1 lít khí NO.
- Trộn 5 ml dung dịch (1) với 5 ml dung dịch (3), thêm bột Cu dư, thu được 2V1 lít khí NO.
- Trộn 5 ml dung dịch (2) với 5 ml dung dịch (3), thêm bột Cu dư, thu được V2 lít khí NO.
Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. So sánh nào sau đây đúng?
A. V2 = 2V1
B. 2V2 = V1
C. V2 = 3V1
D. V2 = V1
Lời giải:
Hướng dẫn giải
* Tìm thành phần của các dung dịch đánh số:
Ta có phản ứng hòa tan kim loại Cu:
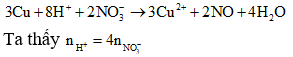
Khi cặp dung dịch KNO3 và HNO3 cùng số mol (cùng nồng độ mol và sử dụng cùng một lượng thể tích) thì có nH+ :nNO3- =1:1 và cặp dung dịch KNO3 và H2SO4 cùng số mol (cùng nồng độ mol và sử dụng cùng một lượng thể tích) thì có nH+ :nNO3- =2:1
Do đó NO3- đều dư so với số mol H+ nên hai cặp dung dịch này khi cho tác dụng với Cu thì lượng khí NO sinh ra đều tính theo số mol H+.
Mà cùng thể tích thì 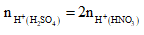
Mặt khác, quan sát hai thí nghiệm thứ nhất và thứ hai ta thấy: ở thí nghiệm thứ hai lượng khí NO thu được gấp đôi lượng khí NO ở thí nghiệm thứ nhất, hai thí nghiệm này sử dụng chung dung dịch (1) và khác nhau ở dung dịch (2) hay dung dịch (3).
Nên dung dịch (1) là KNO3, dung dịch (2) là HNO3 và dung dịch (3) là H2SO4.
* Tìm mối quan hệ giữa V1 và V2:
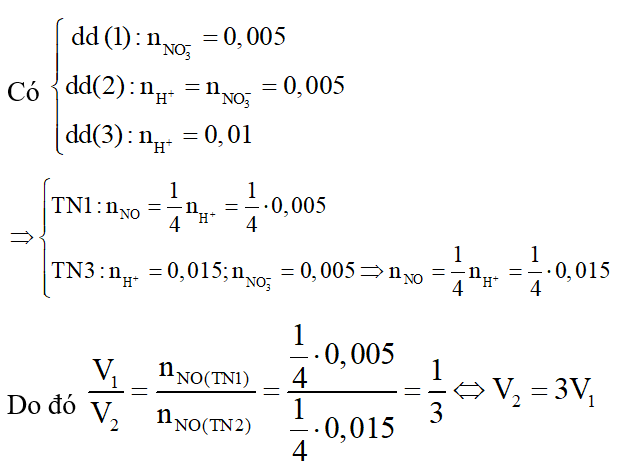
⇒ Đáp án C.
Bài 10: Lấy l,36g hỗn hợp gồm Mg và Fe cho vào 400 ml dung dịch CuSO4 CM, sau khi phản ứng xong thì nhận được l,84g chất rắn Y và dung dịch Z. Cho NaOH dư vào dung dịch Z, lọc kết tủa nung ngoài không khí được l,2g chất rắn (gồm 2 oxit kim loại). Vậy CM của dung dịch CuSO4 là
A. 0,02 M.
B. 0,05 M.
C. 0,08M.
D. 0,12M.
Lời giải:
Hướng dẫn giải:
Các phản ứng xảy ra:
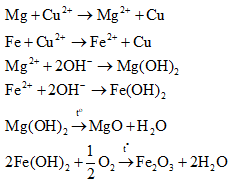
Vì chất rắn thu được cuối cùng gồm 2 oxit kim loại nên 2 oxit này gồm MgO và Fe2O3.
Khi đó Mg và CuSO4 phản ứng hết, Fe có thể phản ứng hết hoặc dư.
Chất rắn Y gồm Cu và Fe dư
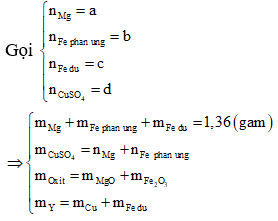
Ta có khi 1 mol Mg phản ứng tạo 1 mol Cu thì khối lượng kim loại tăng (64-24) = 40 gam.
Khi 1 mol Fe phản ứng tạo 1 mol Cu thi khối lượng kim loại tăng (64 - 56) = 8 gam.
Mà a mol Mg và b mol Fe phản ứng với CuSO4.
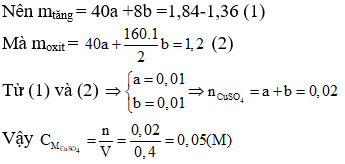
⇒ Đáp án B.

