Bài tập về Sắt (Fe) cực hay, có lời giải chi tiết - Hoá học lớp 12
Bài tập về Sắt (Fe) cực hay, có lời giải chi tiết
Với Bài tập về Sắt (Fe) cực hay, có lời giải chi tiết Hoá học lớp 12 tổng hợp 30 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Sắt (Fe) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Bài 1: Cấu hình electron nào sau đây là cấu hình electron thu gọn của nguyên tử nguyên tố sắt (Z = 26) ?
A. [Ar] 3d8. B. [Ar] 3d74s1.
C. [Ar] 3d64s2. D. [Ar]3d54s24p1.
Lời giải:
Đáp án: C
Cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2
→ Cấu hình thu gọn là [Ar]3d64s2.
Bài 2: Chọn câu trả lời đúng. Trong bảng tuần hoàn các nguyên tố hoá học, vị trí của nguyên tố Fe là
A. Số thứ tự 26, chu kỳ 4, nhóm VIIB, sắt là nguyên tố kim loại nhóm B.
B. Số thứ tự 26, chu kỳ 4, nhóm VIB, sắt là nguyên tố phi kim.
C. Số thứ tự 26, chu kỳ 4, nhóm VIIIB, sắt là nguyên tố kim loại nhóm B.
D. Số thứ tự 26, chu kỳ 4, nhóm VB, sắt là kim loại nhóm B.
Lời giải:
Đáp án: C
Cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2
→ Sắt có số thứ tự 26 do z = 26, chu kỳ 4 do có 4 lớp electron. Sắt có 8e hóa trị, nguyên tố d → Sắt thuộc nhóm VIIIB, là nguyên tố kim loại nhóm B.
Bài 3: Sắt có Z = 26. Cấu hình electron của Fe2+ là
A. [Ar]3d44s2. B. [Ar]3d6.
C. [Ar]3d54s1. D. [Ar]4s23d4.
Lời giải:
Đáp án: B
Cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2
• Fe → Fe2+ + 2e
→ Fe2+ có cấu hình: 1s22s22p63s23p63d6 → [Ar]3d6.
Bài 4: Sắt có Z = 26. Cấu hình electron của Fe3+ là
A. [Ar]3d34s2. B. [Ar]3d5.
C. [Ar]3d44s1. D. [Ar]4s23d3.
Lời giải:
Đáp án: B
Cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2
• Fe → Fe3+ + 3e
→ Fe3+ có cấu hình: 1s22s22p63s23p63d5 → [Ar]3d5.
Bài 5: ngâm một miếng sắt kim loại vào dung dịch H2SO4 loãng. Nếu thêm vào vài giọt dung dịch CuSO4 thì sẽ có hiện tượng là
A. lượng khí bay ra ít hơn.
B. lượng khí bay ra không đổi.
C. lượng khí bay ra nhiều hơn.
D. lượng khí ngừng thoát ra (do Cu bám vào miếng sắt).
Lời giải:
Đáp án: C
Khi ngâm một miếng sắt kim loại vào dung dịch H2SO4 loãng. Nếu thêm vào vài giọt dung dịch CuSO4 thì:
- Ban đầu, Fe tiếp xúc trực tiếp với ion H+ của axit, sắt bị ăn mòn hóa học theo phản ứng:
Fe + 2H+ → Fe2+ + H2↑
Khi H2 sinh ra bám vào bề mặt là sắt, ngăn cản tiếp xúc giữa Fe và H+, giảm tốc độ phản ứng.
-Khi thêm vài giọt CuSO4 vào, vì tính oxi hóa Cu2+ > H+, nên có phản ứng:
Fe + 2Cu2+ → Fe2+ + Cu.
Cu tạo ra bám vào Fe tạo thành hai điện cực (pin điện) và Fe bị ăn mòn điện hóa, vì tính khử Fe > Cu:
Cực âm (Fe): Fe → Fe2+ + 2e, Cực dương (Cu): 2H+ + 2e → H2↑
Khí thoát ra ở cực Cu, nên Fe bị ăn mòn nhanh hơn, lượng khí thoát ra nhiều hơn.
Bài 6: Tính chất vật lí nào dưới đây không phải là tính chất của Fe kim loại?
A. Kim loại nặng, khó nóng chảy.
B. Màu vàng nâu, cứng và giòn.
C. Dẫn điện và nhiệt tốt.
D. Có tính nhiễm từ.
Lời giải:
Đáp án: B
Sắt là kim loại có màu trắng hơi xám, dẻo. dễ rèn.
Bài 7: Trong các phản ứng sau phản ứng nào sai?
A. Fe + 2HCl → FeCl2 + H2.
B. Fe + CuSO4 → FeSO4 + Cu.
C. Fe + Cl2 → FeCl2.
D. 3Fe + 2O2 → Fe3O4.
Lời giải:
Đáp án: C
2Fe + 3Cl2 → 2FeCl3.
Bài 8: Phản ứng nào sau đây đã được viết không đúng?
A. 3Fe + 2O2 -to→ Fe3O4.
B. 2Fe + 3Cl2 -to→ 2FeCl3.
C. 2Fe + 3I2 -to→ 2FeI3.
D. Fe + S -to→ FeS.
Lời giải:
Đáp án: C
Fe + I2 → FeI2
Bài 9: Cho hỗn hợp Fe và Cu vào dung dịch HNO3 thấy thoát ra khí NO và NO2 thu được dung dịch X và một phần kim loại Cu không tan. Muối trong dung dịch X là
A. Fe(NO3)2, Cu(NO3)2. B. Fe(NO3)2.
C. Fe(NO3)3. D. Fe(NO3)3, Cu(NO3)2.
Lời giải:
Đáp án: A
Sau phản ứng có một phần Cu không tan → Dung dịch chỉ gồm Fe(NO3)2 và Cu(NO3)2.
Do: Cudư + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Bài 10: Từ dung dịch FeSO4 có thể điều chế được Fe bằng phương pháp nào? (giả sử các hóa chất và phương tiện có đủ)
A. Thủy luyện. B. Nhiệt luyện.
C. Điện phân. D. Cả 3 phương án trên.
Lời giải:
Đáp án: D
Từ dung dịch FeSO4 có thể điều chế được Fe bằng phương pháp:
- Thủy luyện: Mg + FeSO4 → MgSO4 + Fe↓
- Nhiệt luyện: FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
4Fe(OH)2 + O2 -to→ 2Fe2O3 + 4H2O
Fe2O3 + 3CO -to→ 2Fe + 3CO2
- Điện phân dung dịch: 2FeSO4 + 2H2O Fe + O2 + 2H2SO4
Bài 11: Hòa tan m gam hỗn hợp X gồm Fe và Cu (trong đó Fe chiếm 40% khối lượng) vào dung dịch HNO3 thu được dung dịch Y và 0,448 lít khí NO (sản phẩm khử duy nhất, đo ở đktc) và còn lại 0,65m gam kim loại chưa tan. Khối lượng muối tạo thành trong dung dịch Y là
A. 5,40 gam. B. 6,17 gam.
C. 4,80 gam. D. 7,26 gam.
Lời giải:
Đáp án: A
mCu = 0,6m, mFe = 0,4m.
mchất rắn sau = 0,65m > mCu nên Fe chưa phản ứng hết, Cu chưa phản ứng, dung dịch sau phản ứng chỉ chứa Fe(NO3)2.
Áp dụng định luật bảo toàn electron có: 2.nFe = 3.nNO → nFe = 0,03 mol = nmuối → mmuối = 0,03. 180 = 5,4 gam.
Bài 12: Hoà tan a gam Fe vào dung dịch HCl thu được 2,24 lít khí (ở đktc) và dung dịch D. Cô cạn dung dịch D thu được m gam muối khan. Cho khối lượng muối trên vào 100ml dung dịch KMnO4 0,25M trong H2SO4, sau phản ứng hoàn toàn thu V lít khí (ở đktc). Giá trị V là
A. 2,24. B. 0,28.
C. 1,4. D. 0,336.
Lời giải:
Đáp án: B
nFeCl2 = nH2 = 0,1 mol; nKMnO4 = 0,025 mol
Fe2+ sẽ phản ứng trước với KMnO4 trong HCl, mà thu được khí nên Fe2+ đã phản ứng hết, tiếp là Cl-.
Bảo toàn electron có:
nFe2+ + nCl-(pu) = 5nMn+7
→ nFe2+ + 2nCl2 = 5nMn+7
→ nCl2 = (0,025.5 - 0,1):2 = 0,0125 mol
Vkhí = 0,0125.22,4 = 0,28 lít.
Bài 13: Số oxi hóa chủ yếu của sắt trong hợp chất là
A. +2. B. +3.
C. +2 và +3. D. +8/3, +2, +3.
Lời giải:
Đáp án: C
Trong hợp chất Fe có số oxi hóa +2 hoặc +3.
Bài 14: Cho hỗn hợp Cu và Fe dư vào dung dịch HNO3 loãng, nguội được dung dịch X. Cho dung dịch NaOH vào dung dịch X được kết tủa Y. Kết tủa Y gồm những chất nào sau đây?
A. Fe(OH)3 và Cu(OH)2. B. Fe(OH)2 và Cu(OH)2.
C. Fe(OH)2. D. Không xác định được.
Lời giải:
Đáp án: C
Vì kim loại Fe còn dư nên trong dung dịch X chỉ chứa Fe(NO3)2 nên kết tủa Y là Fe(OH)2.
Bài 15: Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Khối lượng muối tạo thành là
A. 8,18 g. B. 6,5 g.
C. 10,07 g. D. 8,35 g.
Lời giải:
Đáp án: A
Ta có mCu = 2,94 gam, mFe = 1,96 gam, nFe = 0,035 mol; nCu = 0,046 mol.
→ Sau phản ứng còn 2,3 gam < 2,94 gam → chất rắn không tan là Cu, dung dịch sau phản ứng chứa Cu(NO3)2 và Fe(NO3)2.
Có nFe(NO3)2 = nFe = 0,035 mol;
nCu(NO3)2 = nCu pư =
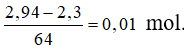
→ mmuối = mFe(NO3)2 + mCu(NO3)2 = 0,035.180 + 0,01. 188 = 8,18 gam.
Bài 16: Nhúng một thanh sắt 11,20 gam vào 200 ml dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh kim loại ra, cô cạn dung dịch được 15,52 gam chất rắn khan. Đem thanh kim loại sau phản ứng cho tác dụng với axit nitric đặc nóng, dư thu được V lít khí duy nhất (27,3oC; 1atm). Giá trị của V là
A. 13,29 lít. B. 11,20 lít.
C. 13,44 lít. D. 16,64 lít.
Lời giải:
Đáp án: A
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Phản ứng: x x mol
Còn lại: 0,2 -x 0,1 -x x x mol
Sau khi cô cạn dung dịch: mchất rắn = mCuSO4 + mFeSO4 → 15,52 = 160(0,1-x) + 152x → x= 0,06 mol.
Thanh kim loại sau phản ứng chứa: 0,06 mol Cu, 0,14 mol Fe.
Đem thanh kim loại phản ứng với HNO3 đặc, nóng. Bảo toàn electron:
→ nkhí = nNO2 = 2nCu + 3nFe = 0,54 mol.
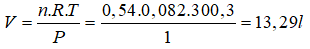
Bài 17: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là
A. 17,8 và 4,48. B. 17,8 và 2,24.
C. 10,8 và 4,48. D. 10,8 và 2,24.
Lời giải:
Đáp án: B
Ta có: nH+ = 0,4 mol, nNO3-: 0,32 mol; nCu2+ = 0,16 mol.
Sau phản ứng thu được 0,6m gam hỗn hợp kim loại → dung dịch sau phản ứng chỉ chứa Fe2+.
4H+ (0,4) + NO3- (0,32) + 3e → NO (0,1 mol) + 2H2O
→ V = 0,1.22,4 = 2,24 lít.
Bảo toàn electron
→ 2nFe pư = 2nCu2+ + 3nNO → nFe pư = (2. 0,16 + 3.0,1):2 = 0,31 mol.
Khối lượng chất rắn gồm Cu: 0,16 mol, Fe dư: m - 0,31.56 = m - 17,36 gam
→ 0,6m = 0,16.64 + m -17,36 → m = 17,8 gam.
Bài 18: Hòa tan hết m gam hỗn hợp A gồm Fe, Cu bằng 800ml dd HNO3 0,5M. Sau khi phản ứng xong thu được dung dịch chứa 26,44 gam chất tan và khí NO. Giá trị m là
A. 6,12. B. 7,84.
C. 5,6. D. 12,24.
Lời giải:
Đáp án: B
4H+ (0,4) + NO3- (0,4) + 3e → NO (0,1 mol) + 2H2O
nNO3- trong muối = 0,4 - 0,1 = 0,3 mol
Ta có mmuối = mkim loại + mNO3-
→ mkim loại = mmuối - mNO3- trong muối = 26,44 - 0,3 × 62 = 7,84 mol.
Bài 19: Hoà tan 2,24 gam Fe bằng dung dịch H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 0,896 lít. B. 2,24 lít.
C. 1,344 lít. D. 0,448 lít.
Lời giải:
Đáp án: C
2Fe (0,04) + 6H2SO4 đ → Fe2(SO4)3 + 3SO2 (0,06 mol) + 6H2O
V = 0,06.22,4 =1,344 lít.
Bài 20: Trong công nghiệp, người ta có thể dùng thùng bằng nhôm hoặc sắt để đựng axit nào sau đây?
A. HNO3 loãng; HCl.
B. H2SO4 đặc, nóng; HNO3 loãng.
C. HCl; H2SO4 loãng.
D. HNO3 đặc, nguội;H2SO4 đặc, nguội.
Lời giải:
Đáp án: D
Al, Fe bị thụ động trong HNO3 đặc, nguội và H2SO4 đặc, nguội.
Bài 21: Quặng giàu sắt nhất trong tự nhiên là
A. Manhetit. B. Pirit.
C. Xiđerit. D. Hematit đỏ.
Lời giải:
Đáp án: A
Quặng giàu sắt nhất trong tự nhiên là manhetit.
Bài 22: Xét phương trình phản ứng: Fe -+X→ FeCl3 -+X→ FeCl2. Hai chất X, Y lần lượt là:
A. HCl, Cu. B. Cl2, Fe.
C. HCl, Cl2. D. Cl2 , NaCl.
Lời giải:
Đáp án: B
2Fe + 3Cl2 → 2FeCl3
2FeCl3 + Fe → 3FeCl2.
Bài 23:Thí nghiệm nào sau đây tạo ra muối sắt (II)?
A. Đun nóng hỗn hợp Fe và S.
B. Đốt dây sắt trong bình khí clo.
C. Cho sắt vào dung dịch HNO3 loãng, dư.
D. Cho FeO tác dụng với dung dịch HNO3, đặc nóng.
Lời giải:
Đáp án: A
Fe + S → FeS
Bài 24: Phương trình hóa học nào sau đây không đúng?
A. 4Cr + 3O2 -to→ 2Cr2O3.
B. Fe+ S -to→ FeS
C. 2Fe + 3H2SO4(loãng) → Fe2(SO4)3 + 3H2.
D. 2Fe + 3Cl2 -to→ 2FeCl3.
Lời giải:
Đáp án: C
Fe + H2SO4(loãng) → FeSO4 + H2
Bài 25: Tính chất vật lý nào dưới đây không phải của sắt?
A. Dẫn điện và dẫn nhiệt tốt.
B. Kim loại nặng, nhiệt độ nóng chảy cao.
C. Có tính nhiễm từ.
D. Là kim loại cứng nhất, có thể cắt được thủy tinh.
Lời giải:
Đáp án: D
Sắt có tính dẻo.
Bài 26: Thể tích clo vừa đủ (đktc) để tác dụng hết với 2,8 gam Fe là
A. 2,24 lit. B. 1,12 lit.
C. 4,48 lit. D. 1,68 lit.
Lời giải:
Đáp án: D
2Fe (0,05) + 3Cl2 (0,075 mol) → 2FeCl3
→ V = 0,075.22,4 = 1,68 lít.
Bài 27: Cho sắt dư vào dung dịch HNO3 loãng thì dung dịch thu được chứa
A. Fe(NO3)2 và Fe(NO3)3.
B. Fe(NO3)2 hay Fe(NO3)3 tùy thuộc vào nồng độ HNO3
C. Fe(NO3)2.
D. Fe(NO3)3.
Lời giải:
Đáp án: C
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2.
Bài 28: Nhúng thanh sắt lần lượt vào các dung dịch sau: CuCl2, AgNO3 dư, ZnCl2, FeCl3, HCl, HNO3 dư. Số trường hợp xảy ra phản ứng tạo hợp chất sắt (II) là
A. 2. B. 5.
C. 3. D. 4.
Lời giải:
Đáp án: C
CuCl2 + Fe → FeCl2 + Cu
2FeCl3 + Fe → 3FeCl2
Fe + 2HCl → FeCl2 + H2
Bài 29: Kim loại sắt có cấu trúc mạng tinh thể
A. lập phương tâm diện
B. lập phương tâm khối
C. lục phương.
D. lập phương tâm khối hoặc lập phương tâm diện.
Lời giải:
Đáp án: D
Tùy thuộc nhiệt độ, kim loại Fe có thể tồn tại ở mạng tinh thể lập phương tâm khối (Feα) hoặc lập phương tâm diện Feγ
Bài 30: Thả cái đinh sắt vào dung dịch đồng (II) clorua. Ở đây xảy ra phản ứng
A. Trao đổi. B. Phân hủy.
C. Hóa hợp. D. Thế.
Lời giải:
Đáp án: D
Fe + CuCl2 → FeCl2 + Cu↓
→ phản ứng thế.

