Phương pháp giải Các dạng bài tập chương Đại cương về kim loại - Hoá học lớp 12
Phương pháp giải Các dạng bài tập chương Đại cương về kim loại
Với Phương pháp giải Các dạng bài tập chương Đại cương về kim loại Hoá học lớp 12 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập chương Đại cương về kim loại từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

- 5 dạng bài tập về kim loại trong đề thi Đại học có giải chi tiết Xem chi tiết
- Dạng 1: Tính chất chung của kim loại Xem chi tiết
- Dạng 2: Chuỗi phản ứng hóa học của kim loại Xem chi tiết
- Dạng 3: Các dạng bài tập về dãy điện hóa kim loại và pin điện hóa Xem chi tiết
- Dạng 4: Phương pháp giải các bài toán về kim loại Xem chi tiết
- Dạng 5: Kim loại tác dụng với dung dịch axit Xem chi tiết
- Dạng 6: Kim loại tác dụng với dung dịch muối Xem chi tiết
Bài tập trắc nghiệm
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (cơ bản) Xem chi tiết
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (nâng cao) Xem chi tiết
Cách giải bài tập Tính chất chung của kim loại hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Lưu ý:
Viết cấu hình electron (hoặc cấu hình electron lớp ngoài cùng) của nguyên tử kim loại, sau đó xác định nguyên tắc:
Số thứ tự ô nguyên tố = số điện tích hạt nhân = số e = Z.
Số thứ tự chu kì = số lớp electron.
Nhóm:
+ Nếu electron cuối cùng thuộc phân lớp s (hoặc p) thì thuộc nhóm A (phân nhóm chính). Lúc đó, số thứ tự nhóm A bằng số electron ở lớp ngoài cùng.
+ Nếu electron cuối cùng thuộc phân lớp d (hoặc f) thì thuộc nhóm B (phân nhóm phụ). Lúc đó, số thứ tự nhóm B bằng số electron ở lóp ngoài cùng cộng thêm số electron ở phân lớp d không bão hòa sát lớp ngoài cùng.
Chú ý:
- Lớp ngoài dạng (n – 1)d4ns2 thì chuyển thành (n-1)d5ns1 (cấu hình bán bão hòa).
- Lớp ngoài dạng (n-1)d9ns2 thì chuyển thành (n-1)d10ns1.
Ví dụ minh họa
Bài 1: Ion M2+, X- đều có cấu hình electron ở lớp ngoài cùng là 3s23p6. Hãy cho biết phân tử được tạo bởi M2+ và X-?
Hướng dẫn:
+ M → M2+ + 2e ⇒ M có cấu hình electron là:
1s22s22p63s23p64s2 (ZM = 20 ⇒ Ca)
+ X + 1e → X- ⇒ X có cấu hình electron là:
1s22s22p63s23p5 (ZX = 17) ⇒ X là Cl ⇒ phân tử CaCl2.
Bài 2: Nguyên tố Cu có số hiệu nguyên tử là 29, lớp electron ngoài cùng có 1e. hãy cho biết:
a) Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+.
b) Vị trí của Cu trong bảng tuần hoàn.
Hướng dẫn:
a) Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+
Cu: 1s22s22p63s23p63d104s1
Cu+: 1s22s22p63s23p63d10
Cu2+: 1s22s22p63s23p63d9
b) Vị trí Cu: nằm ở ô số 29, chu kì 4 nhóm IB.
Bài 3: Ion R+ có cấu hình electron là 1s22s22p6. Hãy xác định vị trí của nguyên tố R trong bảng hệ thống tuần hoàn.
Hướng dẫn:
Từ R → R+ + 1e ⇒ R có cấu hình electron là: 1s22s22p63s1
Có 3 lớp electron nên thuộc chu kì 3, có electron cuối cùng thuộc phân lóp s nên thuộc nhóm A và có 1 electron hóa trị nên thuộc nhóm I.
Bài 4: Hãy sắp xếp các cặp oxi hóa khử sau đây theo thứ tự tăng dần tính oxi hóa của các ion kim loại:
(1): Fe2+/Fe (2): Pb2+/Pb (3): 2H+/H2 (4): Ag+/Ag
(5): Na+/Na (6): Fe3+/Fe2+ (7): Cu2+/Cu
A. (5) < (1) < (2) < (3) < (7) < (6) < (4)
B. (4) < (6) < (7) < (3) < (2) < (1) < (5)
C. (5) < (1) < (6) < (2) < (3) < (4) < (7)
D. (5) < (1) < (2) < (6) < (3) < (7) < (4)
Hướng dẫn:
Đáp án D

B. Bài tập trắc nghiệm
Bài 1: Cation X2+ có cấu hình electron phân lớp ngoài cùng là 3p6. Hãy xác định vị trí của nguyên tố X trong bảng hệ thống tuần hoàn.
A. Nhóm IIA, chu kì 4
B. Nhóm IIIA, chu kì 4
C. Nhóm IIIA, chu kì 2
D. Nhóm IIA, chu kì 6
Lời giải:
Đáp án: A
Từ X → X2+ + 2e ⇒ R có cấu hình electron là:1s22s22p63s23p64s2: có 4 lớp electron nên thuộc chu kì 4; có electron cuối cùng thuộc phân lớp s nên thuộc nhóm A và có 2 electron hóa trị nên thuộc nhóm II.
Bài 2: Có thể dùng axit nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Ag?
A. HCl
B. HNO3 loãng
C. H2SO4 loãng
D. H2SO4 đặc nguội.
Lời giải:
Đáp án: B
Bài 3: Phản ứng nào sau đây chứng tỏ Fe2+ có tính khử yếu hơn so với Cu?
A. Fe + Cu2+ → Fe2+ + Cu .
B. Fe2+ + Cu → Cu2+ + Fe.
C. 2Fe3+ + Cu → 2Fe2+ + Cu2+.
D. Cu2+ + 2Fe2+ → 2Fe3+ + Cu.
Lời giải:
Đáp án: C
Bài 4: Cho 2 phương trình ion rút gọn
M2+ + X → M + X2+
M + 2X3+ → M2+ + 2X2+
Nhận xét nào sau đây là đúng?
A. Tính khử: X > X2+ > M.
B. Tính khử: X2+ > M > X.
C. Tính oxi hóa: M2+ > X3+ > X2+.
D. Tính oxi hóa: X3+ > M2+ > X2+.
Lời giải:
Đáp án: D
Bài 5: Có thể dùng dung dịch muối nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Cu?
A. Cu(NO33)2
B. Pb(NO3)2
C. AgNO3
D. Al(NO3)3
Lời giải:
Đáp án:C
Bài 6: Hầu hết kim loại đều có ánh kim vì
A. Các ion dương trong kim loại hấp thụ tốt những tia sáng có bước sóng mà mắt ta có thể thấy được.
B. Kim loại có cấu trúc mạng tinh thể nên dễ hấp thụ các tia sáng.
C. Mây electron tự do trong kim loại đã phản xạ tốt các tia sáng có bước sóng mà mắt ta thấy được.
D. Tinh thể kim loại đa số ở thể rắn, có hình thể đồng nhất nên phản xạ tốt các tia sáng chiếu tới tạo vẻ sáng lấp lánh.
Lời giải:
Đáp án: C
Bài 7: Chất nào cứng nhất?
A. Cr
B. W
C. Ti
D. Kim cương
Lời giải:
Đáp án: D
Bài 8: Có dung dịch FeSO4 lẫn CuSO4. Phương pháp đơn giản nhất để loại tạp chất là:
A. Cho 1 lá đồng vào dung dịch
B. Cho 1 lá sắt vào dung dịch
C. Cho 1 lá nhôm vào dung dịch
D. Cho dung dịch NH3 đến dư vào dung dịch, lọc lấy kết tủa Fe(OH)2 rồi hòa tan tủa vào dung dịch H2SO4 loãng.
Lời giải:
Đáp án: B
Bài 9: Tính chất chung của ăn mòn điện hóa và ăn mòn hóa học là:
A. Có phát sinh dòng điện
B. Electron của kim loại được chuyển trực tiếp sang môi trường tác dụng
C. Nhiệt độ càng cao tốc độ ăn mòn càng nhanh.
D. Đều là các quá trình oxi hóa - khử.
Lời giải:
Đáp án: D
Bài 10: Chất nào sau đây có thể oxi hóa Zn thành Zn2+?
A. Fe
B. Ag+
C. Al3+
D. Ca2+
Lời giải:
Đáp án: B
Bài 11: Dùng phản ứng của kim loại với dung dịch muối không thể chứng minh
A. Cu có tính khử mạnh hơn Ag.
B. Cu2+ có tính oxi hóa mạnh hơn Zn2+.
C. Fe3+ có tính oxi hóa mạnh hơn Fe2+.
D. K có tính khử mạnh hơn Ca.
Lời giải:
Đáp án: D
Bài 12: Điểm khác nhau giữa kim loại và hợp kim.
A. Kim loại là đơn chất . Hợp kim là hỗn hợp hay hợp chất
B. Kim loại có điểm nóng chảy cố định. Hợp kim có điểm nóng chảy thay đổi tuỳ theo thành phần.
C. Kim loại dẫn điện . Hợp kim không dẫn điện
D. A,B đều đúng
Lời giải:
Đáp án: D
Cách giải bài tập về Chuỗi phản ứng hóa học của kim loại hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Nắm chắc các tính chất hóa học chung và các tính chất đặc trưng của từng nhóm kim loại để vận dụng viết phương trình phản ứng.
Ví dụ minh họa
Bài 1: Hoàn thành sơ đồ phản ứng sau:
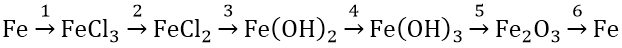
Hướng dẫn:
(1) 2Fe + Cl2 → 2FeCl3
(2) 2FeCl3 + Fe → 3FeCl2
(3) FeCl2 + 2NaOH → Fe(OH)2 + NaCl
(4) 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
(5) 2Fe(OH)3 −tº→ Fe2O3 + 3H2O
(6) Fe2O3 + 2Al −tº→ 2Fe + Al2O3
Bài 2: Hoàn thành phương trình phản ứng theo sơ đồ sau:
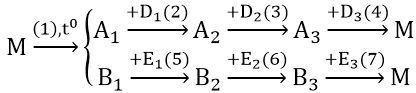
Cho biết: A1 là oxit kim loại A có điện tích hạt nhân là: 3,2.10-18 Culong; B1 là oxit phi kim B có cấu hình electron ở lớp vỏ ngoài cùng là 2s22p2
Hướng dẫn:
Số điện tích hạt nhân của A = (3,2.10-18)/(1,6.10-19) = 20(Ca)
Vậy A1 là CaO.
B ở chu kì 2, nhóm IV A ⇒ (B là cacbon). Vậy B1 là CO2
Các phản ứng:
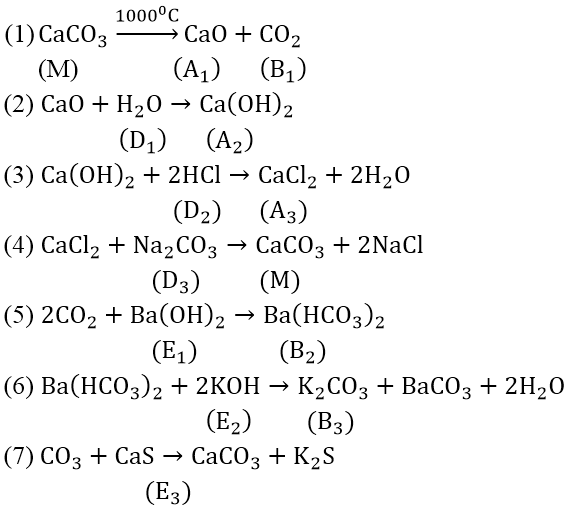
Bài 3: Hoàn thành sơ đồ phản ứng sau:
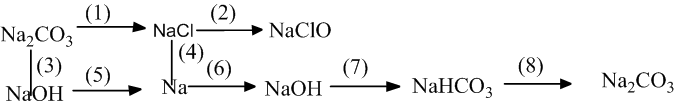
Hướng dẫn:

B. Bài tập trắc nghiệm
Bài 1: Cho các chất sau: Fe, FeCl2, FeCl3, FeSO4, Fe2(SO4)3, FeO, Fe2O3. Những chất có cả tính oxi hóa và tính khử là:
A. Fe, FeO, Fe2O3. B. FeO, FeCl2, FeSO4.
C. Fe, FeCl2, FeCl3. D. Fe, FeSO4, Fe2(SO4)3.
Lời giải:
Đáp án: B
Bài 2: Cho sơ đồ sau:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe → FeCl3.
Số phương trình phản ứng oxi hóa - khử trong dãy là:
A. 3 B. 4 C. 5 D. 6
Lời giải:
Đáp án: B
Những phản ứng có sự thay đổi số oxi hóa là phản ứng oxi hóa – khử
Fe + 2HCl → FeCl2 + H2
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
2Fe(OH)3 −tº→ Fe2O3 + 3H2O
Fe2O3 + 2Al −tº→ 2Fe + Al2O3
Fe + Cl2 → FeCl3
Bài 3: Phương trình phản ứng nào sau đây viết sai?
A. FeCO3 + 2HNO3 → Fe(NO3)2 + CO2 + H2O
B. 2FeCl2 + Cl2 → 2FeCl3
C. 2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
D. Fe2O3 + 6HNO3 đặc −tº→ 2Fe(NO3)3 + 3H2O.
Lời giải:
Đáp án: A
3FeCO3 + 10HNO3 → 3Fe(NO3)3 + 5H2O + NO + 3CO2
Bài 4: Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng dư chất nào sau đây?
A. Mg B. Cu C. Ba D. Na
Lời giải:
Đáp án: B
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Bài 5: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số phản ứng oxi hóa - khử là:
A. 5 B. 6 C. 7 D. 8
Lời giải:
Đáp án: C
Bài 6: Khi nung nóng hỗn hợp các chất Fe(NO3)2, Fe(OH)2 và FeCO3 trong không khí đến khối lượng không đổi thu được một chất rắn là:
A. FeO B. Fe C. Fe3O4 D. Fe2O3
Lời giải:
Đáp án: D
Bài 7: Cho sơ đồ sau: FeS2 → X → Y → Z → Fe
Các chất X, Y, Z lần lượt là:
A. FeS, Fe2O3, FeO. B. Fe3O4, Fe2O3, FeO.
C. Fe2O3, Fe3O4, FeO. D. FeO, Fe3O4, Fe2O3.
Lời giải:
Đáp án:C
2FeS2 + 11/2O2 −tº→ Fe2O3 + 4SO2
3Fe2O3 + CO −tº→ 2Fe3O4 + CO2
Fe3O4 + CO −tº→ 3FeO + CO2
FeO + CO −tº→ Fe + CO2
Cách giải các dạng bài tập về dãy điện hóa kim loại hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Xác định thế điện cực chuẩn, suất điện động chuẩn của pin điện hóa
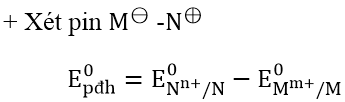
+ Chiều phản ứng: Viết cặp oxi hóa - khử có thế điện cực nhỏ ở bên trái, cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình phản ứng oxi hóa - khử theo quy tắc α.
Ví dụ minh họa
Bài 1: Tính thế điện cực chuẩn E0 của những cặp oxi hóa khử sau:
a. E0 (Cr3+/Cr), biết suất điện động chuẩn của pin điện hóa Cr -Ni là +0,51V và E0 (Ni2+/Ni) = -0,23V.
b. E0 (Mn2+/Mn), biết suất điện động chuẩn của pin điện hóa Cd -Mn là +0,79V và E0 (Cd2+/Cd) = -0,40V.
Hướng dẫn:
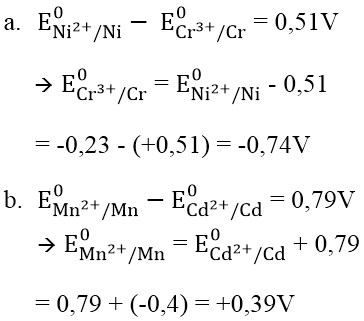
Bài 2: Biết phản ứng oxi hóa khử xảy ra trong một pin điện hóa là:
Fe + Ni2+ → Fe2+ + Ni
a. Hãy xác định các điện cực âm và dương của pin điện hóa.
b. Viết các phản ứng oxi hóa và phản ứng khử xảy ra trên mỗi điện cực.
c. Tính suất điện động chuẩn pin điện hóa.
Hướng dẫn:
a. Ni (+); Fe (-)
b. Phản ứng trên các điện cực:
Cực (-): Fe → Fe2+ + 2e
Cực (+): Ni2+ + 2e → Ni
c. E0pin = -0,23 - (-0,44) = 0,21 V
Bài 3: Tính thế điện cực chuẩn E0 của các cặp oxi hóa khử sau:
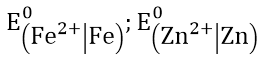
Hướng dẫn:
+) Pin điện hóa Fe – Ni: cực (-) là Fe; cực dương (+) là Ni
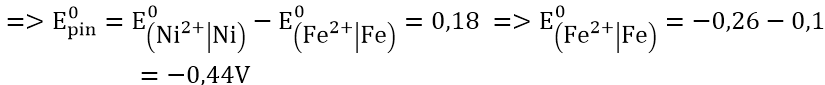
+) Pin điện hóa Zn – Ag: cực (-) là Zn; cực (+) là Ag.
B. Bài tập trắc nghiệm
Bài 1: Cho pin điện hóa 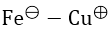
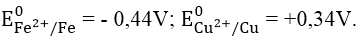
A. 0,78V B. - 0,78V C. - 0,1V D. 0,2V
Lời giải:
Đáp án: A
Ta có: E0pđh = E0Cu2+/Cu - E0Fe2+/Fe = 0,34 - (-0,44) = 0,78V
Bài 2: Cho E0pđh của pin được tạo bởi giữa Sn2+/Sn và Ag+/Ag là 0,94V. Biết E0Ag+/Ag = 0,8V. Vậy E0Sn2+/Sn có giá trị là:
A. -1,74V B. 1,74V C. -0,14V D. 0,14V
Lời giải:
Đáp án: C
Ta có:
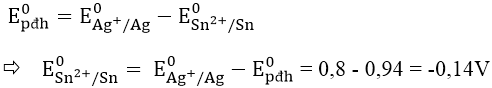
Bài 3: Cho suất điện động chuẩn của các pin điện hóa: Zn - Cu là 1,1V; Cu - Ag là 0,46V. Biết thể tích điện cực chuẩn E0Ag+/Ag = + 0,8V. Thế điện cực chuẩn E0Zn2+/Zn và E0Cu2+/Cu có giá trị lần lượt là:
A. -0,76V và +0,34V B. -1,46V và -0,34V
C. +1,56V và +0,64V D. -1,56V và +0,64V
Lời giải:
Đáp án: A
Ta có:
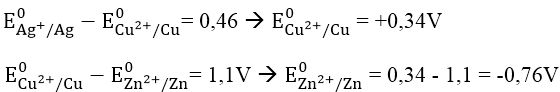
Bài 4: Biết E0Ag+/Ag = + 0,8V, E0Fe3+/Fe2+ =0,77V
Vậy nhận định nào sau đây đúng?
A. Ion Fe3+ oxi hóa được Ag. B. Ion Fe2+ bị oxi hóa bởi Ag+.
C. Ion Ag+ bị khử bởi ion Fe3+. D. Ion Fe2+ oxi hóa được Ag.
Lời giải:
Đáp án: B
Dựa vào E0 ta có thể viết phương trình phản ứng:
Ag+ + Fe2+ → Fe3+ + Ag↓
Bài 5: Tính thế điện cực chuẩn của cặp oxi hóa - khử sau:
E0Zn2+/Zn, biết rằng E0pin(Zn-Cu) = 1,10V và E0Cu2+/Cu = +0,34V.
A. -0,76V B. 0,42 V C. -0,38 V D. 0,24V
Lời giải:
Đáp án: A
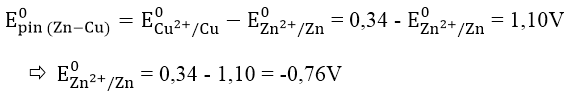
Bài 6: Có pin điện hóa được tạo thành từ những cặp oxi hóa - khử sau:
Fe2+/Fe và Ag+/Ag
Hãy tính suất điện động của mỗi pin điện hóa, biết rằng:
E0Ag+/Ag = + 0,8V; E0Fe2+/Fe = -0,44V.
A. 0,36V B. -1,24V C. 1,24V D. -0,36V
Lời giải:
Đáp án: C
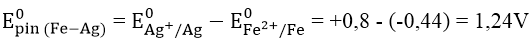
Bài 7: Cho suất điện động chuẩn E0 của các pin điện hóa: E0 (Cu - X) = 0,46V; E0 (Y - Cu) = 1,1V; E0 (Z - Cu) = 0,47V (X, Y, Z là ba kim loại). Dãy các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là:
A. Z, Y, Cu, X B. X, Cu, Z, y C. Y, Z, Cu, X D. X, Cu, Y, Z
Lời giải:
Đáp án: B
E0 (Cu - X) = 0,46V > 0 → Tính khử của X < Cu
E0 (Y - Cu) = 1,1V > E0 (Z - Cu) = 0,47V > 0 → Tính khử của Y > Z > Cu.
Tóm lại: tính khử tăng dần theo chiều X, Cu, Z, Y.
Bài 8: Cho suất điện động chuẩn của các pin điện hóa: Zn-Cu là 1,1V; Cu-Ag là 0,46V. Biết thế điện cực chuẩn E0Ag+/Ag = +0,8V. Thế điện cực chuẩn E0Zn2+/Zn và E0Cu2+/Cu lần lượt là:
A. -0,76V và +0,34V.
B. -1,46V và -0,34V.
C. +1,56V và +0,64V.
D. -1,56V và +0,64V.
Lời giải:
Đáp án: A