Phương pháp trung bình trong hóa học vô cơ hay, chi tiết, có lời giải - Hoá học lớp 12
Phương pháp trung bình trong hóa học vô cơ hay, chi tiết, có lời giải
Với Phương pháp trung bình trong hóa học vô cơ hay, chi tiết, có lời giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Phương pháp trung bình trong hóa học vô cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Phương pháp giải
Một số dạng bài thường gặp:
+ Bài toán liên quan đến đồng vị
+ Xác định các nguyên tố trong cùng chu kì hoặc cùng phân nhóm
+ Bài toán hỗn hợp kim loại
Ví dụ minh họa
Ví dụ 1: Cho m gam hỗn hợp bột X gồm 3 kim loại Zn, Cr, Sn có số mol bằng nhau tác dụng hết với lượng dư dung dịch HCl loãng, nóng thu được dung dịch Y và khí H2. Cô cạn dung dịch Y thu được 8,98 g muối khan. Nếu cho m gam hỗn hợp X tác dụng vói O2 lấy dư để tạo hỗn hợp 3 oxit thì thể tích khí O2 phản ứng là
A. 2,016 lít.
B. 0,672 lít.
C. 1,344 lít.
D. 1,008 lít.
Giải
Ba kim loại Zn, Cr, Sn khi tác dụng với HCl loãng nóng đều bị oxi hóa lên số oxi hóa +2. Gọi X là kim loại chung thỏa mãn tính chất khi tác dụng với HCl giống với 3 kim loại trên.
3 kim loại có số mol bằng nhau 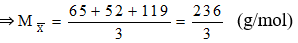
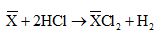
Muối khan khi cô cạn dung dịch Y là hỗn hợp muối clorua của 3 kim loại (XCl2 )
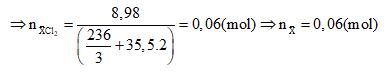
Ba kim loại có số mol bằng nhau 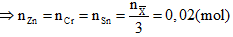
Phản ứng với Oxi
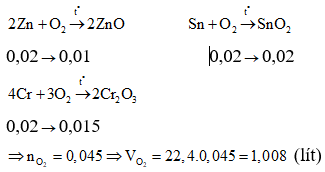
⇒Đáp án D
Ví dụ 2: X và Y là hai nguyên tố halogen ở 2 chu kì liên tiếp trong bảng tuần hoàn. Để kết tủa hết ion trong dung dịch chứa 4,4 gam muối natri của chúng cần 150 ml dung dịch AgNO3 0,4 M. X và Y là
A. Flo, clo.
B. Clo, brom.
C. Brom, iot.
D. Không xác định.
Giải:
Ta có nAgNO3= 0,06 mol.
Gọi công thức trung bình của 2 muối là NaR
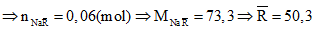
Mà 2 halogen thuộc chu kỳ liên tiếp
Nên 2 halogen đó là Cl (35,5) và Br (80).
⇒Đáp án B
Ví dụ 3: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Thành phần phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 47,2 %
B. 52,8%
C. 58,2%
D. 41,2%
Giải:
Gỉa sử Y không phải Flo

⇒X là Clo, Y là Flo
Kết tủa chỉ gồm AgCl; nAgCl = nNaCl = 8,61: 143,5 = 0,06 mol
% mNaCl = 0,06.58,5: 6,03 . 100% = 58,2% => % mNaF = 41,2%
⇒Đáp án D
Ví dụ 4: Cho 1,9 gam hỗn hợp muối cacbonat và hiđrocacbonat của kim loại kiềm M tác dụng hết với dung dịch HCl (dư), sinh ra 0,448 lít khí (ở đktc). Kim loại M là:
A. K
B. Rb
C. Na
D. Li
Giải:
Công thức muối cacbonat và hiđrocacbonat của kim loại kiềm M là M2CO3 và MHCO3.
Phương trình phản ứng hóa học :
M2CO3 + 2HCl → 2MCl + CO2 + H2O
MHCO3 + HCl → MCl + CO2 + H2O
Theo các phản ứng ta thấy: Tổng số mol hỗn hợp muối = số mol của CO2 = 0,02 mol.
Gọi khối lượng mol trung bình của hai muối là M(tb),
ta có: M + 61 < M(tb) < 2M + 60 (*)
Mặt khác M(tb) = 1,9/0,02 = 95 (**)
Kết hợp giữa (*) và (**) ⇒ 17,5 < M < 34 ⇒ Kim loại M là Na.
⇒ Đáp án C
Ví dụ 5: Nguyên tử khối trung bình của đồng kim loại là 63,546. Đồng tồn tại trong tự nhiên với hai đồng vị là 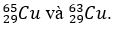
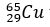
A. 27,30%
B. 26,30%
C. 26,7%
D. 23,70%
Giải:
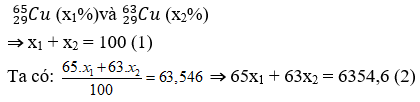
Từ (1)(2) ⇒x1 = 27,3 ; x2 = 72,7
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Sục khí clo dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Thể tích khí clo đã tham gia phản ứng với 2 muối trên (đo ở đktc) là
A. 4,48 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 1,12 lít.
Lời giải:
Hướng dẫn giải:
Gọi công thức trung bình của 2 muối NaBr và KBr là MBr
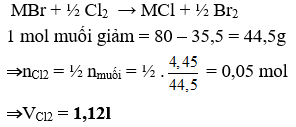
⇒Đáp án D
Bài 2: Hoà tan 46 gam một hỗn hợp Ba và hai kim loại kiềm A, B thuộc hai chu kì kế tiếp nhau vào nước thu được dung dịch C và 11,2 lít khí (đktc). Nếu thêm 0,18 mol Na2 SO4 vào dung dịch C thì dung dịch sau phản ứng vẫn chưa kết tủa hết Ba. Nếu thêm 0,21 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng còn dư Na2SO4. A và B là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Lời giải:
Hướng dẫn giải:
Gọi nguyên tử khối trung bình của hai kim loại là X, tổng số mol là a.
Số mol của Ba là b
Ta có: mhỗn hợp = Xa + 137b = 46 (1)
Khi tác dụng với nước thu được khí: n H2 = 0,5a + b = 0,5 (2)
Nếu thêm 0,18 mol Na2SO4 chưa kết tủa hết Ba. Nếu thêm 0,21 mol Na2SO4 vào thì còn dư Na2SO4
⇒0,18 < b < 0,21
Từ (2) ⇒0,58 < a < 0,64
Từ (1) ⇒17,23 < Xa < 21,34
Suy ra 26,92 < X < 36,79
Vậy hai kim loại là Na (23) và K (39)
⇒Đáp án B
Bài 3: Hòa tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước thu được dung dịch X và 2,688 lit khí H2 (đktc) . Dung dịch Y gồm HCl và H2SO4 có tỉ lệ mol tương ứng: 4: 1. Trung hòa dung dịch X bởi dung dịch Y , tổng khối lượng các muối được tạo ra là
A. 13,7
B. 12,78
C. 18,46
D. 14,62
Lời giải:
Hướng dẫn giải:
Ta có: n H2 = 0,12 mol
Gọi công thức trung bình của Na, K và Ba là M
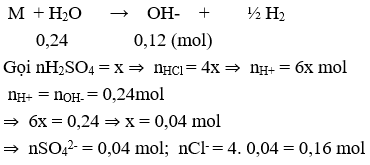
⇒ mmuối = mkim loại + mgốc axit = 8,94 + 0,04 . 96 + 0,16 . 35,5 = 18,46 gam.
⇒Đáp án C
Bài 4: Hòa tan hoàn toàn 4,431g hỗn hợp Al, Mg bằng dung dịch HNO3 loãng thu được dung dịch X ( không chứa muối amoni) và 1,568 lít ( đktc) hỗn hợp hai khí không màu có khối lượng 2,59g, trong đó có một khí bị hóa nâu trong không khí. Cô cạn cẩn thận dung dịch X thì lượng muối khan thu được là:
A. 19,621g
B. 8,771g
C. 28,301g
D. 32,641g
Lời giải:
Hướng dẫn giải:
n X = 1,568: 22,4 = 0,07 mol. Khí không màu hóa nâu trong không khí là NO
KL +HNO3 → Khí không màu ⇒Khí còn lại là 1 trong 2 khí: N2 hoặc N2O
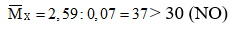
⇒Khí còn lại trong X có M > 37 ⇒Khí còn lại là N2O (44)

⇒Đáp án C
Bài 5: Dung dịch X chứa 8,36g hỗn hợp hiđroxit của 2 kim loại kiềm. Để trung hòa X cần dùng tối thiểu 500ml dung dich HNO3 0,55M. Biết hiđroxit của kim loại có nguyên tử khối lớn hơn chiếm 20% số mol hỗn hợp. Kí hiệu hóa học của 2 kim loại kiềm lần lượt là:
A. Li và Na
B. Na và K
C. Li và K
D. Na và Cs
Lời giải:
Hướng dẫn giải:

⇒Đáp án C
Bài 6: Trong tự nhiên kali có 2 đồng vị 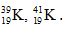
A. 26,39%
B. 26,30%
C. 28,23%
D. 28,16%
Lời giải:
Hướng dẫn giải:

⇒Đáp án B
Bài 7: Cho 8,5g hai kim loại hóa trị I đứng kế tiếp nhau trong bảng tuần hoàn hóa học vào nước thu được 3,36l khí bay lên. Tìm tên của hai kim loại đó
A. Li và Na
B. Na và K
C. K và Rb
C. Rb và Cs
Lời giải:
Hướng dẫn giải:
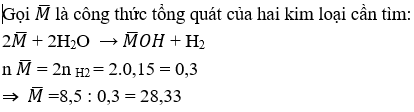
⇒Hai kim loại là Na(23) và K (39)
⇒Đáp án B
Bài 8: Một dung dịch có chứa 35 gam hỗn hợp 2 muối cacbonat của 2 kim loại thuộc hai chu kì kế tiếp nhau ở nhóm IA. Thêm từ từ và khuấy đều một lượng dung dịch HCl vào dung dịch trên. Khi phản ứng xong thu được 1,23 lít khí CO2 (27oC; 2 atm) và dung dịch X. Thêm dung dịch Ca(OH)2 dư vào dung dịch X, thu được 20 gam kết tủa. Hai kim loại kiềm là
A. Li và Na
B. Na và K
C. K và Rb
D. Rb và Cs
Lời giải:
Hướng dẫn giải:
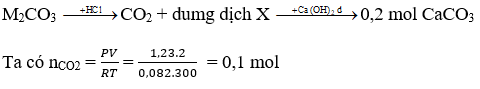
Nhận thấy khi cho dung dịch Ca(OH)2 dư vào dung dịch X tạo kết tủa → trong X có chứa HCO3-
Bảo toàn nguyên tố C ⇒nM2CO3 = nCaCO3 + nCO2 = 0,3 mol
Vậy M tb muối = 35/0,3 = 116,67 → M tb kim loại = 28,33 mà hai kim loại ở chu kì kế tiếp ⇒Na, K.
⇒Đáp án B
Bài 9: Hòa tan 26,8 gam hỗn hợp hai muối cacbonat của hai kim loại (cùng thuộc nhóm IIA và ở hai chu kì lien tiếp của bảng tuần hoàn) tan trong dung dichh HCl vừa đủ. Sau phản ứng thu được 6,72 lít khí (đktc). Thành phần phần trăm khối lượng của muối cacbonat có phân tử khối nhỏ hơn là
A. 56,2%
B. 62,69%
C. 29,6%
D. 25,3 %
Lời giải:
Hướng dẫn giải:
Đặt công thức chung của 2 muối là: MCO3
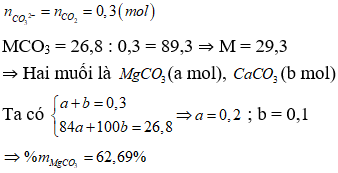
⇒Đáp án B
Bài 10: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng một nhóm A của bảng tuần hoàn, MA < MB. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít khí hidro (đktc). Kim loại B là
A. K
B. Rb
C. Ba
D. Sr
Lời giải:
Hướng dẫn giải:
Đặt công thức chung của 2 kim loại là X, hóa trị n
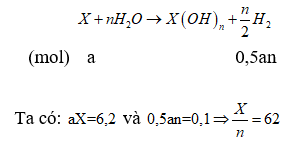
Với n=1: tính được X=62. Hai kim loại A, B lần lượt là K (39) và Rb (85,5)
Với n=2: tính được X=31. Hai kim loại A, B lần lượt là Mg (24) và Ca (40)
Trường hợp này loại vì Mg không tan trong nước.
⇒B là Rb ⇒Đáp án B

