Cách giải Bài tập về tính khử của hợp chất crom 2 (II) hay, chi tiết - Hoá học lớp 12
Cách giải Bài tập về tính khử của hợp chất crom 2 (II) hay, chi tiết
Với Cách giải Bài tập về tính khử của hợp chất crom 2 (II) hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập tính khử của hợp chất crom 2 (II) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

I. Phương pháp
1. Oxit CrO
- CrO là một oxit bazơ, màu đen
- CrO có tính khử, trong không khí CrO dễ bị oxi hóa thành Cr2O3.
2. Hidroxit Cr(OH)2
- Cr(OH)2 là chất rắn, màu vàng.
- Cr(OH)2 có tính khử, trong không khí oxi hóa thành Cr(OH)3
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Cr(OH)2 là một bazơ.
3. Muối crom (II)
- Muối crom (II) có tính khử mạnh.
4CrCl2 + O2 + 4HCl → 4CrCl3 + 2H2O
- Dung dịch CrCl2 để ngòai không khí lại chuyển từ màu xanh lam sang màu lục
- CrCl2 trong dung dịch phân ly ra Cr2+ và Cl-. Ion Cr2+ tồn tại ở dạng
[ Cr(H2O) ]2+ có màu xanh, nên dung dịch CrCl2 có màu xanh.
- Mặt khác trạng thái oxi hóa +2 của Cr có tính khử mạnh, ngay trong dung dịch CrCl2 bị oxi hóa bởi oxi không khí chuyển thành CrCl3. Ion Cr3+ trong dung dịch tồn tại dưới dạng [Cr(H2O)]3+ có màu lục. Nên trong không khí CrCl2 chuyển từ màu xanh lam sang màu lục .
II. Ví dụ minh họa
Ví dụ 1: Hòa tan hết 1,56 gam bột crom vào 550 ml dung dịch HCl 0,2M đun nóng thu được dung dịch A. Sục O2 dư vào A thu được dung dịch B. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch B để thu được lượng kết tủa lớn nhất.
Lời giải:
Giải thích:
nCr = 1,56/52 = 0,03 mol; nHCl = 0,55. 0,2 = 0,11 mol
Cr + 2HCl → CrCl2 + H2
(mol): 0,03 0,06 0,03 0,03
4CrCl2 + O2 + 4HCl → 4CrCl3 + H2O
(mol): 0,03 0,03 0,03
Dung dịch A thu được gồm: CrCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol
Để thu được lượng kết tủa lớn nhất:
HCl + NaOH → NaCl + H2O
(mol): 0,02 0,02
CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl
(mol): 0,03 0,09 0,03
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (l)
Ví dụ 2: Có các phương trình hóa học sau:
1. CrO + 2HCl → CrCl2 + H2O.
2. CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl.
3. 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
4. Cr(OH)2 + 2HCl → CrCl2 + 2H2O
5. 4CrCl2 + 4HCl + O2 → 4CrCl3 + 2H2O
Số lượng phản ứng minh hoạ tính khử của hợp chất crom (II) là
A. 2 B. 3
C. 4 D. 5
Lời giải:
Chọn đáp án: A
Giải thích: Phản ứng thể hiện tính khử của crom (III) là: 3, 5
Ví dụ 3: Cho 2,46g CrCl2 tác dụng với dung dịch NaOH vừa đủ thu kết tủa (A). Nung (A) trong không khí đến khối lượng không đổi thu m gam chất rắn. Giá trị của m
A. 0,68
B. 0,78
C. 1,52
D. 1,2
Lời giải:
Chọn đáp án: C
Giải thích:
CrCl2 + 2NaOH → Cr(OH)2↓màu vàng + 2NaCl
2Cr(OH)2 + 1/2O2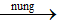
nCrCl2 = 0,02 mol => nCr2O3 = 1/2 . 0,02 = 0,01 mol
mCr2O3 = 152. 0,01 = 1,52g
Ví dụ 4: Cho dung dịch chứa 0,5 mol NaOH vào dung dịch chứa 0,2 mol CrCl2 rồi để trong không khí đến phản ứng hoàn toàn. Lượng kết tủa cuối cùng thu được là
A. 10,3g
B. 20,6g
C. 8,6g
D. 17,2g
Lời giải:
Chọn đáp án: A
Giải thích:
CrCl2 + 2NaOH → Cr(OH)2↓màu vàng + 2NaCl (1)
0,2 → 0,4 mol
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3 (2)
0,2 mol → 0,2 mol
Cr(OH)3 + NaOH → NaCrO2 + 2H2O (3)
0,1 mol ← 0,1 mol
nNaOH (1) = 2. nCrCl2 = 2. 0,2 = 0,4 mol
nNaOH (3) = 0,5 – 0,4 = 0,1 mol
Theo (2): nCr(OH)3 = nCr(OH)2 = 0,2 mol
nCr(OH)3 còn lại sau phản ứng = 0,2 – 0,1 = 0,1 mol
mkết tủa = 0,1. 103 = 10,3 g

