Cách giải bài tập Sắt tác dụng với phi kim (Cl, O, S) hay, chi tiết - Hoá học lớp 12
Cách giải bài tập Sắt tác dụng với phi kim (Cl, O, S) hay, chi tiết
Với Cách giải bài tập Sắt tác dụng với phi kim (Cl, O, S) hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Sắt tác dụng với phi kim (Cl, O, S) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

I. Phương pháp
Sắt tác dụng với hầu hết các phi kim khi đun nóng:
- Với halogen sắt tạo muối sắt (III) halogenua (trừ iot tạo muối sắt II)
2Fe + 3X2 →t o 2FeX3 (t0)
2Fe0 + 3Cl2 →t o 2Fe3+ + 3Cl20
Chú ý rằng kể cả khi dư sắt phản ứng vẫn tạo muối Fe3+ và Fe dư. Sau đó nếu cho vào nước mới xảy ra phản ứng tạo muối Fe2+.
- Với O2:
3Fe + 2O2 →t o Fe3O4
Thực tế sắt thường tạo hỗn hợp các oxit và sắt dư. Với trường hợp này chúng ta thường dùng phương pháp quy đổi, phương pháp bảo toàn electron kết hợp với bảo toàn khối lượng để làm bài.
- Với S, sắt chỉ tạo hợp chất sắt (II):
Fe + S →t o FeS
Nếu sau phản ứng hỗn hợp cho tác dụng với axit có tính oxi hóa mạnh thì nên áp dụng định luật bảo toàn e cho cả quá trình, ngoài ra cũng chú ý thêm bảo toàn nguyên tố.
II. Ví dụ minh họa
Ví dụ 1: Cho a mol sắt tác dụng với 1,25a mol khí clo, thu được hỗn hợp chất rắn X. Cho X vào nước, thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Các chất trong dd Y là:
A. FeCl2
B. FeCl2, FeCl3
C. FeCl2, Fe
D. FeCl3
Lời giải:
Chọn đáp án: B
Giải thích:
PTHH: 2Fe + 3Cl2 → 2FeCl3
a mol 1,25a mol
Ta có: a/2 > (1,25a)/3 => Fe dư
Chất rắn X chứa:
nFeCl3 = 2. (1,25a/3) = 5a/6 mol; nFe dư = a - (5a/6) = a/6 mol
Khi cho X vào nước xảy ra phản ứng:
Fe + 2FeCl3 → 3FeCl2
a/6 5a/6 mol
=> Sau phản ứng dung dịch Y có FeCl2 và FeCl3 dư.
Ví dụ 2: Cho a mol sắt tác dụng với a mol khí clo, thu được hỗn hợp rắn X. Cho X vào nước thu được dung dịch Y. Nhỏ dd AgNO3 dư vào dd Y thu được 79g kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
A. 0,12 mol
B. 0,15 mol
C. 0,18 mol
D. 0,2 mol
Lời giải:
Chọn đáp án: D
Giải thích:
PTHH: 2Fe + 3Cl2 → 2FeCl3
Ta có: a/2 > a/3 => Fe dư
Chất rắn X chứa:
nFe pư = nFeCl3 = a/3 .nCl2 = (2a)/3 mol ; nFe dư = a - (2a)/3 = a/3 mol
Khi cho X vào nước xảy ra phản ứng:
Fe + 2FeCl3 → 3FeCl2
a/3 2a/3 mol
=> Phản ứng hết, dd Y chỉ chứa FeCl2
nFeCl2 = 3. nFe = a mol
nFe2+ = a mol, nCl- = 2a mol
Fe2+ + Ag+ → Fe3+ +Ag
Cl- + Ag+ → AgCl
=> nAg = nFe2+ = a mol
và nAgCl = nCl- = 2a mol
m↓ = 108a + 143,5. 2a = 79
=> a = 0,2 mol
Ví dụ 3: Trộn 5,6 gam bột sắt với 3,2 gam bột lưu huỳnh rồi nung nóng trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Cho Y tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí Z và còn lại một phần không tan G. Để đốt cháy hoàn toàn Z và G cần vừa đủ V lít O2 (đktc). Giá trị của V là
A. 1,12
B. 3,36
C. 6,72
D. 4,48
Lời giải:
Chọn đáp án: B
Giải thích:
nFe = nS = 0,1 mol dư
Fedư FeCl2
Fe, S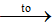
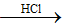
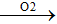
FeS S
Nung hỗn hơp Fe, S thu được hỗn hợp chất rắn Y gồm FeS, Fe dư, S dư
Y + HCl => Khí Z là H2S, H2; Chất rắn G là S.
Xét cả quá trình:
Fe → Fe2+ +2e
O2 +4e → O2-
S → S+ 4 + 4e
Bảo toàn electron: 4nO2 = 2nFe + 4nS
=> nO2 = 0,15 => V = 3,36 lít
Câu 4: Cho kim loại M tác dụng với Cl2 thu được muối X; tác dụng với dung dịch HCl thu được muối Y. Nếu cho M tác dụng với dung dịch muối X ta cũng thu được muối Y. Kim loại M là:
A. Mg
B. Cu
C. Al
D. Fe
Lời giải:
Chọn đáp án: D
Giải thích:
2Fe + 3Cl2 → 2FeCl3
Fe + 2HCl → FeCl2 + H2
2FeCl3 + Fe → 2FeCl2

