Các phương pháp phân biệt một số chất vô cơ - Hoá học lớp 12
Các phương pháp phân biệt một số chất vô cơ
Với Các phương pháp phân biệt một số chất vô cơ Hoá học lớp 12 tổng hợp các dạng bài tập, 100 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập phân biệt một số chất vô cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Tổng hợp Lý thuyết chương Phân biệt một số chất vô cơ
- Lý thuyết Cách nhận biết một số cation trong dung dịch Xem chi tiết
- Lý thuyết Cách nhận biết một số anion trong dung dịch Xem chi tiết
- Lý thuyết Cách nhận biết một số chất khí Xem chi tiết
- Lý thuyết Chuẩn độ axit - bazo, chuẩn độ oxi hóa - khử Xem chi tiết
- Lý thuyết về Nhận biết một số chất vô cơ Xem chi tiết
Phương pháp giải Các dạng bài tập chương Phân biệt một số chất vô cơ
- Cách làm bài tập nhận biết chất hóa học cực hay, chi tiết Xem chi tiết
- Cách làm bài tập tách chất hóa học cực hay, chi tiết Xem chi tiết
- Dạng 1: Các dạng bài tập về nhận biết, tách chất Xem chi tiết
- Dạng 2: Các bài toán về chuẩn độ axit bazo, chuẩn độ oxi hoa khử Xem chi tiết
Bài tập trắc nghiệm
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải chi tiết (cơ bản) Xem chi tiết
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải chi tiết (nâng cao) Xem chi tiết
Cách làm bài tập nhận biết chất hóa học
Bảng nhận biết chất hóa học
Ion, chất |
Ion, chất Thuốc thử |
Hiện tượng, phương trình |
| Ion | ||
Na+, K+ |
Thử màu ngọn lửa ( Đốt bằng ngọn lửa không màu) |
Với Na+ ngọn lửa biến thành màu vàng; K+ biến thành màu tím |
NH4+ |
Dung dịch kiềm (OH-) |
Sủi bọt khí mùi khai : NH4+ + OH- → NH3 + H2O |
Ba2+ |
- Dung dịch có SO42- - Dung dịch K2CrO4 hoặc K2Cr2O7 |
- Xuất hiện kết tủa trắng: Ba2+ + SO42- → BaSO4↓ - Xuật hiện kết tủa vàng: Ba2+ + CrO42- → BaCrO4↓ 2Ba2+ + Cr2O72- + H2O → 2BaCrO4 + 2H+ |
Al3+, Cr3+ |
Dung dịch kiềm (OH-) dư |
Xuất hiện kết tủa (Al(OH)3 màu trắng; Cr(OH)3 màu xanh), sau đó kết tủa tan: M3+ + 3OH- → M(OH)3 M(OH)3 + OH- → M(OH)4-( hoặc MO2-+ 2H2O) |
Fe3+ |
Dung dịch kiềm (hoặc NH3) hoặc dung dịch thiosunfua SCN- |
Fe3+ + OH- → Fe(OH)3↓ Kết tủa nâu đỏ Fe3+ + 3SCN- → Fe(SCN)3 dung dịch màu đỏ máu |
Fe2+ |
Dung dichh kiềm hoặc NH3 |
Kết tủa keo trắng, khi đưa ra ngoài không khí tạo kết tủa màu nâu đỏ: Fe2+ + OH- → Fe(OH)2↓: trắng 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3: nâu đỏ |
Cu2+, Ni2+ |
- Dung dịch kiềm (OH-) |
- Kết tủa xanh lục: Cu2+ + 2OH- → Cu(OH)2↓: xanh lục - Tạo kết tủa xanh lục sau đó kết tủa tan tạo kết tủa xanh lam đậm ( do khả năng tạo phức NH3 với Cu) Cu2+ + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4+ Cu(OH)2↓ + NH3 → [Cu(NH3)4]2+ + 2OH- Ni2+ tương tự |
NO3- |
Cu, H2SO4 loãng |
Giải phóng khí không màu hóa nâu trong không khí 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O NO + O2 → 2NO2 |
SO42- |
Dung dịch Ba2+ |
Xuất hiện kết tủa trắng: SO42- + Ba2+ → BaSO4↓ ( kết tủa không tan trong axit) |
CO32-; |
- Dung dịch Ba2+ - Dung dịch axit (H+) |
- Xuất hiện kết tủa trắng nhưng tan được trong axit: Ba2+ + CO32- → BaCO3↓ BaCO3 + 2H+ → CO2 + H2O + Ba2+ - Sủi bọt khí: H+ + CO32- → CO2 + H2O |
SO32- |
- Dung dịch Ba2+ - Dung dịch axit (H+) - Dung dịch I2 |
- Xuất hiện kết tủa trắng nhưng tan được trong axit: Ba2+ + SO32- → BaSO3↓ BaSO3 + 2H+ → SO2 + H2O + Ba2+ - Sủi bọt khí: H+ + SO32- → SO2 + H2O - Làm mất màu dung dịch I2: SO32- + I2 + H2O → SO32- + 2H+ + 2I- |
Cl-; Br-; I- |
Dung dịch AgNO3 |
Xuất hiện kết tủa trắng: Ag + X- → AgX↓ ( AgCl: trắng; AgBr: vàng nhạt; AgBr: vàng đậm) Chú ý: Với AgCl tan được trong dung dịch NH3 AgCl + NH3 → [Ag(NH3)2]+ + Cl- Kết tủa AgCl sẽ xuất hiện lại khi cho dung dịch HNO3: [Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓ + 2NH4+ |
| Chất khí | ||
CO2 |
- Dung dịch Ca(OH)2 hoặc Ba(OH)2 |
Xuất hiện kết tủa trắng: CO2 + Ca(OH)2 → CaCO3↓ + H2O CO2 + Ba(OH)2 → BaCO3↓ + H2O |
SO2 |
- Dung dịch Ca(OH)2 hoặc Ba(OH)2 - Dung dịch Br2 |
- Giống như CO2 - Mất màu dung dịch Br2 SO2 + Br2 + 2H2O→ 2HBr + H2SO4 |
Cl2 |
Dung dịch KI + hồ tinh bột |
- I2 sinh ra làm hồ tinh bột chuyển sang xanh 2KI + Cl2 → 2KCl + I2 |
NO2 |
Dùng H2O sau đó dùng Cu |
Sinh ra khí không màu hóa nâu trong không khí 4NO2 + O2 + 2H2O → 4HNO3 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O |
H2S |
Dung dịch Cu2+ hoặc Pb2+ |
Kết tủa đen Cu2+ + H2S → CuS↓ + 2H+ Pb2+ + H2S → PbS↓ + 2H+ |
NH3 |
Qùy tím ẩm |
Qùy tím ẩm hóa xanh |
| Các hợp chất hữu cơ | ||
Ancol |
Na |
Xuất hiện sủi bọt khí Lưu ý: - Ancol bậc 1 oxi hóa ⇒ anhehit. Nhận biết andehit sẽ nhận ra alcol - Ancol etylic có phản ứng iođofom: C2H5OH + 4I2 + 6NaOH → HCOONa + 5NaI + 5H2O + CH3I3↓ - Ancol đa chức có OH liền kề: Dùng Cu(OH)2 tạo phức màu xanh lam |
Anđehit |
AgNO3/NH3 |
Phản ứng tráng bạc: tạo kết tủa bạc |
Axit cacboxylic |
- Qùy tím - Muối CO32- |
- Qùy tím đổi màu đỏ - Giải phóng CO2 Chú ý: Axit fomic có nhóm –CHO nên phản ứng tráng gương; axit axetic phản ứng với FeCl3 cho phức chất màu đỏ |
Glucozơ, fructozơ |
- AgNO3/NH3 - Cu(OH)2 |
- Phản ứng tráng bạc - Phản ứng của ancol có nhóm OH liền kề: tạo phức xanh lam Chú ý: Glucozơ làm mất màu dung dịch Br2 còn fructozơ thì không |
Tinh bột |
I2 |
Màu xanh |
Ankan |
Cho phản ứng với Halgen sau đó thử sản phẩm bằng quỳ tím ẩm |
Phản ứng thế sản phẩm sinh ra HCl làm đổi màu quỳ tím ẩm sang đỏ |
Anken |
Dung dịch Br2; KMnO4 |
Mất màu dung dịch Br2, KMnO4 |
Ankin |
Dung dịch Br2; KMnO4 |
Mất màu dung dịch Br2, KMnO4 Chú ý: Với ankin-1 tạo kết tủa với AgNO3/NH3 |
Aren |
Brom lỏng (Fe) |
Mất màu Br2 |
Aren |
Brom lỏng (Fe) |
Mất màu Br2 Chú ý: với ankyl benzen đun nóng với dung dịch KMnO4 làm mất màu thuốc tím |
Stiren |
Dung dịch Br2 |
Mất màu |
Phương pháp:
Ví dụ 1 : Có thể dùng thuốc thử nào dưới đây để phân biệt các dung dịch riêng biệt chứa AlCl3, FeCl3, FeCl2 và MgCl2?
A. Dung dịch H2SO4
B. Dung dịch NaOH
C. Dung dịch Na2SO4
D. Dung dịch NH4NO3
→ Đáp án B
Ví dụ 2 : Có 3 lọ mất nhãn đựng ba chất riêng biệt: phenol, stiren và ancol benzylic. Thuốc thử nào sau đây có thể nhận biết được cả ba lọ hóa chất trên?
A. Qùy tím
B. Dung dịch Br2
C. Dung dịch NaOH
D. Na kim loại
Hướng dẫn giải :
Phenol tạo kết tủa với dung dịch Br2
Stiren làm mất màu với dung dịch Br2
Ancol benzylic không hiện tượng
→ Đáp án B
Ví dụ 3 : Có 5 bình mất nhãn, chứa riêng biệt các khí SO2, SO3, N2, CH3NH2 và NH3. Nếu chỉ dùng quỳ tím ẩm thì có thể nhận ra bình chứa khí:
A. SO2 B. SO3 C. N2 D. NH3
Hướng dẫn giải :
SO2, SO3: làm quỳ tím ẩm chuyển màu đỏ
CH3NH2 và NH3: làm quỳ tím hóa xanh
N2: không hiện tượng
→ Đáp án C
Ví dụ 4 : Cho ba hợp kim: Cu-Ag; Cu – Al; Cu – Zn. Thuốc thử nào sau đây có thể được dùng để phân biệt ba hợp kim trên?
A. HCl và NaOH B. HNO3 và NH3
C. H2SO4 và NaOH D. H2SO4 loãng và NH3
Hướng dẫn giải :
Cho H2SO4 loãng:
- Hợp kim nào không xuất hiện khí là Cu – Ag
Cho dung dịch NH3 vào dung dịch thu được trong hai hợp kim còn lại:
+ Xuất hiện kết tủa keo trắng và không tan trong NH3 dư ⇒ hợp kim Cu – Al
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
+ Xuất hiện kết tủa rồi kết tủa lại tan trong NH3 dư ⇒ hợp kim Cu – Zn
Zn + H2SO4 → ZnSO4 + H2
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
→ Đáp án D
Ví dụ 5 : Có 4 dung dịch là: NaOH, H2SO4, HCl, Na2CO3. Chỉ dùng thêm 1 chất để nhận biết các dung dịch đó thì chất đó là chất nào?
A. Dung dịch HNO3.
B. Dung dịch KOH.
C. Dung dịch BaCl2.
D. Dung dịch NaCl.
Hướng dẫn giải :
Dùng BaCl2 nhận biết được 2 nhóm:
+ Xuất hiện kết tủa trắng: H2SO4; Na2CO3 (Nhóm I)
Ba2+ + SO42- → BaSO4↓
Ba2+ + CO32- → BaCO3↓
+ Không hiện tượng: NaOH; HCl (Nhóm II)
;Đổ lần lượt từng chất của 2 nhóm vào nhau:
+ Nếu cặp chất nào đổ vào nhau xuất hiện sủi bột khí là Na2CO3 (nhóm I) và HCl (nhóm II)
H+ + CO32- → CO2↑ + H2O
→ Đáp án C
Ví dụ 6 : Có 4 chất lỏng đựng trong 4 lọ bị mất nhãn: ancol etylic, toluen, phenol, axit fomic. Để nhận biết 4 chất đó có thể dùng nhóm thuốc thử nào sau đây ?
A. Quỳ tím, nước Br2, dung dịch NaOH.
B. Dung dịch Na2CO3, nước Br2, Na.
C. Quỳ tím, nước Br2, dung dịch K2CO3.
D. Na, dung dịch HCl, dung dịch AgNO3 trong NH3.
Hướng dẫn giải :
+ Dùng Na2CO3 nhận ra axit fomic: Hiện tượng sủi bọt khí
+ Nước Br2 nhận ra phenol: Hiện tượng kết tủa trắng
+ Na nhận ra ancol etylic: Hiện tượng sủi bọt khí
→ Đáp án B
Ví dụ 7 : Chỉ dùng thêm một chất nào trong các chất dưới đây để nhận biết các chất: ancol etylic, axit axetic, glixerol, glucozơ đựng trong 4 lọ mất nhãn ?
A. dung dịch AgNO3 trong NH3.
B. Quỳ tím.
C. CaCO3.
D. Cu(OH)2.
Hướng dẫn giải :
Dùng Cu(OH)2 hiện tượng:
+ Axit axetic: hòa tan kết Cu(OH)2
+ Glixerol: Tạo phức màu xanh lam
+ Glucozơ: Tạo phức màu xanh lam, khi đun nóng xuất hiện đỏ gạch (Cu2O)
+ Ancol etylic: Không hiện tượng
→ Đáp án D
Ví dụ 8 : Có 3 bình không nhãn, mỗi bình đựng 1 trong các dung dịch: NaCl, NaBr, NaI. Dùng cặp thuốc thử nào sau đây để xác định dung dịch chứa trong mỗi bình?
A. Nước Cl2 và dung dịch I2.
B. Nước Br2 và dung dịch I2.
C. Nước Cl2 và hồ tinh bột.
D. Nước Br2 và hồ tinh bột.
Hướng dẫn giải :
Dùng nước clo và hồ tinh bột xảy ra hiện tượng:
+ Bình NaBr: xuất hiện dung dịch vàng đậm ( do Br2 sinh ra)
+ Bình NaI: Xuất hiện màu xanh, do I2 sinh ra làm hồ tinh bột chuyển sang màu xanh
+ Bình NaCl: Không hiện tượng
→ Đáp án C
Ví dụ 9 : Có 4 bình đựng các khí riêng biệt: CO2; SO3; SO2 và N2. Trật tự dùng thuốc thử nào cho dưới đây để nhận biết các khí trên?
A. Dung dịch BaCl2, dung dịch Br2 và dung dịch Ca(OH)2
B. Dung dịch Ca(OH)2, dung dịch Ba(OH)2 và dung dịch Br2
C. Qùy tím ẩm, dung dịch Ca(OH)2 và dung dịch Br2
D. Dung dịch Br2, dung dịch BaCl2 và que đóm
Hướng dẫn giải :
Dùng BaCl2 có hiện tượng:
+ Xuất hiện kết tủa trắng gồm các khí: CO2; SO3; SO2
+ Không hiện tượng: N2
Dùng dung dịch Br2 để nhận biết các khí: CO2; SO3; SO2
+ SO2 làm mất màu dung dịch brom
+ CO2; SO3 không hiện tượng
Dùng Ca(OH)2 để nhận biết CO2; SO3
+ Xuất hiện kết tủa trắng: CO2
+ Không hiện tượng: SO3
→ Đáp án A
Cách làm bài tập tách chất hóa học cực hay, chi tiết
Phương pháp:
Sử dụng các phản ứng hóa học kết hợp với tách, chiết, đun sôi, cô cạn để tách một chất ra khỏi hỗn hợp hoặc các chất ra khỏi nhau
- Với yêu cầu tách một chất ra khỏi hỗn hợp:
+ Sử dụng các chất phản ứng tác dụng hết với các chất cần loại bỏ, còn lại chất cần tách không tác dụng chính là chất ta cần tách ra
+ Sử dụng tính chất riêng biệt của chất cần tách, sử dụng các chất chỉ phản ứng với chất cần tách
- Với yêu cầu tách riêng rẽ các chất ra khỏi nhau:
Sử dụng tính chất riêng rẽ của từng chất để chọn tác nhân phản ứng phù hợp và thu tách sản phẩm sau phản ứng để tinh chế lại chất ban đầu.
Ví dụ 1 : Có thể tách ion Cu2+ trong dung dịch chứa đồng thời các ion Ba2+; Fe2+ và Cu2+ bằng cách dùng hóa chất nào sau đây?
A. NaOH, NH4Cl
B. NaOH, dung dịch NH3
C. Ni, HCl
D. Zn, NaOH
Hướng dẫn giải :
Dùng NaOH, thu được 2 kết tủa Fe(OH)2 và Cu(OH)2
Cho dung dịch NH3 vào 2 kết tủa trên, Kết tủa Cu(OH)2 bị hòa tan do tạo phức với NH3 tạo Cu2+
→ Đáp án B
Ví dụ 2 : Để làm sạch Ag có lẫn Cu và Fe thì có thể khuấy hỗn hợp kim loại trong dung dịch
A. Cu(NO3)2
B. AgNO3
C. Fe(NO3)2
D. Pb(NO3)2
Hướng dẫn giải :
Dùng phản ứng kim loại mạnh đẩy kim loại yếu ra khỏi muối, Cu và Fe phản ứng hết với AgNO3 tạo Ag
→ Đáp án B
Ví dụ 3 : Để tách riêng lấy từng chất từ hỗn hợp gồm benzen, anilin, phenol, ta có thể dùng thêm các dung dịch
HCl và NaOH B. Br2 và HCl C. NaOH và Br2 D. CO2 và HCl
Hướng dẫn giải :
Dùng dung dịch HCl, anilin sẽ phản ứng với HCl tạo ra muối phân lớp với bezen và phenol. Tách chiết thu được 2 phần: muối C6H5NH3Cl và hỗn hợp gồm benzen và phenol.
Cho muối C6H5NH3Cl tác dụng với NaOH thu lại được anilin.
Cho NaOH tác dụng với hỗn hợp benzen và phenol. Phenol phản ứng với NaOH tạo muối và phân lớp với benzen. Tách chiết thu được 2 phân: muối C6H5ONa và benzen.
Cho muối C6H5ONa tác dụng với HCl ta thu lại được phenol.
→ Đáp án A
Ví dụ 4 : Để tách riêng từng chất benzen (ts =80oC) và axit axetic (ts =118oC) nên dùng phương pháp nào sau đây ?
A. Chưng cất B. Chiết
C. Kết tinh D. Chưng cất phân đoạn
→ Đáp án A
Ví dụ 5 : Để loại bỏ tạp chất C2H2, C2H4, but-1,3-đien, CH3NH2 có lẫn trong C2H6 ta cho hỗn hợp lần lượt đi qua dung dịch
A. Br2 và NaOH
B. Br2 và HCl
C. AgNO3/NH3 và NaOH
D. AgNO3/NH3 và HCl
Hướng dẫn giải :
Cho hỗn hợp đi qua dung dịch Br2, các chất C2H2, C2H4, but-1,3-đien do có phản ứng với dung dịch Br2
Còn lại CH3NH2 và C2H6 đi ra khỏi dung dịch, dẫn hỗn hợp này qua dung dịch HCl. CH3NH2 bị giữ lại do phản ứng với HCl, còn lại ta thu được C2H6 tinh khiết
→ Đáp án B
Các bài toán về chuẩn độ axit bazo, chuẩn độ oxi hoa khử
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
a. Phương pháp chuẩn độ trung hòa (chuẩn độ axit - bazơ)
- Dùng những dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ các dung dịch axit và dùng các dung dịch axit mạnh (HCl, HNO3, H2SO4) đã biết chính xác nồng độ làm dung dịch chuẩn để độ các dung dịch bazơ.
- Để nhận ra điểm tương đương (thời điểm dung dịch chuẩn vừa phản ứng hết với dung dịch cần xác định) của phản ứng chuẩn độ trung hòa, người ta dùng chất chỉ thị axit - bazơ (hay chỉ thi pH, là những axit yếu có màu sắc thay đổi theo pH)
Bảng ghi khoảng pH đổi màu của một số chỉ thị
| Tên thông dụng của chất chỉ thị | Khoảng pH đổi màu | Màu dạng axit - bazơ |
| Metyl da cam | 3,1 - 4,4 | Đỏ - vàng |
| Metyl đỏ | 4,2 - 6,3 | Đỏ - vàng |
| Phenolphtalein | 8,3 - 10,0 | Không màu - đỏ |
Với mỗi phản ứng chuẩn độ cụ thể người ta chọn những chất chỉ thị nào có khoảng đổi màu trắng hoặc rất sát điểm tương đương.
b. Chuẩn độ oxi hóa khử bằng phương pháp pemangant
- Chuẩn độ oxi hóa - khử (phương pháp pemangant): được dùng để chuẩn độ dung dịch của các chất khử (Ví dụ: Fe2+, H2O2, H2C2O4, .. ) trong môi trường axit mạnh (thường dùng dung dịch H2SO4 loãng), khi đó MnO4- bị khử về Mn2+ không màu:
MnO4- + 8H+ + 5e → Mn2+ + 4H2O
- Trong phương pháp này chất chỉ thị chính là KMnO4 vì ion Mn2+ không màu do đó khi dư một giọt KMnO4 dung dịch từ không màu chuyển sang màu hồng rất rõ giúp ta kết thúc chuẩn độ.
Ví dụ minh họa
Bài 1: Cần thêm vào bao nhiêu ml dung dịch NaOH 0,25M vào 50 ml dug dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2 ?
Hướng dẫn:
nNaOH = nOH = 0,25.V (mol)
nH+ = nHCl + 2nH2SO4 = 0,05.0,1 + 0,05.2.0,05
pH = 2 ⇒ [H+] = 10 - 2 M = 0,01 mol
Ta có: (0,01 - 0,25V)/(0,05 + V) = 10 - 2
0,01 - 0,25.V = 0,01.0,05 + 0,01 V ⇒ 0,26.V = 0,01 - 0,01.0,05
V = 0,0365 l = 36,5 ml
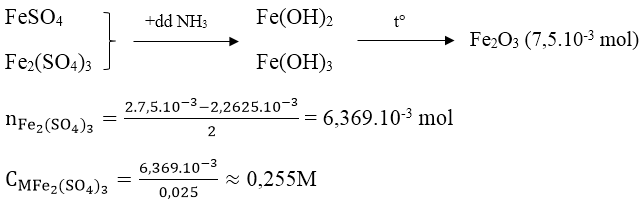
Bài 2: Lấy 25ml dung dịch A gồm FeSO4 và Fe2(SO4)3 rồi chuẩn độ bằng dung dịch hỗn hợp KMnO4 0,025M thì hết 18,10ml. Mặt khác, thêm lượng dư dung dịch NH3 vào 25ml dung dịch A thì thu được kết tủa, lọc kết tủa rồi nung đỏ trong không khí ở nhiệt độ cao đến khối lượng không đổi, cân được 1,2g. Nồng độ mol/l của FeSO4 và Fe2(SO4)3 lần lượt là:
A. 0,091 và 0,25 B. 0,091 và 0,265
C. 0,091 và 0,255 D. 0,087 và 0,255
Hướng dẫn:
Ta có:
nFeSO4 = 5.nKMnO4 = 2,2615.10-3 mol
CMFeSO4 = 2,2625/0,025 = 0,091M
B. Bài tập trắc nghiệm
Bài 1: Để xác định nồng đội dung dịch NaOH người ta tiến hành như sau: cân 1,26 gam axit oxalic ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 ml. lấy 10 ml dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) thì hết 17,5 ml dung dịch NaOH. Tính nồng độ dung dịch NaOH đã dùng.
A. 0,114M B. 0,26M C. 0,124M D. 0,16M
Lời giải:
Đáp án: A
Chuẩn độ: H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
Nồng độ dung dịch H2C2O4: C_(H2C2O4) = 1,26/126.1000/100 = 0,1M
Theo phản ứng: nNaOH = 2nH2C2O4.V = 2.10-3 mol
⇒ CM(NaOH) = 0,114M
Bài 2: Chuẩn độ 20 ml dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/l cần dùng hết 16,5 ml dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là:
A. 0,07 B. 0,08 C. 0,065 D. 0,068
Lời giải:
Đáp án: C
∑nH+ = 0,02.0,1 + 0,02a
∑nOH- = 0,0165.0,1 + 0,0165.2.0,05 = 3,3.10 - 3 mol
Trung hòa dung dịch thì ∑nH+ = ∑nOH-
0,02.0,1 + 0,02a = 3,3.10 - 3 ⇒ a = 0,065 mol/l
Bài 3: Để xác định nồng độ dung dịch H2O2, người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M. Xác định hàm lượng H2O2 trong nước oxi già.
A. 9% B. 17% C. 12% D. 21%
Lời giải:
Đáp án: B
Phản ứng
5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + SO2 + 8H2O
Từ phản ứng ⇒ nH2O2 = 5/2 nKMnO4 = 2,5.10-3 (mol)
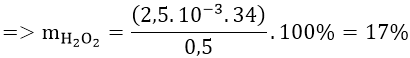
Bài 4: Để xác định hàm lượng FeCO3 trong quặng xi đe rit, người ta làm như sau: còn 0,6g mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn đọ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2ml. % theo khối lượng của FeCO3 là:
A. 12,18% B. 24,26% C. 60,9% D. 30,45%
Lời giải:
Đáp án: C
nKMnO4 = 0,025.25,2/1000 = 6,3.10-4 mol
Phương trình phản ứng:

Bài 5: Chuẩn độ 20 ml dung dịch HCl chưa biết nồng độ đã dùng hết 17 ml dung dịch NaOH 0,12M. Xác định nồng độ mol của dung dịch HCl.
A. 0,102M B. 0,12M C. 0.08M D. 0,112M
Lời giải:
Đáp án: A
PTHH: HCl + NaOH → NaCl + H2O
nNaOH = 0,017.0,12 = 0,00204(mol)
Theo PT: nHCl = nNaOH = 0,00204mol
Nồng độ mol của dung dịch HCl là: 0,00204/0,02 = 0,102(M)

