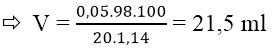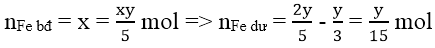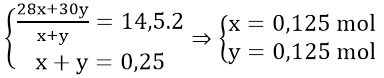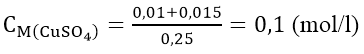Phương pháp giải Các dạng bài tập chương Crom, Sắt, Đồng - Hoá học lớp 12
Phương pháp giải Các dạng bài tập chương Crom, Sắt, Đồng
Với Phương pháp giải Các dạng bài tập chương Crom, Sắt, Đồng Hoá học lớp 12 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Crom, Sắt, Đồng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

- 6 dạng bài tập Crom, Sắt, Đồng trong đề thi Đại học có giải chi tiết Xem chi tiết
- Dạng 1: Chuỗi phản ứng hóa học của sắt, crom Xem chi tiết
- Dạng 2: Nhận biết, điều chế sắt và hợp chất của sắt Xem chi tiết
- Dạng 3: Sắt tác dụng với axit HNO3 và H2SO4 đặc nóng Xem chi tiết
- Dạng 4: Kim loại tác dụng với axit, muối Xem chi tiết
- Dạng 5: Xác định tên kim loại và oxit kim loại Xem chi tiết
- Dạng 6: Phương pháp quy đổi trong hóa học vô cơ Xem chi tiết
- Bài tập về Crom (Cr) cực hay, có lời giải chi tiết
- Bài tập về Đồng (Cu) và hợp chất của đồng cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của Crom cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của Sắt cực hay, có lời giải chi tiết
- Bài tập về Niken (Ni), Kẽm (Zn), Thiếc (Sn), Chì (Pb) cực hay, có lời giải chi tiết
- Bài tập về Sắt (Fe) cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết (cơ bản) Xem chi tiết
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết (nâng cao) Xem chi tiết
Cách nhận biết, điều chế sắt và hợp chất của sắt
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Dùng các phản ứng đặc trưng để nhận biết các chất
- Nắm vững các tính chất hóa học của các chất để giải thích các hiện tượng phản ứng.
Ví dụ minh họa
Bài 1: Hãy dùng 2 thuốc thử tự chọn để có thể phân biệt được các kim loại sau: Al, Fe, Mg, Ag. Trình bày cách nhận biết và viết các phương trình hóa học.
Hướng dẫn:
Có thể chọn 2 thuốc thử là axit HCl và dung dịch kiềm NaOH
- Lấy vào mỗi ống nghiệm một ít bột kim loại đã cho.
- Nhỏ vào mỗi ống nghiệm một ít dung dịch HCl.
Ở ống nghiệm nào không có hiện tượng gì xảy ra đó là ống đựng kim loại Ag. Phản ứng xảy ra ở các ống nghiệm còn lại.
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
Mg + 2HCl → MgCl2 + H2↑
- Nhỏ từ từ dung dịch kiềm vào ống nghiệm chứa các dung dịch muối vừa thu được.
Ở ống nào thấy có kết tủa tạo thành rồi lại tan ra thì đó là ống chứa muối nhôm.
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓
Al(OH)3 + NaOH → Na[Al(OH)4]
Ở ống nào thấy có kết tủa màu trắng xanh, sau đó dần dần hóa nâu thì đó là ống chứa muối sắt, ta nhận ra kim loại sắt.
FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓ (trắng xanh)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓ (nâu đỏ)
Ở ống nào thấy có kết tủa màu trắng không bị biến đổi thì đó là ống chứa muối magie, ta nhậ ra kim loại Mg.
MgCl2 + 2NaOH → 2NaCl + Mg(OH)2↓ (trắng)
Bài 2: Một hỗn hợp bột gồm Al, Fe, Cu. Hãy trình bày một phương pháp hóa học để tách từng kim loại ra khỏi hỗn hợp đó. Viết các phương trình hóa học của các phản ứng.
Hướng dẫn:
Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần:
Phần dung dịch là NaAlO2 và NaOH dư.
Phần chất rắn là Cu và Fe
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu chất rắn Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3↓
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3
2Al(OH)3 −tº→ Al2O3 + 3H2O
2Al2O3 −đpnc→ 4Al + 3O2
Phần chất rắn gồm Cu và Fe đem hòa tan trong HCl dư, thu được dung dịch là FeCl2 còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2↑
FeCl2 −đpnc→ Fe + Cl2
Bài 3: Có các dung dịch muối: FeCl3, FeCl2, MgCl2, AlCl3, NaCl và NH4Cl. Để phân biệt các dung dịch muối clorua này có thể dùng thuốc thử nào dưới đây?
A. Dung dịch AgNO3 B. Dung dịch NH3
C. Dung dịch H2SO4 D. Dung dịch KOH
Hướng dẫn:
Trích mẫu thử cho mỗi lần thí nghiệm. Nhỏ dung dịch KOH từ từ cho đến dư vào các mẫu thử:
- Mẫu nào xuất hiện kết tủa nâu ⇒ là dung dich FeCl3.
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
- Mẫu nào xuất hiện kết tủa trắng dần hóa nâu đung dịch FeCl2.
FeCl2 + 2KOH → Fe(OH)2 + 2KCl
- Mẫu nào xuất hiện kết tủa trắng ⇒ dung dịch MgCl2.
MgCl2 + 2KOH → Mg(OH)2 + 2KCl
- Mẫu nào không có hiện tượng nào xảy ra ⇒ dung dịch NaCl.
- Mẫu nào xuất hiện kết tủa keo trắng, tan dần khi dư dung dịch KOH
⇒ dung dịch AlCl3.
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Al(OH)3 + KOH → K[Al(OH)4]
- Mẫu nào có khí mùi khai bay ra ⇒ dung dịch NH4Cl.
KOH + NH4Cl → KCl + NH3 + H2O
Bài 4: Từ Fe, hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4. Viết các phương trình hóa học.
Hướng dẫn:
3 phương pháp hóa học điều chế trực tiếp FeSO4 từ Fe là:
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Fe + Fe2(SO4)3 → 3FeSO4
B. Bài tập trắc nghiệm
Bài 1: Hiện tượng gì xảy ra khi cho từ từ dung dịch NH3 vào dung dịch CuSO4?
A. Xuất hiện kết tủa màu xanh nhạt
B. Xuất hiện kết tủa màu xanh nhạt rồi tan thành dung dịch màu xanh đậm
C. Xuất hiện dung dịch màu xanh
D. Không có hiện tượng
Lời giải:
Đáp án: B
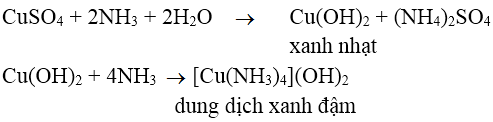
Bài 2: Hiện tượng gì xảy ra khi nhỏ một ít dung dịch KMnO4 vào dung dịch có chứa FeSO4 và H2SO4?
A. Xuất hiện màu tím hồng của dung dịch KMnO4
B. Mất màu tím hồng và xuất hiện màu vàng
C. Mất màu vàng và xuất hiện màu tím hồng
D. Cả A, B và c đều không đúng
Lời giải:
Đáp án: B
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + MnSO4 + 8H2O
Bài 3: Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Hiện tượng quan sát được là
A. dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng
B. dung dịch màu tím hồng bị nhạt dần đến không màu
C. dung dịch màu tím hồng bị chuyển dần sang nâu đỏ
D. màu tím bị mất ngay. Sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng
Lời giải:
Đáp án: A
10FeSO4 + 8H2SO4 + 2KMnO4 → 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4.
Chú ý muối Fe2(SO4)3 và FeCl3 có màu vàng
Bài 4: Hiện tượng gì xảy ra khi cho dung dịch NaOH vào ống nghiệm có chứa dung dịch FeCl2?
A. Xuất hiện màu nâu đỏ
B. Xuất hiện màu trắng xanh
C. Xuất hiện màu nâu đỏ rồi chuyển sang màu trắng xanh
D. Xuất hiện màu trắng xanh rồi chuyển sang màu nâu đỏ
Lời giải:
Đáp án: D
FeCl2 + 2NaOH → Fe(OH)2 (trắng xanh) + 2NaCl
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 (nâu đỏ)
Bài 5: Khi thêm dung dịch Na2CO3 vào dung dịch FeCl3 sẽ có hiện tượng gì xảy ra ?
A. Xuất hiện kết tủa màu nâu đỏ vì xảy ra hiện tượng thủy phân
B. Dung dịchvẫn có màu nâu đỏ vì chúng không phản ứng với nhau
C. Xuất hiện kết tủa màu nâu đỏ đồng thời có hiện tượng sủi bọt khí
D. Có kết tủa nâu đỏ tạo thành sau đó lại tan do tạo khí CO2
Lời giải:
Đáp án: C
Phương trình phản ứng:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓(đỏ nâu) + 3CO2↑ + 6NaCl
Bài 6: Để bảo quản dung dịch muối sắt (II) trong phòng thí nghiệm, người ta thường ngâm vào dung dịch đó
A. Một thanh Cu
B. Một thanh Zn
C. Một thanh Fe
D. Một thanh AI
Lời giải:
Đáp án: C
- Trong điều kiện thường Fe2+ dễ chuyển thành Fe3+
- Khi có Fe thì: Fe + 2Fe3+ → 3Fe2+
⇒ Do đó, trong dung dịch luôn có Fe2+
Bài 7: Cho vài giọt dung dịch H2S vào dung dịch FeCl3 hiện tượng xảy ra là
A. dung dịch xuất hiện kết tủa đen
B. có kết tủa vàng
C. kết tủa trắng hóa nâu
D. không hiện tượng gì
Lời giải:
Đáp án: B
H2S + 2FeCl3 → S↓(vàng) + 2FeCl2 + 2HCl
Bài 8: Cho vào ống nghiệm một ít tinh thể K2Cr2O7, sau đó cho nước vào và khuấy đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu của dung dịch X và Y lần lượt là:
A. Màu vàng và màu da cam
B. Màu nâu đỏ và màu vàng
C. Màu da cam và màu vàng
D. Màu vàng và màu nâu đỏ
Lời giải:
Đáp án: C
Trong dung dịch K2Cr2O7 (màu da cam) có cân bằng:
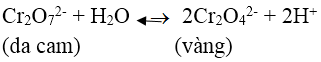
Khi thêm dung dịch KOH vào, OH- trung hòa H+ làm cân bằng chuyển dịch sang phải tạo ra CrO42- có màu vàng
Cách giải bài tập Sắt tác dụng với axit HNO3, H2SO4 đặc nóng
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Khi cho Fe tác dụng với HNO3, H2SO4 đặc nóng, trình tự phản ứng xảy ra:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Nếu Fe dư thì tiếp tục xảy ra phản ứng:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
⇒ Khi cho Fe vào dung dịch HNO3, H2SO4 đặc nóng, nếu sau phản ứng Fe dư thì muối sinh ra là muối Fe2+.
* Lưu ý: Khi cho Fe và hỗn hợp kim loại, trong đó có Fe tác dụng hết với dung dịch HNO3 thì:
mmuối nitrar = mKl + 62.ne nhận
Ví dụ minh họa
Bài 1: Cho m(g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (dktc). Giá trị của m là:
A. 70 B. 56 C. 84 D. 112
Hướng dẫn:
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Fe + 4HNO3 → Fe(NO3 )3 + NO + 2H2O
Fe + 2Fe(NO3 )3 → 3Fe(NO3 )2
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN(trong HNO3) = nN trong Fe(NO3)2 + nN trong NO,NO2
Hay: 1,28 = 2. nFe(NO3)2 + 0,38
nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy: mFe = 0,5.56 = m - 0,75m ⇒ m = 112 (g)
Bài 2: Cho 6,72 gam Fe vào axit đặc chứa 0,3 mol H2SO4, đun nóng (giả sử SO2 là sản phẩm khử duy nhất). sau khi phản ứng xảy ra hoàn toàn thu được những sản phẩm nào?
Hướng dẫn:
Ta có nFe = 6,72/56 = 0,12(mol)
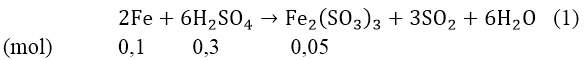
⇒ nFedu = 0,12 - 0,1 = 0,02(mol) nên tiếp tục khử Fe2(SO4)3
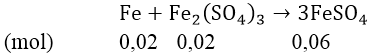
⇒ nFe2(SO4)3 = 0,05 - 0,02 = 0,03(mol)
Vậy sau phản ứng thu được 0,03 mol Fe2(SO4)3 và 0,06 mol FeSO4
Bài 3: Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x: y = 2: 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hòa tan là:
A. 3x B. y C. 2x D. 2y
Hướng dẫn:
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
* TH1: H2SO4 loãng:
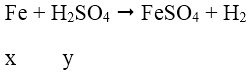
⇒ loại vì x = y
* TH2: H2SO4 đặc nóng
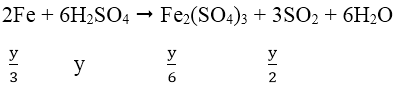
Ta có:
Do Fe dư nên tiếp tục xảy ra phản ứng:
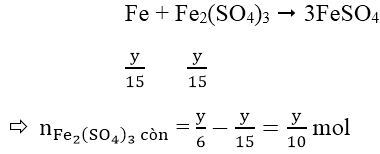
Vậy Fe hết
Cuối cùng: Fe → Fe2+ nên ta có:

Áp dụng định luật bảo toàn electron ta có: 2x = y
Đáp án B.
Bài 4: Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
A. 2,24 B. 5,60 C. 3,36 D.4,48
Hướng dẫn:
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64 x = 12 ⇒ x = 0,1 mol

Mặt khác:
Đặt x, y là số mol của NO và NO2 thì 30x + 46 y = 38 (x+ y) ⇒ x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 ⇒ 4x = 0,5 . Vậy x = 0,125 mol
V = 0,125.2. 22.4= 5,6 lít (đáp án B)
B. Bài tập trắc nghiệm
Bài 1: Cho 20 gam bột Fe vào dung dịch HNO3 và khuấy đến khi phản ứng xong thu V lít khí NO (đkc) và còn 3,2 gam kim loại. Giá trị của V là
A. 2,24 lít
B. 4,48 lít
C. 6,72 lít
D. 5,6 lít
Lời giải:
Đáp án: B
Fe còn dư nên dung dịch chỉ gồm Fe2+
Fe + 4HNO3 → Fe(NO3 )3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
mFe (pu) = 20 – 3,2 =16,8g ⇒ nFe = 0,3 mol
Fe - 2e → Fe2+
N+5 + 3e → N+2 (NO)
BT e ⇒ 3nNO = 2nFe =2.0,3 = 0,6 mol ⇒ nNO 0,2 mol ⇒ V = 4,48l
Bài 2: Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là
A. 370.
B. 220.
C. 500.
D. 420.
Lời giải:
Đáp án: A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , n = yFe2(SO4)3
→ mdd = 152 x + 400y = 51,76
nFe = nFeSO4 + 2. nFe2(SO4)3 = x + 2y = 0,29
→ x = 0,13 mol , y = 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
→ b = 0,37.98/9,8% = 370g
Bài 3: Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn 18 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1: 1 là: ( biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít B. 0,6 lít C. 0,8 lít D. 1,2 lít
Lời giải:
Đáp án: C
nFe = nCu = 0,15 mol
- Do thể tích dung dịch HNO3 cần dùng ít nhất → muối Fe2+
→ ∑ ne cho = 2.(0,15 + 0,15) = 0,6 mol
- Theo ĐLBT mol electron: nH+ = nHNO3 = (0,6.4): 3 = 0,8 mol
→ VHNO3 = 0,8 lít
Bài 4: Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là:
A. 1,92 gam B. 3,20 gam C. 0,64 gam D. 3,84 gam
Lời giải:
Đáp án: A
nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
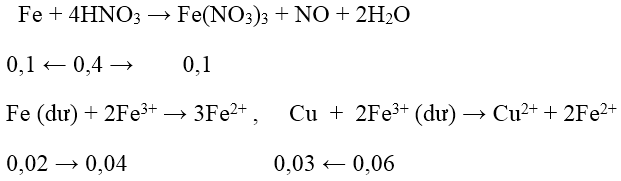
→ mCu = 0,03.64 = 1,92 gam
Bài 5: Cho hỗn hợp A gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thấy thoát ra 0,448 lít khí NO duy nhất (đktc). Tính khối lượng muối trong dung dịch thu được.
A. 54g B. 42g C. 36g D. 32g
Lời giải:
Đáp án: A
Ta có: nNO = 0,02 (mol); nFe ban đầu = 0,0375 (mol)
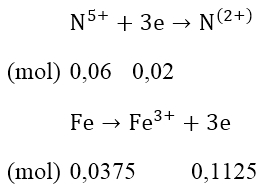
Nếu Fe phản ứng hết, số mol electron nhường = 0,0375 × 3= 0,1125 > 0,06 Fe dư, Cu chưa phản ứng với dung dịch HNO3.

Như vậy sau khi phản ứng kết thúc Fe dư, Cu chưa phản ứng muối tạo ta là Fe(NO3)2: mFe(NO3)2 = 0,03 × 180 = 54(gam)
Bài 6: Nung nóng 16,8 gam bột sắt ngoài không khí, sau một thời gian thu được m gam hỗn hợp X gồm các oxit sắt và sắt dư. Hòa tan hết hỗn hợp X bằng H2SO4 đặc nóng thu được 5,6 lít SO2 (đktc). Hãy xác định khối lượng của hỗn hợp X.
A. 40g B. 20g C.25g D.32g
Lời giải:
Đáp án: B
Áp dụng bảo toàn electron cho các quá trình oxi hóa và khử tổng hợp từ các giai đoạn của các phản ứng.
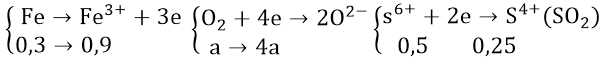
Ta có: nFe = 16,8/56 = 0,3(mol); nSO2 = 5,6/22,5 = 0,25(mol)
Theo bảo toàn electron ta có: 4a + 0,5 = 0,9 ⇒ a = 0,1(mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mFe + mO2 = 16,8 + 32a = 16,8 + 32.0,1 = 20(gam)
Bài 7: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít hỗn hợp X gồm (NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối vơi hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 3,36l B. 4,48l C. 5,6l D. 1,2 l
Lời giải:
Đáp án: C
Ta có: 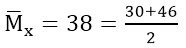
Trong 12 gam hỗn hợp có 0,1 mol Fe và 0,1 mol Cu
Fe → Fe3+ + 3e Cu → Cu2+ + 2e
⇒ ∑nelectron do chất khử cho = 0,5(mol)

Áp dụng định luật bảo toàn electron: 4x = 0,5 ⇒ x = 0,125(mol)
Vậy: V = 0,125.2.22,4 = 5,6(lít)
Bài 8: Cho hỗn hợp gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thấy thoát ra 0,448 lít khí NO(đktc). Tính khối lượng muối thu được trong dung dịch , biết các phản ứng xảy ra hoàn toàn.
A. 4,5g B. 3,6g C. 2,4g D. 5,4g
Lời giải:
Đáp án: D
Phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Fe + 2Fe(NO3 3 → 3Fe(NO3)2 (2)
Từ (1) ⇒ nFe = nFe(NO3 )3 = nNO = 0,448/22,4 = 0,02(mol)
Từ (2) ⇒ nFe = 1/2 nFe(NO3)2 = 0,01(mol)
nFe(NO3)2 = 3/2 nFe(NO3)3 = 0,03(mol)
nFedu = 0,0375 - 0,02 - 0,01 = 0,0075(mol)
Fe dư nên Cu chưa phản ứng.
⇒ mFe(NO3)3 = 180*0,03 = 5,4(gam)
Bài 9: Cho 18,5 gam hỗn hợp X gồm Fe và Fe3O4 tác dụng với 200ml dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và 1,46 gam kim loại. Nồng độ mol của dung dịch HNO3 là:
A. 2M B. 2,4M C. 2,5M D. 3,2M
Lời giải:
Đáp án: D
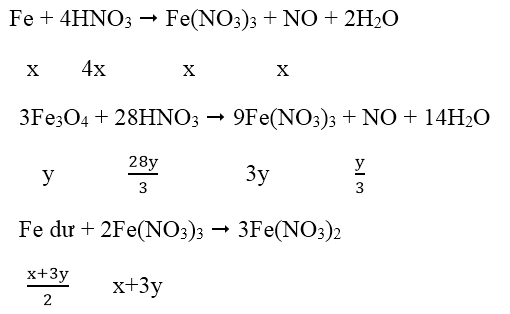
Ta có:
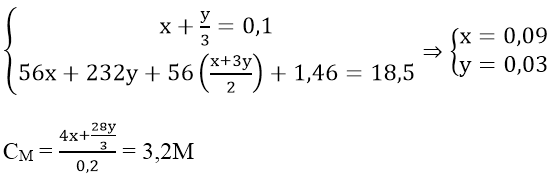
Bài 10: Hòa tan hỗn hợp gồm 0,1 mol Fe và a mol Cu vào dung dịch HNO3 loãng dư thu được 5,6 lít hỗn hợp NO và N2 (đktc) có tỷ khối hơi so với H2 là 14,5. Vậy a có giá trị là:
A. 0,6625 B. 0,6225 C. 0,0325 D. 0,165
Lời giải:
Đáp án: A
Gọi x, y là số mol của N2 và NO trong hỗn hợp.
Ta có:
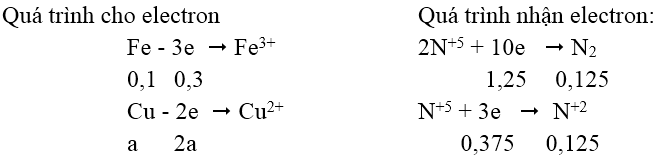
Ta có: ∑necho = ∑ne nhận ⇒ 0,3 + 2a = 1,25 + 0,375
⇒ a = 0,6625 mol
Cách giải bài tập Kim loại tác dụng với axit, muối
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Với dung dịch axit
Phản ứng thuộc loại oxi hóa khử nên có thể vận dụng phương pháp bảo toàn electron.
Trong HCl,H2SO4 loãng:Cr và Fe bị H^+ của axit oxi hóa thành Cr2+,Fe2+ còn Cu không phản ứng.
Với H2SO4 đậm đặc,HNO3
+) Cu bị tan ra
+) Fe, Al, Cr bị thụ động trong HNO3 đặc nguội và H2SO4đặc nguội
- Với H2SO4 đặc nóng, HNO3 loãng,HNO3 đặc nóng,… Fe và Cr bị oxi hóa thành
Fe3+,Cr3+
+) S6+ và N5+ nếu bị khử về mức oxi hóa thấp hơn như SO2,NO, NO2,...
Chú ý: Nếu kim loại còn dư, thì thu được muối của sắt II và có thể muối sắt III dư.
Với dd Muối
- Vận dụng ý nghĩa của dãy điện thế cực chuẩn: Cr, Fe, Cu có thể đẩy kim loại yếu hơn ra khỏi muối như Ag, Hg...
- Với dạng bài tập: từ kim loại mạnh, tạo thành kim loại yếu hơn, có sự thay đổi về khối lượng nên vận dụng phương pháp tăng giảm khối lượng.
Ví dụ minh họa
Bài 1:Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Hướng dẫn:
Phương trình phản ứng:
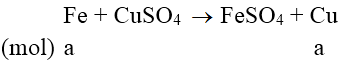
m tăng = (64 - 56).a = 1 ⇒ a = 0,125 mol
nFe = 0,125 ⇒ nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
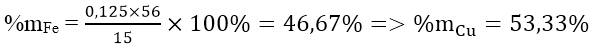
Bài 2: Cho 100 gam hợp kim của Fe, Cr, Al tác dụng với một lượng dư dung dịch NaOH thu được 4,98 lít khí. Lấy bã rắn không tan cho tác dụng với một lượng dư dung dịch HCl (không có không khí ) thu được 38,8 lít khí. Các thể tích khí đo ở đktc. Xác định thành phần % của hợp kim.
Hướng dẫn:
Phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
Cr + 2HCl → CrCl2 + H2 (3)
Từ (1)⇒ nAl = 2/3 nH2 = 2/3.4,98/22,4 = 0,15(mol)
⇒ mAl = 0,15.27 = 4,05(gam)
⇒ mCr + Fe = 100 - 4,05 = 95,95(gam)
Gọi số mol Fe và Cr lần lượt là x và y mol
Theo đề bài ta có hệ phương trình:
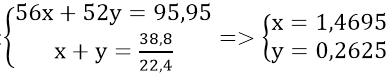
Vậy:
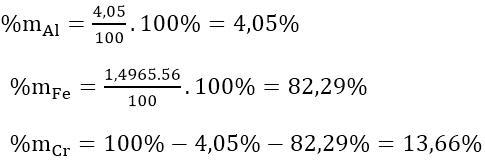
Bài 3: Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
A. 600ml B. 200ml C. 800ml D. 400ml
Hướng dẫn:
Theo ĐL bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) ⇒ nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
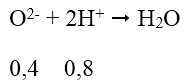
VHCl = 0,8: 2 = 0,4 (lít) = 400ml
B. Bài tập trắc nghiệm
Bài 1: Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
A. 0,1M B. 0,15M C. 0,12M D. 0,2M
Lời giải:
Đáp án: A
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4:
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol ⇒ n CuSO4 = 0,1 mol
Từ (1) ⇒ 0,1 mol Mg tác dụng với 0,1 mol CuSO4, sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng: 0,01 .(64 – 24) = 0,4 (gam)
⇒ Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng:
0,52 - 0,40 = 0,12 (gam)
Fe + CuSO4 → FeSO4 + Cu
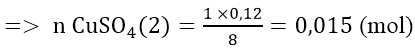
Vậy
Bài 2: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 B. 240 C. 400 D. 120
Lời giải:
Đáp án: A
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol; số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
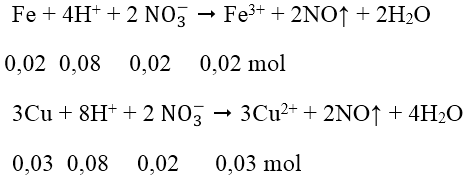
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH^-.

Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol ⇒ V = 360ml
Bài 3: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít hỗn hợp X gồm(NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối với hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 2,24l B. 5,6l C. 4,48l D. 3,36l
Lời giải:
Đáp án: B
Ta có: 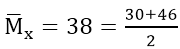
Có 56a + 64a = 12 ⇒ a = 0,1 mol ⇒ nFe = nCu = 0,1 mol

Áp dụng định luật bảo toàn electron: 4x = 0,5 ⇒ x = 0,125(mol)
Vậy: V = 0,125.2.22,4 = 5,6(lít)
Bài 4: Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch CuSO4 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch HNO3 2M biết phản ứng tạo ra NO.
A. 0,12l B. 0,15 l C. 0,18l D. 0,2l
Lời giải:
Đáp án: C
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
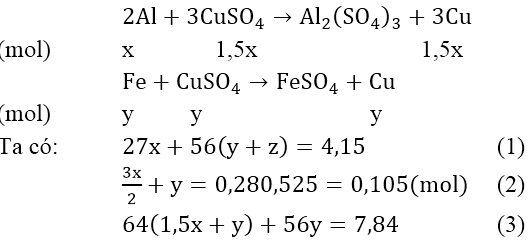
Phản ứng:
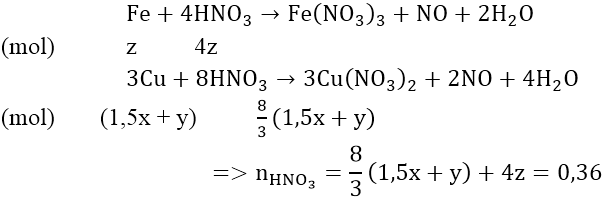
Vậy: VHNO3 = 0,36/2 = 0,18(lít)
Bài 5: Cho một hỗn hợp gồm có 1,12 gam Fe và 0,24 gam Mg tác dụng với 250 ml dung dịch CuSO4. Phản ứng thực hiện xong, người ta thu được kim loại có khối lượng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 đã dùng.
A. 0,1M B. 0,12M C. 0,2M D. 0,05M
Lời giải:
Đáp án: A
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là:
0,03 .64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam)
Đặt khối lượng Fe tham gia ở (2) là x, khối lượng sắt dư là (1,12 – 56x) và khối lượng Cu sinh ra ở (2) là 64x.
Ta có: (1,12 - 56x) + 64x = 1,24 ⇒ x = 0,015
Lượng CuSO4 trong 250 ml dung dịch đã phản ứng hết:
0,015 + 0,01 = 0,025(mol)
Nồng độ mol của dung dịch CuSO4 đã dùng là: 0,025/0,25 = 0,1mol|lít
Bài 6: Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu đựơc m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (đktc). Giá trị của m1 và m2 lần lượt là:
A. 8,10 và 5,43 B. 1,08 và 5,16
C. 0,54 và 5,16 D. 1,08 và 5,43.
Lời giải:
Đáp án: D
Ta có: nCu(NO3)2 = 0,03 mol; nAgNO3 = 0,03 mol; nH2 = 0,015 mol
Chất rắn X + dd HCl dư → H2 ⇒ trong chất rắn X có Al dư
Cu(NO3)2 và AgNO3 hết
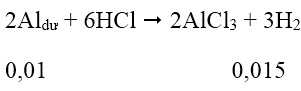
Al phản ứng hết với dd Cu(NO3)2 và AgNO3
Quá trình nhận e:

Tổng số mol e nhận = 0,06 + 0,03 = 0,09 mol
Quá trình nhường e:
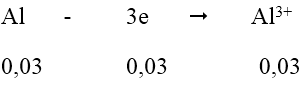
Vậy m2 = mAl dư + mCu + mAg = 0,01.27 + 0,03.64 + 0,03.108 = 5,43 gam
m1 = mAl ban đầu = (0,01 + 0,03).27 = 1,08g
Bài 7: Hòa tan hoàn toàn hỗn hợp gồm 0,01 mol Al; 0,05 mol Zn và 0,03 mol Fe cần vừa đủ 200ml dung dịch HCl 0,1M và H2SO4 a mol/l. Giá trị của a là?
A. 0,425 B. 0,5 C. 0,625 D. 0,75
Lời giải:
Đáp án: A
∑nH+ = 0,2.0,2 + 0,2.2a = 0 ,02 + 0,4a (mol)
∑ne cho = 0,01.3 + 0,05.2 + 0,03.2 = 0,19 (mol)
Ta có: ne cho = ne nhận = nH+
0,02 + 0,4a = 0,19 ⇒ a = 0,425
Bài 8: Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g B. 4,4g C. 4,08g D. 5,4g
Lời giải:
Đáp án: C
Phản ứng xảy ra theo thứ tự:
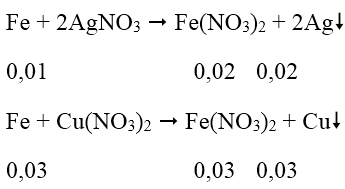
⇒ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)
Bài 9: Hòa tan m gam hỗn hợp A gồm Cu, Ag trong dung dịch HNO3 thu được dung dịch B chứa hỗn hợp 7,06g muối và 0,05 mol NO2 (duy nhất). Giá trị của m là:
A. 2,2 B. 3,06 C. 2,58 D. 3,96
Lời giải:
Đáp án: D
0,05 mol NO2 đã nhận 0,05 mol e
⇒ số mol điện tích (+) tạo ra là 0,05 mol ⇒ Số mol NO3- là 0,05 mol
m = mmuối - mNO3- = 7,06 - 0,05.62 = 3,96g
Bài 10: Đốt cháy hoàn toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml B.21,5 ml C. 23,4 ml D. 19,6 ml
Lời giải:
Đáp án: B
mO = moxit - mkim loại = 4,66 - 3,86 = 0,8g
nO = 0,8/16 = 0,05 mol
nO = 2nH+ = nH2SO4 = 0,05 mol