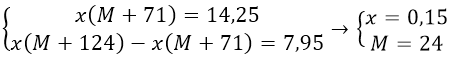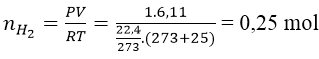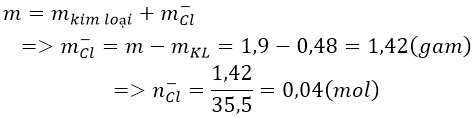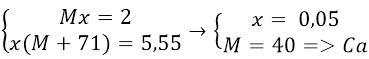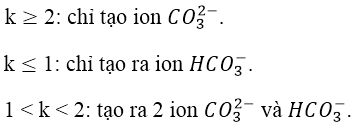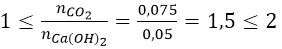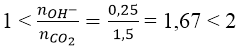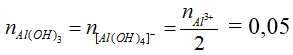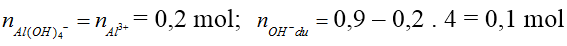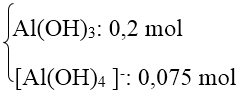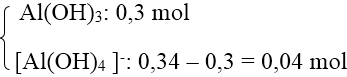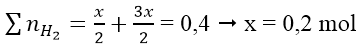Phương pháp giải Các dạng bài tập chương Kim loại kiềm, kim loại kiềm thổ, nhôm - Hoá học lớp 12
Phương pháp giải Các dạng bài tập chương Kim loại kiềm, kim loại kiềm thổ, nhôm
Với Phương pháp giải Các dạng bài tập chương Kim loại kiềm, kim loại kiềm thổ, nhôm Hoá học lớp 12 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập chương Kim loại kiềm, kim loại kiềm thổ, nhôm từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

- 6 dạng bài tập Kim loại kiềm, kiềm thổ, nhôm trong đề thi Đại học có giải chi tiết Xem chi tiết
- Dạng 1: Tính chất chung của kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 2: Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 3: Nhận biết, điều chế kim loại kiềm, kiềm thổ, nhôm Xem chi tiết
- Dạng 4: Bài toán xác định tên kim loại Xem chi tiết
- Dạng 5: CO2, SO2 tác dụng với dung dịch kiềm Xem chi tiết
- Dạng 6: Tính lưỡng tính của nhôm Xem chi tiết
- Dạng 7: Phản ứng nhiệt nhôm Xem chi tiết
- Dạng 8: Các dạng bài tập về muối cacbonat Xem chi tiết
- Dạng 9: Các dạng bài tập về nước cứng Xem chi tiết
- Bài tập về Hợp chất của kim loại kiềm thổ cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của kim loại kiềm cực hay, có lời giải chi tiết
- Bài tập về Hợp chất của nhôm cực hay, có lời giải chi tiết
- Bài tập về Kim loại kiềm thổ cực hay, có lời giải chi tiết
- Bài tập về Kim loại kiềm cực hay, có lời giải chi tiết
- Bài tập về Nhôm cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (cơ bản) Xem chi tiết
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết (nâng cao) Xem chi tiết
Phương pháp giải Bài tập xác định tên kim loại hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Mỗi nguyên tố có một số điện tích hạt nhan (Z) và khối lượng mol nguyên tử xác định (M). Do đó tùy theo bài toán mà tìm cách xác định: Z hoặc M.
Lưu ý: Nếu bài toán thiếu dữ kiện (giả sử hóa trị của kim loại chưa biết) thì tìm sự phụ thuộc của M theo hóa trị n rồi rựa vào điều kiện của n (nguyên, 1 ≤ n ≤ 3) để tìm M.
- Trong các bài tập có hai hay nhiều chất cùng thành phần hóa học, phản ứng tương tự nhau có thể thay chúng bằng một chất có công thức chung, như vậy việc tính toán sẽ rút gọn được số ẩn.
Khối lượng phân tử trung bình của một hỗn hợp là khối lượng của 1 mol hỗn hợp đó:
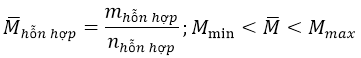
Ví dụ minh họa
Bài 1: Cho 3,1 g hỗn hợp hai kim loại kiềm ở hai chu kì kế tiếp trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 (đktc). Xác định tên hai kim loại kiềm và tính thành phần % khối lượng mỗi kim loại trong hỗn hợp?
Hướng dẫn:
Gọi R— là kí hiệu và nguyên tử khối chung của 2 kim loại:
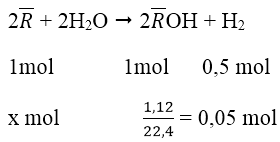
⇒ x = 0,1 mol
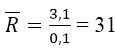
⇒ 2 kim loại đó là Na (23) và K (39).
Bài 2: Cho 8.8 gam một hỗn hợp gồm 2 kim loại ở hai chu kì liên tiếp thuộc nhóm IIA tác dụng với dung dịch HCl dư cho 6,72 lít khí hidro (đktc). Xác định hai kim loại.
Hướng dẫn:
Đặt công thức chung của hai ki loại ở hai chu kì liên tiếp và thuộc phân nhóm IIA cần tìm là M—.
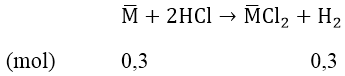
Vậy khối lượng mol nguyên tử trung bình của hai kim loại là:
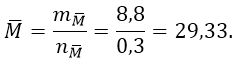
Trong nhóm IIA, có Mg = 24 < 29,33 < 40 = Ca; Mg thuộc chu kì 2, Ca thuộc chu kì 3. Vậy hai kim loại cần tìm là Mg và Ca.
Bài 3: Khi lấy 14,25g muối clorua của một kim loại chỉ có hóa trị II và một lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95g. Xác định tên kim loại.
Hướng dẫn:
Gọi kim loại cần tìm là M, có hóa trị n
Công thức muối clorua là MCln
Công thức muối nitrat là M(NO3)2. Có số mol là x
Theo bài ra ta có hệ pt:
M là Mg
B. Bài tập trắc nghiệm
Bài 1: Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
A. K
B. Na
C. Ba
D. Ca
Lời giải:
Đáp án: C
M: x mol ; M2On: y mol
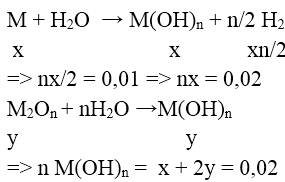
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
Bài 2: Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là
A. Mg
B. Al
C. Ca
D. Na
Lời giải:
Đáp án: A
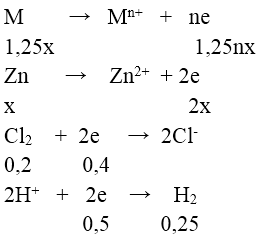
Bảo toàn e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M + 65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
Bài 3: Hòa tan hết 10,1 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước thu được 3 lít dung dịch có pH = 13. Hai kim loại kiềm đó là:
A. Na, K
B. Li, Na
C. K, Rb
D. Rb, Cs
Lời giải:
Đáp án: A
pH = 13 ⇒ [OH-] = 0,1M ⇒ n OH- = 0,3 mol
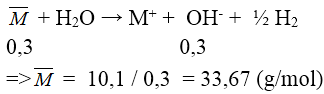
Bài 4: Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A. Natri , magie
B. Liti và beri
C. Liti và beri
D. Kali , bari
Lời giải:
Đáp án: A
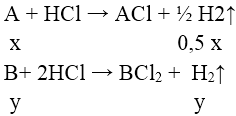
⇒ nH2 = 0,5x + y = 0,25 ⇒ 0,25 < x + y < 0,5
⇒ 7,1/0,5 < M— < 7,1/0,25 ⇒ 14,2 < M— < 28,4
Chỉ có cặp nghiệm A = 23 (Na ) , B = 24 (Mg) thỏa mãn
Bài 5: Hòa tan hòa toàn 6,645g hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì liên tiếp nhau vào nước được dd X. Cho toàn bộ dd X tác dụng hoàn toàn với dd AgNO3 (dư), thu được 18,655g kết tủa. Hai kim loại kiềm trên là :
A. Na, K
B. Rb, Cs
C. Li , Na
D. K , Rb
Lời giải:
Đáp án: C
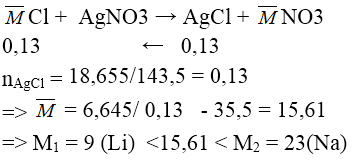
Bài 6: Hỗn hợp X gồm M2CO3, MHCO3, MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 gam chất rắn. Cũng đem 20,29 gam hỗn hợp X tác dụng hết với 500ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y.Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 gam kết tủa. Kim loại M là
A. Na
B. Li
C. K
D. Cs
Lời giải:
Đáp án: C
+) Nung X:
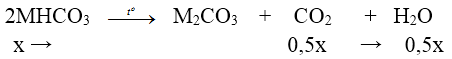
⇒ ∆m giảm = mCO2 + mH2O ⇒ 31x = 20,29 – 18,74 ⇒ x = 0,05 mol
+) X + HCl:

⇒ nCO2 = y + 0,05 = 0,15 ⇒ y = 0, 1 mol
Dung dịch Y chứa MCl và HCl dư. Gọi z là số mol MCl có trong X ta có:
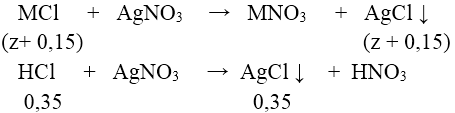
⇒ nAgCl = 0,5 + z = 74,62/143,5 = 0,52 ⇒ z = 0,02
⇒(2M + 60).0,1 + (M + 61). 0,05 + (M + 35,5).0,02 = 20,29 ⇒ M = 39(K)
Bài 7: Cho 10g một kim loại kiềm thổ tác dụng với H2O, thu được 6,11 lít khí H2 (ở 25℃ và 1 atm). Hãy xác định tên của kim loại kiềm thổ đã dùng.
A. Mg B. Ca C. Ba D. Be
Lời giải:
Đáp án: B
Ta có:
Gọi A là kí hiệu, nguyên tử khối của kim loại.
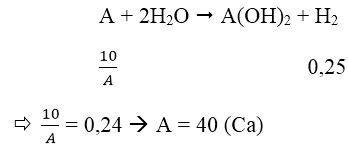
Bài 8: Điện phân nóng chảy hoàn toàn 1,9 gam muối clorua của một kim loại hóa trị II thu được 0,48 g kim loại ở catot. Xác định tên kim loại đó.
A.Sr B. C. Ba D. Mg
Lời giải:
Đáp án: D
Ta có:
Do kim loại cần tìm có hóa trị II nên công thức của muối là MCl2
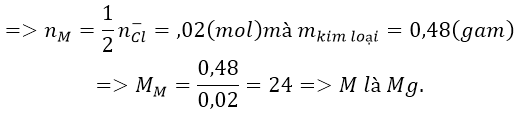
Bài 9: Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoat ra 0,672 lít khí H2 (đktc). Tìm tên hai kim loại đem dùng.
A. Ca và Mg B. Ca và Sr. C. Mg và Ba D. Ba và Sr
Lời giải:
Đáp án: B
Gọi R— là kim loại hai chu kì liên tiếp của nhóm IIA.
Ta có: nH2 = 0,672/22,4 = 0,03(mol)
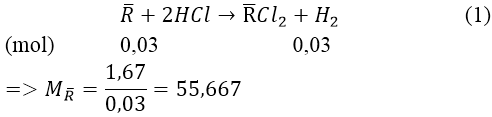
⇒ 2 kim loại cần tìm là: Ca và Sr.
Bài 10: Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be B. Mg C. Ca. D. Ba
Lời giải:
Đáp án: C
Gọi M là kim loại nhóm II, số mol là x
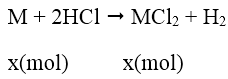
Theo đề bài ra ta có hệ phương trình:
Cách giải bài tập CO2, SO2 tác dụng với dung dịch kiềm hay, chi tiết
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Tác dụng với NaOH, KOH, Ca(OH)2, Ba(OH)2
Đối với bài toán này ta tính hệ số k:
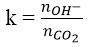
Nếu:
PTHH tạo muối:
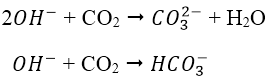
Lưu ý:
- Hấp thụ CO2 vào NaOH dư/ nước vôi dư chỉ tạo muối Na2CO3/ CaCO3.
- Hấp thụ CO2 dư vào NaOH/ nước vôi chỉ tạo muối NaHCO3/ Ca(HCO3)2.
- Hấp thụ CO2 vào NaOH tạo dung dịch muối. Sau đó thêm BaCl2 vào dung dịch muối thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa: tạo ra 2 muối Na2CO3 và NaHCO3.
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa. Sau đó thêm NaOH dư vào thấy có kết tủa nữa: tạo ra 2 muối CaCO3 và Ca(HCO3)2.
- Hấp thụ CO2 vào nước vôi trong thấy tạo kết tủa, lọc bỏ kết tủa rồi đun nung nóng lọc lại thấy kết tủa trắng nữa: tạo ra 2 muối CaCO3 và Ca(HCO3)2.
- Nếu bài toán không cho bất kì dữ liệu nào thì phải cho trường hợp để giải.
Ví dụ minh họa
Bài 1: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 5,8 g B. 6,5 g C. 4,2 g D. 6,3 g
Hướng dẫn:
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 −tº→ RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
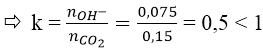
⇒ tạo ra muối NaHCO3 và CO2 dư.
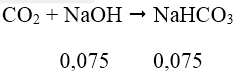
⇒ mmuối = 0,075.84 = 6,3(g)
Bài 2: Cho 100g CaCO3 tác dụng hoàn toàn với dung dịch HCl để lấy khí CO2 sục vào dung dịch chứa 60 g NaOH. Tính khối lượng muối natri thu được.
Hướng dẫn:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Số mol CaCO3 nCaCO3 = 100/100 = 1 mol
Số mol CO2 nCO2 = nCaCO3 = 1 mol
Số mol NaOH nNaOH = 60/40 = 1,5 mol
Lập tỉ lệ k = nNaOH/nCO2 = 1,5/1 = 1,5
k = 1,5 phản ứng tạo ra hai muối NaHCO3 và Na2CO3
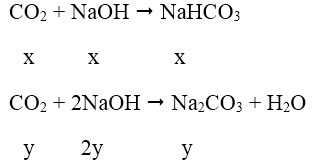
Gọi x, y lần lượt là số mol NaHCO3 và Na2CO3.
Theo bài ra ta có hệ
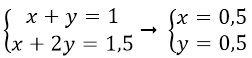
Khối lượng NaHCO3 m = 84.0,5 = 42(g)
Khối lượng Na2CO3 m = 106.0,5 = 53 (g)
Bài 3: Cho 2,8 gam CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2 (đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Hướng dẫn:
Ta có: nCaO = 2,8/56 = 0,05(mol) và nCO2 = 1,68/22,4 = 0,075(mol)
Phản ứng:
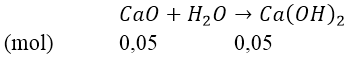
Lập tỉ lệ:
Như vậy, sau phản ứng tạo thành 2 muối:
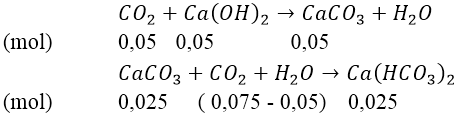
⇒ mCaCO3 = 100(0,05 - 0,025) = 2,5(gam)
Khi đun nóng dung dịch:
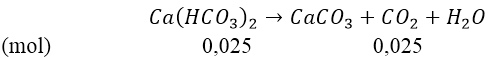
Vậy khi đun nóng, khối lượng kết tủa thu được tối đa là 5 gam.
Bài 4: Cho V lít SO2 (đktc) vào 300 ml dung dịch Ca(OH)2 0,1M thu được 2,08 gam kết tủa. Tìm V.
Hướng dẫn:
Ta có: nCa(OH)2= 0,1 × 0,3 = 0,03 (mol)
Kết tủa là CaSO3 ⇒ nCaSO3 = 2,6/120 = 0018 (mol)
+) Trường hợp 1: Ca(OH)2 dư:
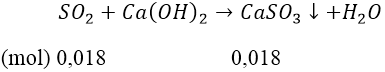
nSO2 = 0,018 (mol) ⇒ V = 0,4032 (lít)
+) Trường hợp 2: xảy ra xả 2 phản ứng.
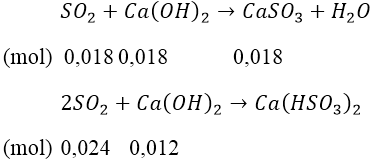
nSO2 = 0,018 + 0,024 = 0,042 (mol) ⇒ V = 0,9408 (lít)
B. Bài tập trắc nghiệm
Bài 1: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Giá trị của X là:
A. 1,0 B. 1,4 C. 1,2 D. 1,6
Lời giải:
Đáp án: B
Ta có: nCO2 = 0,1 mol; nBaCO3 = 11,82/197 = 0,06 mol; nK2CO3 = 0,02 mol
Khi sục CO2 vào dung dịch hỗn hợp K2CO3 và KOH, giả sử chỉ xảy ra phản ứng:
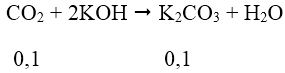
⇒ nK2CO3 trong dung dịch = 0,1 + 0,02 = 0,12 mol
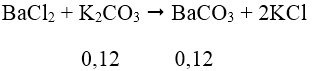
Ta thấy n↓ = 0,12 → n↓ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3
Áp dụng định luật bảo toàn nguyên tố C ta có:
nCtrong CO2 + nCTrong K2CO3 = nCTrong BaCO3 + nCTrong KHCO3
0,1 + 0,02 = 0,06 + x (x là số mol BaCO3)
x = 0,06

⇒ nKOH = 0,14 mol → [KOH] = 0,14/0,1 = 1,4M
Bài 2: Sục V lít CO2 (đktc) vào 150 ml dung dịch Ba(OH)2 1M sau phản ứng thu được 19,7 gam kết tủa. Tính V?
A. 2,24l B. 3,36l C. 4,48l D. Cả A và C
Lời giải:
Đáp án: D
Phản ứng có thể xảy ra là:
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (2)
Khi sục CO2 vào dung dịch Ba(OH)2, kết tủa thu được là BaCO3
Ta có: nBaCO3 = 19,7/197 = 0,1(mol) và nBa(OH)2 = 1.150/1000 = 0,15(mol)
So sánh thấy: nBaCO3 ≠ nBa(OH)2 nên có hai trường hợp:
Trường hợp 1: xảy ra phản ứng (1), tạo muối BaCO3, Ba(OH)2 còn dư:
Lúc đó: nCO2 = nBaCO3 = 0,1(mol)
Vậy: VCO2 = 0,1.22,4 = 2,24(lít)
Trường hợp 2: Xảy ra hai phản ứng, tạo muối (CO2 và Ba(OH)2 đều hết).
ở phản ứng (1): nCO2 pư(1) = nBa(OH)2 pư (1) = nBaCO3 = 0,1(mol)
⇒ nBa(OH)2 pư (2) = 0,15 - 0,1 = 0,05 (mol)
⇒ nCO2 pư (2) = 2.0,05 = 0,1(mol)
Suy ra tổng số mol CO2: nCO2 = nCO2 pư(1) + nCO2 pư(2) = 0,1 + 0,1 = 0,2(mol)
⇒ VCO2 = 0,2.22,4 = 4,48 (lít)
Bài 3: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là:
A. 0,4M B. 0,2M C. 0,6M D. 0,1M
Lời giải:
Đáp án: B
Ta có: nCO2 = 0,15 mol; nBa(OH)2 = 0,125 mol; nOH- = 0,25 mol
Ta thấy
→ tạo ra 2 muối.
PTPỨ:
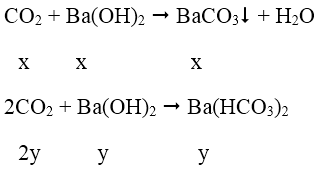
Ta có hệ:
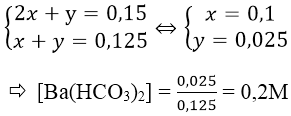
Bài 4: Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 có nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là:
A. 0,032 B. 0,048 C. 0,06 D. 0,04
Lời giải:
Đáp án: B
Ta có: nCO2 = 2,688/22,4 = 0,12 mol;
nBaCO3 = 11,82/197 = 0,06 mol
Do nCO2 ≠ nBaCO3 nên ngoài BaCO3 còn có Ba(HCO3)2 được tạo thành.
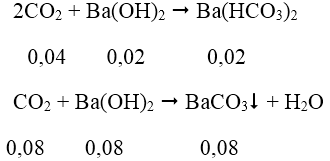
Theo phản ứng: ∑nBa(OH)2 = 0,08 + 0,02 = 0,1 mol
a = 0,1/2,5 = 0,04M
Bài 5: Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào m gam dung dịch hỗn hợp chứa 0,05 mol NaOH; 0,05mol KOH; 0,05 mol Ba(OH)2. Dung dịch sau phản ứng có khối lượng?
A. (m – 11,65) gam
B. (m + 6,6) gam
C. (m – 5,05) gam
D. (m – 3,25) gam
Lời giải:
Đáp án: D
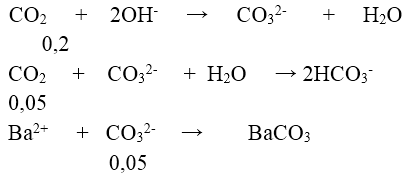
⇒ mdd = m + 0,15.44 – 197.0,05 = (m – 3,25) gam
Bài 6: Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00
B. 0,75
C. 1,25
D. 1,00
Lời giải:
Đáp án: C
n OH- = n NaOH + 2n Ca(OH)2 = 0,05 mol
n CO2 = 0,672/22,4 = 0,03 mol
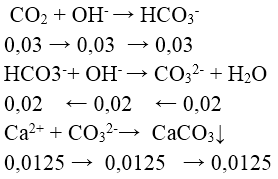
⇒ x = 0,0125.100 = 1,25 g
Bài 7: Hấp thụ hoàn toàn 4,48 lít CO2 ở (đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là:
A. 19,70 B. 17,73 C. 9,85 D. 11,82
Lời giải:
Đáp án: C
Ta có: nCO2 = 4,48/22,4 = 0,2 mol
nNaOH = 0,5.0,1 = 0,05 mol
nBa(OH)2 = 0,2.0,5 = 0,1 mol
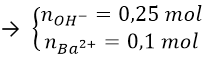
Ta thấy:
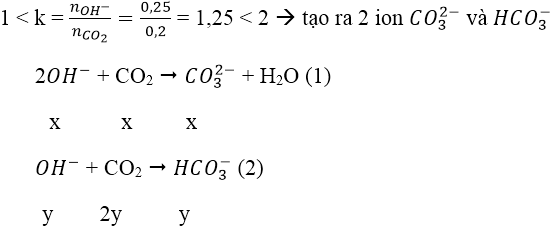
Ta có hệ phương trình:
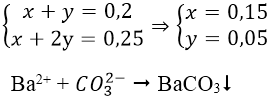
⇒ mBaCO3 = 0,05.197 = 9,85 g
Bài 8: Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là:
A. 23,2 B. 12,6 C. 18,0 D. 24,0
Lời giải:
Đáp án: C
Pt pư:
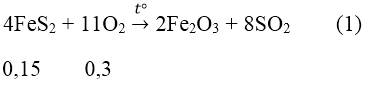
Ta có: nBa(OH)2 = 0,15 mol
NKOH = 0,1 mol
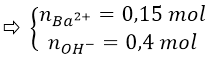
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) ↓ BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO-3.
Vì: Ba2+ + HSO-3 + OH- → BaSO3↓ + H2O
Ta có: nBaCO3 = 0,1 mol
Ptpứ:
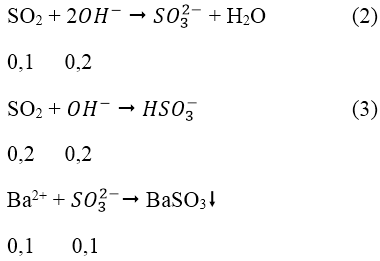
Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: nSO2 = 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: nFeS2 = 1/2 nSO2 = 0,15 mol ⇒ mFeSO24 = 120.0,15 = 15 (g)
Cách giải bài tập về Tính lưỡng tính của nhôm hiđroxit Al(OH)3
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cho dung dịch OH- tác dụng với dung dịch Al3+ hoặc cho H+ tác dụng với dung dịch AlO-2 (hoặc [Al(OH)4]-
a/ Cho từ từ a mol OH- vào dung dịch chứa b mol Al3+. Tìm khối lượng kết tủa:
Al3+ + OH- → Al(OH)3↓
Nếu OH- dư: Al(OH)3 + OH- → AlO-2 + 2H2O
- Khi đó tùy theo tỉ lệ số mol OH-: số mol Al3+ mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
* Để giải nhanh có thể sử dụng công thức:
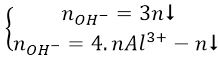
b/ Nếu cho từ từ H+ vào dung dịch chứa AlO-2 (hoặc [Al(OH)4]- thì có các phản ứng sau:
AlO-2 + H+ + H2O → Al(OH)3
Nếu H+ dư: Al(OH)3 + H+ → Al3+ + 3H2O
Khi đó tùy theo tỉ lệ số mol H3+: số mol AlO-2 mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tảu vừa có muối tan.
* Để giải nhanh có thể sử dụng công thức:
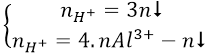
Ví dụ minh họa
Bài 1: Rót 100 ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
Hướng dẫn:
Ta có: nNaOH = 0,35 mol, nAlCl3 = 0,1 mol
Vận dụng tỉ lệ T
nOH- = 0,35 mol, nAl3+ = 0,1 mol

→ m↓ = 0,05 . 78 = 3,9 g
hoặc T = 3,5 nên
Bài 2: Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X. Tính nồng độ mol/l các chất trong dung dịch X?
Hướng dẫn:
nOH- = 0,9 mol, nAl3+ = 0,2 mol
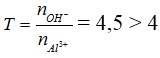
→ Tạo [Al(OH)4]- và OH- dư
Dung dịch X có
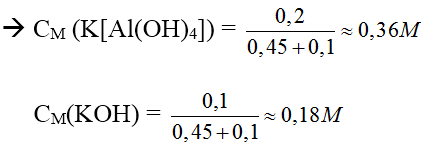
Bài 3: Cho m gam hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thấy thoát ra 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thì thấy thoát ra 8,96 lít khí (đktc). Tính khối lượng của Al và Fe trong hỗn hợp ban đầu.
Hướng dẫn:
Ta có: nH2(1) = 6,72/22,4 = 0,3(mol)
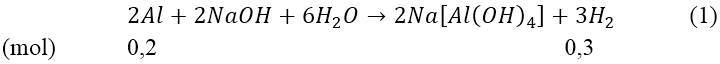
Từ (1) ⇒ nAl = 0,2(mol) ⇒ mAl = 0,2*27 = 5,4 (gam)
Mà nH2(2)(3) = 8,96/22,4 = 0,4(mol)
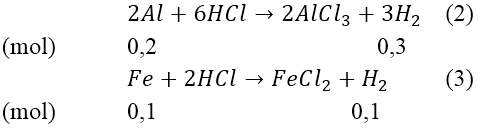
Từ (2) và (3) suy ra: mFe = 0,1*56 = 5,6(gam)
b) Bài toán ngược
Đặc điểm: Biết số mol của 1 trong 2 chất tham gia phản ứng và số mol kết tủa. Yêu cầu tính số mol của chất tham gia phản ứng còn lại.
* Kiểu 1: Biết số mol Al(OH)3, số mol Al3+ . Tính lượng OH-.
Phương pháp:
- Nếu số mol Al(OH)3 = số mol Al3+: cả 2 chất phản ứng vừa đủ với nhau tạo Al(OH)3. Khi đó:
- Nếu nAl(OH)3 < nAl3+ thì có 2 trường hợp:
+) Chưa có hiện tượng hoà tan kết tủa hay Al3+ còn dư. Khi đó sản phẩm chỉ có Al(OH)3 và .
+) Có hiện tượng hoà tan kết tủa hay Al3+ hết. Khi đó sản phẩm có Al(OH)3 và [Al(OH)4]- :
Ta có:
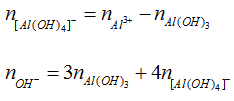
Ví dụ minh họa
Bài 1: Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lít của dung dịch NaOH. Biết các phản ứng xảy ra hoàn toàn.
Hướng dẫn:
Số mol Al3+ = 0,12 mol.
Số mol Al(OH)2 = 0,02 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,02 = 0,06 mol.
→ CM(NaOH) = 0,12M
+ TH2: Al3+ hết → tạo
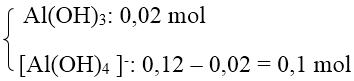
→ Số mol OH- = 3 . 0,02 + 4 . 0,1 = 0,46 mol
→ CM(NaOH) = 0,92M
* Kiểu 2: Biết số mol OH-, số mol kết tủa Al(OH)3. Tính số mol Al3+.
Phương pháp: mol OH- của bài cho với số mol OH- trong kết tủa.
+ Nếu số mol OH- của bài cho lớn hơn số mol OH- trong kết tủa thì đã có hiện tượng hoà tan kết tủa.
Sản phẩm của bài có Al(OH)3 và [Al(OH)4]-
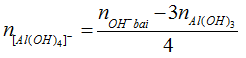
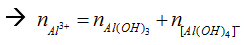
+ Nếu trong bài có nhiều lần thêm OH- liên tiếp thì bỏ qua các giai đoạn trung gian, ta chỉ tính tổng số mol OH- qua các lần thêm vào rồi so sánh với lượng OH- trong kết tủa thu được ở lần cuối cùng của bài.
Ví dụ minh họa
Bài 2: Thêm 0,6 mol NaOH vào dd chứa x mol AlCl3 thu được 0,2 mol Al(OH)3. Thêm tiếp 0,9 mol NaOH thấy số mol của Al(OH)3 là 0,5. Thêm tiếp 1,2 mol NaOH nữa thấy số mol Al(OH)3 vẫn là 0,5 mol. Tính x?
Hướng dẫn:
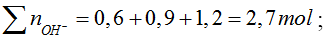
nAl(OH)3 = 0,5
Số mol OH- trong kết tủa là 1,5 mol < 2,7 mol → có tạo [Al(OH)4]-
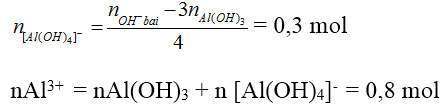
* Kiểu 3: Nếu cho cùng một lượng Al3+ tác dụng với lượng OH- khác nhau mà lượng kết tủa không thay đổi hoặc thay đổi không tương ứng với sự thay đổi OH-, chẳng hạn như:
TN1: a mol Al3+ tác dụng với b mol OH- tạo x mol kết tủa.
TN2: a mol Al3+ tác dụng với 3b mol OH- tạo x mol kết tủa hoặc 2x mol kết tủa.
Khi đó, ta kết luận:
TN1: Al3+ còn dư và OH- hết. nAl(OH)3 = nOH-/3 = x.
TN2: Cả Al3+ và OH- đều hết và đã có hiện tượng hoà tan kết tủa.
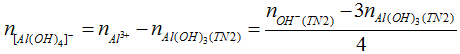
Ví dụ minh họa
Bài 3: TN1: Cho a mol Al2(SO4)3 tác dụng với 500ml dung dịch NaOH 1,2M được m gam kết tủa.
TN2: Cũng a mol Al2(SO4)3 tác dụng với 750ml dung dịch NaOH 1,2M thu được m gam kết tủa. Tính a và m?
Hướng dẫn:
Vì lượng OH- ở 2 thí nghiệm khác nhau mà lượng kết tủa không thay đổi nên:
TN1: Al3+ dư, OH- hết.
Số mol OH- = 0,6 mol → nAl(OH)3 = nOH-/3 = 0,2 mol → m = 15,6 g
TN2: Al3+ và OH- đều hết và có hiện tượng hoà tan kết tủa.
Số mol OH- = 0,9 mol → Tạo
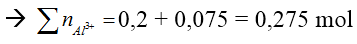
Số mol Al2(SO4)3 = 0,1375 mol = a.
B. Bài tập trắc nghiệm
Bài 1: Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
A. 2,65l B. 2,24l C. 1,12l D. 3,2 l
Lời giải:
Đáp án: A
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+ TH2: Al3+ hết → tạo
→ Số mol OH- = 3 . 0,3 + 4 . 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax.
Bài 2: Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng.
A. 0,8M B. 1,2M C. 1M D. 0,75M
Lời giải:
Đáp án: C
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
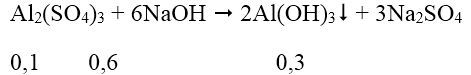
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4] = 0,2/(0,15 + 0,1) = 0,8M
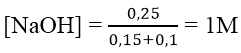
Bài 3: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2 B. 0,15 C. 0,1 D. 0,05
Lời giải:
Đáp án: C
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+ = 2.0,1 = 0,2 mol
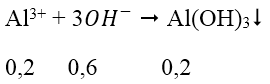
→ nOH- dư = 0,7 - 0,6 = 0,1 mol
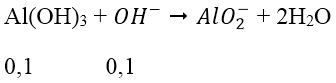
→ nAl(OH)3 còn = 0,2 - 0,1 = 0,1 mol
Bài 4: Cho 100ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55g. Tính nồng độ dung dịch NaOH ban đầu.
A. 0,75 M B. 1,75M C. 1M D. 1,25M
Lời giải:
Đáp án: B
Số mol AlCl3 là nAlCl3 = 0,1.1 = 0,1 (mol)
Số mol Al2O3 là nAl2O3 = 2,55/102 = 0,025 (mol)
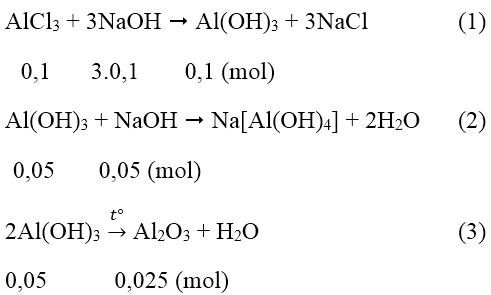
Theo pt (3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
Nồng độ mol/l CM(NaOH) = 0,35/0,2 = 1,75M
Bài 5: Cho V lít dung dịch Ba(OH)2 0,5M vào 200 ml dung dịch Al(NO3)3 0,75M thu được 7,8 g kết tủa. Vậy V có giá trị là:
A. 0,3 và 0,6 B. 0,3 và 0,7 C. 0,4 và 0,8 D. 0,3 và 0,5
Lời giải:
Đáp án: D
nBa(OH)2 = 0,5V → nOH- = 1V (mol)
nAl3+ = nAl(NO3)3 = 0,75.0,2 = 0,15 (mol)
nAl(OH)3 = 7,8/78 = 0,1 mol
Trường hợp 1: lượng OH- chỉ đủ tạo 0,1 mol kết tủa:
nOH- = 3.nAl(OH)3 = 0,3 mol
V = 0,3 (l)
Trường hợp 2: lượng OH- dư, hòa tan một phần kết tủa
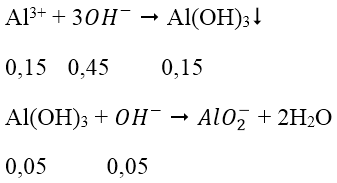
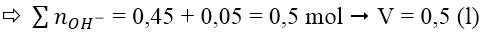
* Cách khác áp dụng nhanh công thức cho 2 trường hợp:
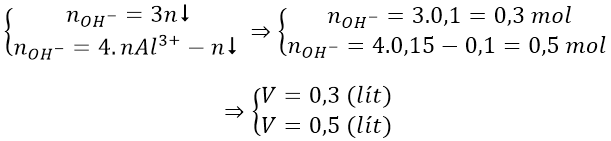
Bài 6: Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
A. 0,22l B. 0.2l C. 0,15l D. 0,12l
Lời giải:
Đáp án: A
Số mol Al = 0,81/27 = 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
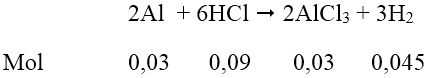
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
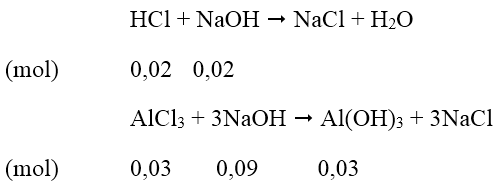
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (lít)
Bài 7: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
A. 1,2 B. 1,8 C. 2,4 D. 2
Lời giải:
Đáp án: D
Ta có: nAlCl3 = 1,5.0,2 = 0,3 mol; nAl(OH)3 = 15,6/78 = 0,2 mol
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại, bị NaOH hòa tan 1 phần còn 15,6 (g).
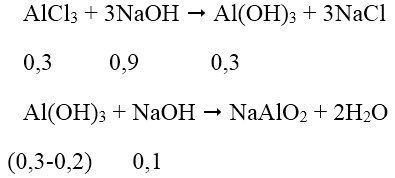
Theo phương trình phản ứng, ta có: nNaOH = 0,9 + 0,1 = 1 mol
→ VNaOH = 1/0,5 = 2 lít
Bài 8: Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1: 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 10,8 B. 5,4 C. 7,8 D. 43,2
Lời giải:
Đáp án: B
Ta có: nH2 = 0,896/22,4 = 0,04 mol
Gọi: nAl = x mol → nAl = 2x mol
Phản ứng:
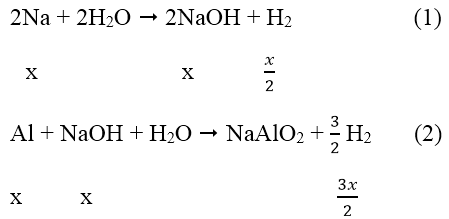
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
→ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
→ mAl = 0,2.27 = 5,4 (g)