Cách giải bài tập về Phương pháp điều chế Sắt (Fe) và hợp chất hay, chi tiết - Hoá học lớp 12
Cách giải bài tập về Phương pháp điều chế Sắt (Fe) và hợp chất hay, chi tiết
Với Cách giải bài tập về Phương pháp điều chế Sắt (Fe) và hợp chất hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Phương pháp điều chế Sắt (Fe) và hợp chất từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

I. Phương pháp
1. Sắt
Trong tự nhiên, sắt tồn tại dưới dạng quặng:
+ Quặng hematit đỏ (chứa Fe2O3 khan)
+ Quặng hematit nâu (chứa Fe2O3.nH2O)
+ Quặng manhetit (chứa Fe3O4) là quặng giàu sắt nhất.
+ Quặng xiđerit chứa FeCO3
+ Quặng pirit chứa FeS2
2. Sắt (II) oxit (FeO)
Chất rắn màu đen, không có trong tự nhiên. Có thể điều chế FeO bằng phương pháp phân hủy hợp chất không bền của sắt (II) hiđroxit ở nhiệt độ cao, không có không khí.
Fe(OH)2 →t o FeO + H2O
Khi nung nóng trong không khí thì tạo ra oxit sắt (II)
2Fe(OH)3 + ½O2 →t o Fe2O3 + 2H2O
Hợp chất Fe (II) có thể đóng vai trò là chất oxi hóa trong một số trường hợp. Thí dụ: Muối Fe (II) tác dụng với kim loại, FeO tác dụng với nhôm ở nhiệt độ cao …
3. Sắt (III) oxit Fe2O3
Là chất rắn, màu nâu đỏ.
Có thể điều chế Fe2O3 bằng phương pháp phân hủy Fe(OH)3 ở nhiệt độ cao.
2Fe(OH)2 →t o Fe2O3 + 3H2O
4. Sắt (II) hiđroxit (Fe(OH)2)
Chất rắn màu lục nhạt, không tan trong nước. Fe(OH)2 được điều chế bằng phản ứng trao đổi ion giữa dung dịch muối sắt (II) và dung dịch kiềm.
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
5. Sắt (III) hiđroxit Fe(OH)3
Là chất rắn màu nâu đỏ, không tan trong nước. Fe(OH)3 được điều chế bằng phản ứng trao đổi ion giữa dung dịch muối sắt (III) với dung dịch kiềm.
Fe3+ + 3OH- → Fe(OH)3
II. Câu hỏi
Câu 1: Phản ứng nào sau đây không tạo ra FeSO4?
A. Cho Fe tác dụng với dung dịch H2SO4.
B. Cho Fe tác dụng với dung dịch Fe2(SO4)3.
C. Cho Cu tác dụng với dung dịch Fe2(SO4)3.
D. Cho Fe tác dụng với dung dịch H2SO4 đặc nóng.
Lời giải:
Chọn đáp án: D
Giải thích: 2Fe + 6H2SO4 đặc →t o Fe2(SO4)3 + 3SO2 + 6H2O
Câu 2: Điều chế Fe trong công nghiệp bằng cách:
A. Cho Mg tác dụng với dung dịch FeCl2.
B. Khử Fe2O3 bằng Al ở nhiệt độ cao.
C. Khử Fe2O3 bằng CO ở nhiệt độ cao.
D. Điện phân dung dịch FeCl2.
Lời giải:
Chọn đáp án: C
Câu 3: Nung FeCO3 trong không khí đến khối lượng không đổi được chất rắn X. X là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe.
Lời giải:
Chọn đáp án: B
Giải thích: 2FeCO3 + ½O2 →t o Fe2O3 + 2CO2
Câu 4: Phản ứng nào sau đây sai?
A. 2Fe + 6H2SO4 đặc, nguội → Fe2(SO4)3 + 3SO2 + 6H2O
B. Fe + H2O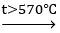
C. 3Fe + 4H2O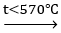
D. 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3.
Lời giải:
Chọn đáp án: A
Giải thích: Fe bị thụ động hóa trong H2SO4 đặch nguội.
Câu 5: Loại quặng nào sau đây không chứa sắt?
A. Quặng manhetit.
B. Quặng xiđerit và quặng pirit.
C. Quặng hematit đỏ và hematit nâu.
D. Quặng sinvinit.
Lời giải:
Chọn đáp án: D
Giải thích: Quặng sinvinit: KCl. NaCl

