150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết (nâng cao) - Hoá học lớp 12
150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết (nâng cao)
Với 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết (nâng cao) Hoá học lớp 12 tổng hợp 150 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Crom, Sắt, Đồng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Câu 1. Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là:
A. 2,80. B. 3,36.
C. 3,08. D. 4,48.
Lời giải:
Fe + S ⇒ M: Fe, S, FeS -+ HCl→ Fe2+, X: H2S, H2; G: S -+ O2→ H2O, SO2
Có 3 chất thay đổi số oxi hóa là Fe, S và Oxi
Bảo toàn e: 4nO2 = 2nFe + 4nSO2 = 2. 0,1 + 4. 0,75 = 0,5 mol
⇒ nO2 = 0,125 mol ⇒ V = 2,8lít
→ Đáp án A
Câu 2. Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là:
A. Fe3O4
B. Fe2O3
C. FeO
D. FeO hoặc Fe2O3.
Lời giải:
25,52 gam FexOy + 0,44 mol H2SO4.
Giả sử oxit sắt gồm FeO a mol và Fe2O3 b mol.
FeO + H2SO4 → FeSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Lập hpt

→ Oxit sắt là Fe3O4 (Fe3O4 = FeO.Fe2O3)
→ Đáp án A
Câu 3. Hỗn hợp bột X gồm Cu, Zn. Đốt cháy hoàn toàn m gam X trong oxi (dư), thu được 40,3 gam hỗn hợp gồm CuO và ZnO. Mặt khác, nếu cho 0,25 mol X phản ứng với một lượng dư dung dịch KOH loãng nóng, thì thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Cu trong X là:
A. 19,81%. B. 29,72%.
C. 39,63%. D. 59,44%.
Lời giải:
nZn = nH2 = 0,15 ⇒ nCu = 0,1 mol
⇒ %Cu = 0,1. 64 /(0,1. 64 + 0,15. 65) = 39,63%
→ Đáp án C
Câu 4. Cho m (g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (dktc). Giá trị của m là:
A. 70 B. 56
C. 84 D. 112
Lời giải:
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN (trong HNO3) = nN trong Fe(NO3)2 + nN trong NO, NO2
Hay: 1,28 = 2. nFe(NO3)2 + 0,38
⇒ nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy: mFe = 0,5.56 = m - 0,75m → m = 112 (g)
→ Đáp án D
Câu 5. Cho 0,1 mol FeCl3 vào dung dịch Na2CO3 có dư, độ giảm khối lượng dung dịch là:
A. 6,6 gam B. 14,6 gam
C. 17,3 gam D. 10,7 gam
Lời giải:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
nFe(OH)3 = 0,1 mol; nCO2 = 0,1 x 3/2 = 0,15 mol.
Độ giảm khối lượng dung dịch = mFe(OH)3 + mCO2 = 0,1 x 107 + 0,15 x 44 = 17,3 gam
→ Đáp án C
Câu 6. Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Lời giải:
Phương trình phản ứng:
Fe (a) + CuSO4 → FeSO4 + Cu (a)
mtăng = (64 - 56).a = 1 ⇒ a = 0,125 mol
nFe = 0,125 ⇒ nCu = (15 - 56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
%mFe = [(0,125x56)/15] x 100% = 46,67% ⇒ %mCu = 53,33%
→ Đáp án B
Câu 7. Cho 0,01 mol Fe vào 50ml dung dịch AgNO3 1M khi phản ứng kết thúc khối lượng AgNO3 thu được là:
A. 3,6 B. 3,24
C. 2,16 D. 1,08
Lời giải:
nAg+ = 0,05. 1 = 0,05 mol
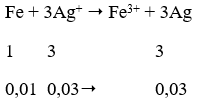
⇒ nAg+ dư ⇒ nAg = 0,03 mol
⇒ mAg = 3,24g
→ Đáp án B
Câu 8. Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
A. 9,75 B. 8,75
C. 7,80 D. 6,50
Lời giải:
Xem Fe3O4 là FeO.Fe2O3
Ta có: nFeCl2 = 7,62/127 = 0,06 (mol)
FeO (0,06) + 2HCl → FeCl2 (0,06) + H2O
nFe2O3 = (9,12 - 0,06.72)/160 = 0,03 mol
Fe2O3 (0,03) + 6HCl → 2FeCl3 (0,06) + 3H2O
mFeCl3 = 0,06. 162,5 = 9,75 (g)
→ Đáp án A
Câu 9. Cho luồng khí CO đi qua ống sứ đựng m gam Fe2O3 ở nhiệt độ cao một thời gian, người ta thu được 6,72 gam hỗn hợp gồm 4 chất rắn khác nhau. Đem hòa tan hoàn toàn hỗn hợp rắn này vào dung dịch HNO3 dư tạo thành 0,448 lít khí NO (đktc). Giá trị của m là
A. 8,2 B. 8
C. 7,2 D. 6,8
Lời giải:
CO + m gam Fe2O3 -to→ 6,72 gam hỗn hợp gồm 4 chất rắn khác nhau.
m gam hỗn hợp + HNO3 dư → 0,02 mol NO.
Bản chất của phản ứng là quá trình nhường nhận electron:
C+2 → C+4 + 2e
N+5 + 3e → N+2
Theo bảo toàn electron 2 x nCO = 3 x nNO → nCO = 3 x 0,02: 2 = 0,03 mol.
CO + Fe2O3 → 6,72 gam hỗn hợp + CO2
nCO2 = nCO = 0,03 mol.
Theo bảo toàn khối lượng:
mFe2O3 = mhỗn hợp + mCO2 - mCO = 6,72 + 0,03 x 44 - 0,03 x 28 = 7,2 gam
→ Đáp án C
Câu 10. Ngâm một kim loại có khối lượng 50 gam trong dung dịch HCl, sau một thời gian thu dược 4,368 lit khí H2 (đktc) và khối lượng kim loại giảm 3,51 gam. Kim loại đã dùng là:
A. Mg B. Al
C. Cu D. Zn
Lời giải:
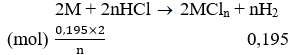
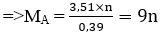
Bảng biện luận:
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
Vậy kim loại M là nhôm (Al)
→ Đáp án B
Câu 11. Cho bột Cu dư vào 2 cốc đựng V1 (lít) dung dịch HNO3 4M và V2 (lít) dung dịch hỗn hợp HNO3 3M và H2SO4 1M đều thu được V lít (đktc) khí NO duy nhất thoát ra. Mối quan hệ giữa V1 và V2 là
A. V1 = 1,40V2
B. V1 = 0,8V2
C. V1 = 0,75V2
D. V1 = 1,25V2
Lời giải:
nH+ (1) = nH+(2) ⇒ 4V1 = V2 (3 + 1.2) ⇒ V1 = 1,25V2
→ Đáp án D
Câu 12. Cho 16,8 gam bột sắt vào V lít dung dịch HNO3 0,5 M thu được 8,4 gam kim loại dư . Tính thể tích khí thu được .
A. 2,24l B. 1,12l
C. 3,36l D. 4,48l
Lời giải:
nFe phản ứng = (16,8 – 8,4)/56 = 0,15 mol
Vì kim loại dư nên chỉ tạo thành muối sắt II
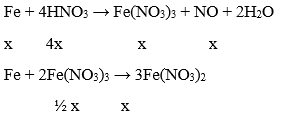
→ Tổng số mol Fe phản ứng: 3/2x = 0,15 → x = 0,1 mol
→ Thể tích khí thu được: 2,24 lít
→ Đáp án A
Câu 13. Hòa tan hết m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 bằng HNO3 đặc nóng thu được 4,48 lít khí NO (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan. Giá trị của m là
A. 46,4 gam B. 52,8 gam
C. 43,2 gam D. 48,0 gam
Lời giải:
X(FeO, Fe2O3, Fe3O4) -+HNO3→ 0,2 mol NO + Fe(NO3)3
Khối lượng muối thu được chỉ chứa Fe(NO3)3 → nFe(NO3)3 = 145,2: 242 = 0,6 mol
Coi hỗn hợp X chứa Fe: 0,6 mol và O: x mol
Bảo toàn electron: 0,6 x 3 = 2x + 0,2 x 3 → x = 0,6 mol
→ m = mFe + mO = 0,6 x 56 + 0,6 x 16 = 43,2 gam
→ Đáp án C
Câu 14. Hòa tan m(g) hỗn hợp Fe và Cu, trong đó Fe chiếm 40% khối lượng bằng dung dịch HNO3 thu được dung dịch X; 0,448 lít NO duy nhất (đktc) và còn lại 0,65m (g) kim loại. Khối lượng muối trong dung dịch X là:
A. 5,4g B. 6,4g
C. 11,2g D. 4,8g
Lời giải:
Ta có: mFe = 40%. m = 0,4m (g) → mCu = m - 0,4m = 0,6m (g)
Sau phản ứng còn 0,65m (g) kim loại > mCu = 0,6m (g)
→ Khối lượng Fe còn dư: 0,65m - 0,6m = 0,05m (g)
Vậy: mFe phản ứng = 0,4m - 0,05m = 0,35m (g)
Do Fe còn dư sau phản ứng nên tạo thành muối Fe2+.
- Quá trình nhường electron:
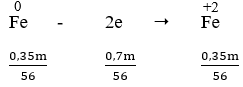
- Quá trình nhận electron:
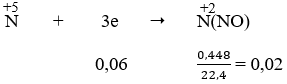
Áp dụng định luật bảo toàn electron, ta có:
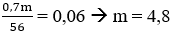
Ta có:
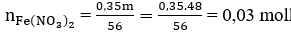
⇒ mFe(NO3)2 = 0,03. 180 = 5,4 (g)
→ Đáp án A
Câu 15. Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x: y = 2: 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hòa tan là:
A. 3x B. y
C. 2x D. 2y
Lời giải:
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
∗ Trường Hợp 1: H2SO4 loãng:
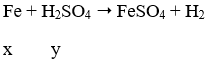
⇒ loại vì x = y
∗ Trường Hợp 2: H2SO4 đặc nóng
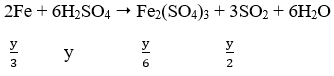
Ta có:
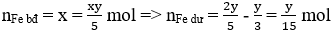
Do Fe dư nên tiếp tục xảy ra phản ứng:
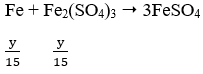
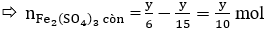
Vậy Fe hết
Cuối cùng: Fe → Fe2+ nên ta có:
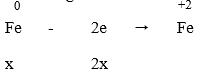
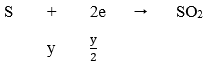
Áp dụng định luật bảo toàn electron ta có: 2x = y
→ Đáp án B
Câu 16. Khử m gam Fe3O4 bằng khí H2 thu được hỗn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 23,2 gam B. 34,8 gam
C. 11,6 gam D. 46,4 gam
Lời giải:
m gam Fe3O4 + H2 → hỗn hợp X gồm Fe, FeO.
hỗn hợp X + 0,6 mol H2SO4.
Ta có Fe + 2H+ → Fe2+ + H2↑; FeO + 2H+ → Fe2+ + H2O
nFe + nFeO = nH+: 2 = 0,6 x 2: 2 = 0,6 mol → nFe3O4 = 1/3 x (nFe + nFeO) = 1/3 x 0,6 = 0,2 mol
→ mFe3O4 = 0,2 x 232 = 46,4 gam
→ Đáp án D
Câu 17. Hoà tan 3,24 gam Ag bằng V ml dung dịch HNO3 0,7M thu được khí NO duy nhất và V ml dung dịch X trong đó nồng độ mol của HNO3 dư bằng nồng độ mol của AgNO3. Giá trị của V là:
A. 50 B. 100
C. 80 D. 75
Lời giải:
0,03 mol Ag + V ml AgNO3 0,7M → NO↑
CM AgNO3 = CM HNO3 dư
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
nHNO3 phản ứng = 0,03: 3 x 4 = 0,04 mol.
Vì V không thay đổi nên nHNO3 dư = nAgNO3 = 0,03 mol
→ ∑nHNO3 = 0,04 + 0,03 = 0,07 mol
→ VHNO3 = 0,07: 0,7 = 0,1 lít = 100 ml
→ Đáp án B
Câu 18. Cho 19,2 gam một kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất No (đktc). Kim loại M là kim loại nào sau đây:
A. Mg B. Cu
C. Fe D. Zn
Lời giải:
Số mol NO là nNO = 4,48/22,4 = 0,2 mol
3M (0,6/n) + 4nHNO3 → 3M(NO3)n + nNO (0,2) + 2nH2O
M = 19,2:(0,6/n) = 32n → n = 2; M = 64 → M: Cu
→ Đáp án B
Câu 19. Cho 23,52 gam hỗn hợp X gồm Mg, Fe, Cu vào 200ml dung dịch HNO3 3,4M. Khuấy đều thấy thoát ra khí NO (sản phẩm khử duy nhất), trong dung dịch còn dư một kim loại chưa tan hết; đổ tiếp từ từ dung dịch Y (H2SO4 5M) vào, chất khí trên lại thoát ra cho đến khi kim loại vừa tan hết thì cần vừa hết 44ml, thu được dung dịch Y. Lấy 1/2 dung dịch Y, cho dung dịch NaOH dư vào, lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi được chất rắn Z nặng 15,6 gam. Số mol Fe có trong hỗn hợp X là
A. 0,06. B. 0,12.
C. 0,24. D. 0,36.
Lời giải:
nMg = a; nFe = b; nCu = c
⇒ mX = 24a + 56b + 64c = 23,52 (1)
nH+ = 0,2. 3,4 + 0,044. 5. 2 = 1,12
Do lần đầu, 1 kim loại dư nên Cu sẽ dư, dung dịch Y có: Mg2+, Cu2+, Fe2+
Ở lần hai, khi thêm H2SO4, do Cu có tính khử mạnh hơn Fe2+ nên khi Cu tan hết thì Fe2+ vẫn không phản ứng nên dung dịch Y cuối cùng sẽ có: Mg2+, Cu2+, Fe2+
nH+ = 8/3 nMg2+ + 8/3 nFe2+ + 8/3 nCu2+ ⇒ 8/3 a + 8/3 b + 8/3 c = 1,12 (2)
mOxit = mMgO + mFe2O3 + mCuO ⇒ 40a + 80b + 80c = 15,6. 2 = 31,2 (3)
Từ (1), (2), (3) ⇒ a = 0,06; b = 0,12 ; c = 0,24 ⇒ nFe = 0,12 mol.
→ Đáp án B
Câu 20. Dung dịch X có 0,1 mol Fe2(SO4)3, 0,1 mol FeSO4 và 0,1 mol CuSO4. Cho khí H2S lội qua dung dịch X đến dư thì thu được m gam kết tủa. Giá trị của m là
A. 30,4 B. 39,2
C. 12,8 D. 16,0
Lời giải:
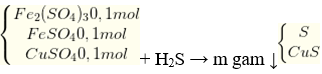
nCuS = 0,1 mol;
Theo bảo toàn electron: 2 x nS = 1 x nFe3+ → nS = 0,1 x 2: 2 = 0,1 mol.
→ m↓ = mS + mCuS = 0,1 x 32 + 0,1 x 96 = 12,8 gam
→ Đáp án C
Câu 21. Nhiệt phân hoàn toàn hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 được hỗn hợp khí có M = 42,5 đvC. Tỉ số x/y là:
A. 1 B. 3
C. 2 D. 4
Lời giải:
Tổng số NO2 và O2 thu được
nNO2 = x + 2y
nO2 = 0,5x + 0,5y
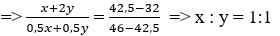
→ Đáp án A
Câu 22. Hòa tan 1 gam một mẫu quặng chứa Au vào hỗn hợp cường thủy có dư, sau khi vàng hòa tan hoàn toàn thấy tiêu tốn 0,002 mol HNO3. Khối lượng Zn tối thiểu cần dùng để thu hồi lượng Au từ dung dịch thu được là:
A. 0,195 gam. B. 0,065 gam.
C. 0,130 gam. D. 0,65 gam.
Lời giải:
• Bản chất của phản ứng là quá trình oxi hóa, khử:
N+5 + 3e → N+2
Zn → Zn+2 + 2e
Au + nước cường toan thì N trong HNO3 chuyển hết về NO → nNO = 0,002 mol.
Theo bảo toàn e: 3 x nNO = 2 x nZn → nZn = 0,002 x 3/2 = 0,003 mol
→ mZn = 0,003 x 65 = 0,195 gam
→ Đáp án A
Câu 23. X là hỗn hợp gồm Fe và hai oxit của sắt. Hòa tan hết 15,12 gam X trong dung dịch HCl dư, sau phản ứng thu được 16,51 gam muối Fe (II) và m gam muối Fe (III). Mặt khác, khi cho 15,12 gam X phản ứng hoàn toàn với dung dịch acid nitric loãng dư thì giải phóng 1,568 lít NO (sản phẩm khử duy nhất, đo ở đktc). Thành phần % về khối lượng của Fe trong X là ?
A. 11,11%. B. 29,63%.
C. 14,81%. D. 33,33%.
Lời giải:
Có hỗn hợp X gồm Fe và O với số mol lần lượt là a, b(mol)
⇒ mX = 56a + 16b = 15,12
BT e: 3nFe = 2nO + 3nNO ⇒ 3a = 2b + 3. 0,07
⇒ a = b = 0,21
nFeCl2 = 16,51/127 = 0,13 ⇒ nFeCl3 = 0,21 - 0,13 = 0,08 mol
nH+ = nCl- = 0,13. 2 + 0,08. 3 = 0,5 mol
nH+ = 2nO + 2nH2 ⇒ nH2 = (0,5 – 0,21. 2)/2 = 0,04 mol
nFe = nH2 = 0,04 mol
%Fe = (0,04. 56)/15,12 = 14,81%
→ Đáp án C
Câu 24. Hòa tan hoàn toàn hỗn hợp X (gồm x mol Fe, y mol Cu, z mol Fe2O3 và t mol Fe3O4) trong dung dịch HCl không thấy có khí bay ra khỏi bình, dung dịch thu được chỉ chứa 2 muối. Mối quan hệ giữa số mol các chất có trong hỗn hợp X là
A. x + y = z + t
B. x + y = 2z + 3t
C. x + y = 2z + t
D. x + y = 2z + 2t
Lời giải:
Hỗn hợp X gồm:
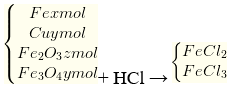
• Sau phản ứng không có khí thoát ra → Fe, Cu phản ứng hết với Fe3+
Theo bảo toàn electron ta có 2 x nFe + 2 x nCu = 1 x nFe3+ (Fe2O3) + 1 x nFe+3 (Fe3O4)
→ 2x + 2y = 2z + 2t → x + y = z + t → Đáp án đúng là đáp án A.
Chú ý: Có thể xác định số mol Fe3+ trong Fe3O4 bằng phương trình
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O.
→ Đáp án A
Câu 25. Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
A. 600ml B. 200ml
C. 800ml D. 400ml
Lời giải:
Theo ĐL bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) → nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
O2- (0,4) + 2H+ (0,8) → H2O
VHCl = 0,8: 2 = 0,4 (lít) = 400ml
→ Đáp án D
Câu 26. Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
A. 2,24 B. 5,60
C. 3,36 D .4,48
Lời giải:
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64x = 12 ⇒ x = 0,1 mol
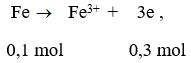
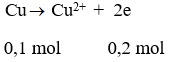
Mặt khác: dx/H2 = 19 ⇒ MX = 38
Đặt x, y là số mol của NO và NO2 thì 30x + 46y = 38(x + y) ⇒ x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 ⇒ 4x = 0,5 . Vậy x = 0,125 mol
V = 0,125. 2. 22,4 = 5,6 lít
→ Đáp án B
Câu 27. Khi hoà tan hoàn toàn 0,05 mol Au bằng nước cường toan thì số mol HCl phản ứng và số mol NO sản phẩm khử duy nhất lần lượt là:
A. 0,05 và 0,02.
B. 0,15 và 0,03.
C. 0,15 và 0,05.
D. 0,05 và 0,15.
Lời giải:
Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
⇒ nNO = 0,05 mol; nHCl = 3. 0,05 = 0,15 mol
→ Đáp án C
Câu 28. Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370. B. 220.
C. 500. D. 420.
Lời giải:
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a; nFe2(SO4)3 = b
⇒ 152a + 400b = 51,76
BT Fe: a + 2b = 0,145. 2 = 0,29 ⇒ a = 0,13 mol; b = 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3nFe2(SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒ b = (0,37.98)/0,098 = 370g
→ Đáp án A
Câu 29. Cho 5,36 gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn được dung dịch Y. Cô cạn Y được 3,81 gam FeCl2 và m gam FeCl3. Giá trị của m là
A. 6,5 B. 7,80
C. 2,4375 D. 4,875
Lời giải:
5,36 gam FeO, Fe2O3, Fe3O4 + HCldư → ddY.
Cô cạn Y → 0,03 mol FeCl2 và m gam FeCl3.
Coi hỗn hợp X gồm FeO và Fe2O3
nFeO = nFeCl2 = 0,03 → mFe3O4 = 5,36 - 0,03 x 72 = 3,2 gam → nFe2O3 = 3,2: 160 = 0,02 mol
→ nFeCl3 = 0,02 x 2 = 0,04 mol → mFeCl3 = 0,04 x 162,5 = 6,5 gam
→ Đáp án A
Câu 30. Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 11,2 gam B. 10,2 gam
C. 7,2 gam D. 6,9 gam
Lời giải:
Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hòa tan hỗn hợp X vào dung dịch HNO3 dư ta có:
Fe (0,1/3) + 6HNO3 → Fe(NO3)2 (0,1) + 3NO2 + 3H2O
⇒ Số mol nguyên tử Fe trong oxit Fe2O3 là
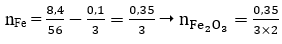
Vậy mX = mFe + mFe2O3
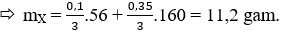
→ Đáp án A
Câu 31. Dẫn luồng khí CO dư qua ống đựng 0,03 mol oxit sắt, khí sau phản ứng cho vào dung dịch Ca(OH)2 dư thu được 12 g kết tủa. Vậy công thức của oxit sắt là:
A. Fe3O4 B. FeO
C. Fe2O3 D. Fe3O4 hoặc FeO
Lời giải:
Ta có: nCaCO3 = 12/100 = 0,12 mol
Xét sơ đồ sau:
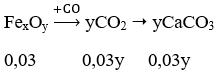
Ta có: 0,03y = 0,12 → y = 4
→ Đáp án A
Câu 32. Y là một hỗn hợp gồm sắt và hai oxit của nó. Chia Y làm hai phần bằng nhau:
Phần 1: Đem hòa tan hết trong dung dịch HCl dư thu được dung dịch Z chứa a gam FeCl2 và 13 gam FeCl3.
Phần 2: Cho tác dụng hết với 875 ml dung dịch HNO3 0,8M (vừa đủ) thu được 1,568 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của a là
A. 10,16. B. 16,51.
C. 11,43. D. 15,24.
Lời giải:
Bảo toàn N:
nNO3- = nHNO3 – nNO = 0,875. 0,8 – 0,07 = 0,63 ⇒ nFe(NO3)3 = 0,21 mol
nFeCl3 = 0,08 mol ⇒ nFeCl2 = 0,21 – 0,08 = 0,13 ⇒ mFeCl2 = 16,51g
→ Đáp án B
Câu 33. Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
A. 0,1M B. 0,15M
C. 0,12M D. 0,2M
Lời giải:
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol ⇒ nCuSO4 = 0,1 mol
Từ (1) ⇒ 0,1 mol Mg tác dụng với 0,1 mol CuSO4 sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng: 0,01.(64 – 24) = 0,4 (gam)
⇒ Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng: 0,52 – 0,4 = 0,12 g
Fe + CuSO4 → FeSO4 + Cu (2)
⇒ nCuSO4 (2) = (1 x 0,12)/8 = 0,015 (mol)
Vậy CM(CuSO4) = (0,01 + 0,015)/0,25 = 0,1 (mol/l)
→ Đáp án A
Câu 34. Cho 23,8 gam kim loại M tan hết trong dung dịch H2SO4 loãng tạo ra ion M2+. Dung dịch tạo thành có thể tác dụng vừa đủ với 200 ml dung dịch Fe2(SO4)3 1M để tạo ra ion M4+ và Fe2+. M là
A. Sn. B. Pb.
C. Au. D. Zn.
Lời giải:
Nhận thấy M có thể tan trong dung dịch H2SO4 loãng → Loại Au, Pb
Ion M2+ + Fe3+ → M4+ + Fe2+ → chỉ có đáp án A thỏa mãn .
Sn + H2SO4 → SnSO4 + H2
SnSO4 + Fe2(SO4)3 → Sn(SO4)2 + 2FeSO4.
→ Đáp án A
Câu 35. Nhúng một miếng đồng vào dung dịch chứa 100 ml AgNO3 0,3M. Sau một thời gian lấy miếng đồng ra thấy khối lượng tăng lên 1,52 gam. Vậy nồng độ của AgNO3 sau phản ứng là:
A. 0,1M B. 0,2M
C. 0,5M D. 0,04M
Lời giải:
số mol AgNO3 = 0,03 (mol)
Phương trình phản ứng:
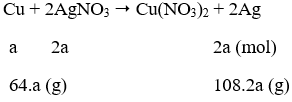
Ta có: 108.2a - 64a = 152a = 1,52 → a = 0,01 (mol)
Số mol AgNO3 còn lại = 0,03 - 2.a = 0,03 - 2.0,01 = 0,01 mol
Nồng độ AgNO3 = 0,01/0,1 = 0,1M
→ Đáp án A
Câu 36. Đốt cháy hoàn toàn hỗn hợp gồm FeS2 và Ag2S với số mol bằng nhau thu được 3,696 lít SO2 (đktc) và chất rắn B. Cho B tác dụng với dung dịch H2SO4 loãng dư, sau phản ứng hoàn toàn thấy còn lại m gam chất rắn không tan. Giá trị của m là:
A. 13,64 B. 11,88
C. 17,16 D. 8,91
Lời giải:
nFeS2 = nAg2S = 1/3 nSO2 = 0,055 mol
Chất rắn B gồm có Fe2O3 và Ag, cho qua H2SO4 thì chỉ còn lại Ag
⇒ m = 0,055. 2. 108 = 11,88
→ Đáp án B
Câu 37. Hoà tan một đinh thép có khối lượng 1,14 gam bằng dd H2SO4 loãng dư, phản ứng xong loại bỏ kết tủa, được dd X. Dd X làm mất màu 40 ml dd KMnO4 0,1M. Hàm lượng sắt nguyên chất có trong đinh thép là (Cho rằng trong đinh thép, chỉ có Fe tác dụng với H2SO4 loãng)
A. 98,1% B. 98,2%
C. 99,4% D. 99,5%.
Lời giải:
1,14 gam thép + H2SO4 dư → ddX gồm FeSO4, H2SO4 dư.
FeSO4 + 0,004 mol KMnO4
Theo bảo toàn electron 1 x nFeSO4 = 5 x nKMnO4 → nFeSO4 = 5 x 0,004 = 0,02 mol.
→ nFe = 0,02 mol → %Fe = 0,02 x 56: 1,14 ≈ 98,2%
→ Đáp án B
Câu 38. Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là:
A. 52,2 B. 48,4
C. 54,0 D. 58,0
Lời giải:
Ta có: nSO2 = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
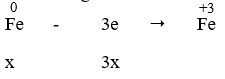
- Quá trình nhận electron:
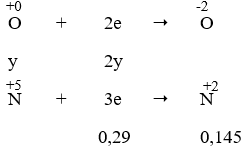
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,29 → 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) → x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
⇒ nFe2(SO4)3 = 1/2 nFe = 0,145 mol → mFe2(SO4)3= 0,145. 400 = 58 (g)
→ Đáp án D
Câu 39. Hòa tan hoàn toàn 11,15 gam hỗn hợp X gồm crom và thiếc vào dung dịch HCl dư thu được 3,36 lít H2 (đktc). Số mol O2 cần dùng để đốt cháy hoàn toàn 11,15 gam X là:
A. 0,10. B. 0,075.
C. 0,125. D. 0,15.
Lời giải:
Chú ý Cr, Sn tác dụng với HCl thì hình thành Cr2+, Sn2+ và khi tác dụng với Cr3+ và Sn4+
Gọi số mol Cr, Sn lần lượt là x, y
Ta có hệ
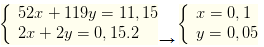
Bảo toàn electron → nO2= 0,125 mol.
→ Đáp án C
Câu 40. Hòa tan m gam hỗn hợp X gồm FeO, Fe(OH)2, FeCO3, Fe2O3, Fe3O4 có cùng số mol tác dụng với dung dịch H2SO4 loãng dư thu được 1,568 lít khí CO2 (đktc) và dung dịch Y. Dung dịch Y có thể làm mất màu bao nhiêu ml dung dịch KMnO4 1M ?
A. 112 ml B. 84 ml
C. 42 ml D. 56 ml
Lời giải:
m gam hỗn hợp X gồm
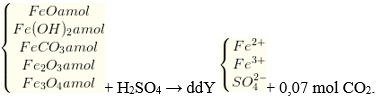
ddX + V ml KMnO4.
- nFeCO3 = a = 0,07 mol.
∑nFe2+ = 4a = 4 x 0,07 = 0,28 mol.
- ddY + KMnO4
Theo bảo toàn electron: 1 x nFe2+ = 5 x nKMnO4 → nKMnO4 = 0,28: 5 = 0,056 mol
→ VKMnO4 = 0,056: 1 = 0,056 lít = 56ml
→ Đáp án D
Câu 41. Cho hỗn hợp gồm a mol FeS2 và b mol Cu2S tác dụng vừa đủ với dung dịch HNO3 thì thu được dung dịch A (chứa 2 muối sunfat) và 0,8 mol khí NO là sản phẩm khử duy nhất. Tìm a và b là
A. a = 0,06; b = 0,03.
B. a = 0,12; b = 0,06.
C. a = 0,06; b = 0,12.
D. a = 0,03; b = 0,06.
Lời giải:
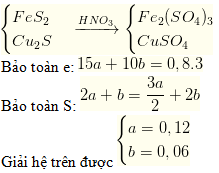
→ Đáp án B
Câu 42. Khi hòa tan hiđroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối trung hòa có nồng độ 27,21%. Kim loại M là:
A. Fe B. Zn
C. Cu D. Mg
Lời giải:
Giả sử đem 1 mol H2SO4 phản ứng, ta có:
mdung dich H2SO4 = (98/20)x100 = 490 (gam)
mdung dịch sau phản ứng = 490 + (M + 34) (gam)
M(OH)2 (1) + H2SO4 (1) → MSO4 (1 mol) + 2H2O
Theo đề bài ta có: (M + 96)/[490 + (M + 34)] = 0,2721 ⇒ M ≈ 64: đồng
→ Đáp án C
Câu 43. Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 B. 240
C. 400 D. 120
Lời giải:
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol; số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
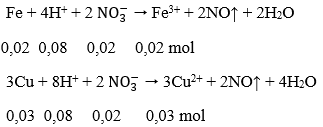
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH-.

Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol → V = 360ml
→ Đáp án A
Câu 44. Dung dịch X gồm FeCl2 và FeCl3 được chia làm hai phần bằng nhau:
Phần 1: Tác dụng với dung dịch NaOH dư ở ngoài không khí thu được 0,5 mol Fe(OH)3.
Phần 2: Tác dụng với dung dịch AgNO3 thu được 1,3 mol AgCl.
Tỉ lệ mol của FeCl2 và FeCl3 là:
A. 4:1 B. 3:2
C. 1:4 D. 2:3
Lời giải:
nFeCl2 = a, nFeCl3 = b
⇒ nFe(OH)3 = a + b = 0,5 mol
nAgCl = 2a + 3b = 1,3 mol ⇒ a = 0,2 mol; b = 0,3 mol ⇒ a:b= 2:3
→ Đáp án D
Câu 45. Hòa tan 120 gam một mẫu quặng chứa vàng vào lượng dư nước cường thủy. Kết thúc phản ứng có 0,015 mol HCl tham gia phản ứng. Thành phần % về khối lượng của vàng trong mẫu quặng trên là:
A. 0,82%. B. 1,23%.
C. 1,64%. D. 2,46%.
Lời giải:
Au + HNO3 + 3HCl → AuCl3 + NO + 2H2O
→ nAu = nHCl: 3 = 0,015: 3 = 0,005 mol
%Au = 0,005 x (197/120) x 100% = 0,082%.
→ Đáp án A
Câu 46. Cho 20 gam bột Fe vào dung dịch HNO3 và khuấy đến khi phản ứng xong thu V lít khí NO (đkc) và còn 3,2 gam kim loại. Giá trị của V là
A. 2,24 lít B. 4,48 lít
C. 6,72 lít D. 5,6 lít
Lời giải:
Fe còn dư nên dung dịch chỉ gồm Fe2+
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
mFe (pư) = 20 – 3,2 = 16,8g ⇒ nFe = 0,3 mol
Fe - 2e → Fe2+
N+5 + 3e → N+2 (NO)
BT e ⇒ 3nNO = 2nFe = 2.0,3 = 0,6 mol ⇒ nNO = 0,2 mol ⇒ V = 4,48l
→ Đáp án B
Câu 47. Hỗn hợp X gồm Ag, Fe, Cu. Ngâm X trong dd chỉ chứa một chất tan Y, khuấy kỹ để pư xảy ra hoàn toàn, thấy còn lại một kim loại có khối lượng không đổi so với ban đầu. Biết Y tạo kết tủa với dd BaCl2. Chất Y là
A. AgNO3. B. Fe2(SO4)3.
C. HCl. D. H2SO4.
Lời giải:
Nếu Y là AgNO3 thì thu được kim loại Ag sẽ có khối lượng lớn hơn khối lượng ban đầu
Nếu là Fe2(SO4)3 thì Fe, Cu tan, còn Ag không tan, có khối lượng không đổi
Nếu là HCl, H2SO4 thì cả Cu và Ag đều không tan nên sẽ thu được 2 kim loại
→ Đáp án B
Câu 48. Cho dung dịch KOH dư vào dung dịch FeCl2 thu được 13,5 gam kết tủa. Nếu thay dung dịch KOH bằng dung dịch AgNO3 dư thì thu lượng kết tủa là
A. 43,05 gam. B. 59,25 gam.
C. 53,85 gam. D. 48,45 gam.
Lời giải:
TN1: nFeCl2 = nFe(OH)2 = 13,5/127 = 0,15 mol
TN2: 3AgNO3 + FeCl2 → 2AgCl↓ + Fe(NO3)3 + Ag↓
mkết tủa = mAg + mAgCl = 0,15. 108 + 0,15. 2. 143,5 = 59,25 gam.
→ Đáp án B
Câu 49. Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72 B. 35,50
C. 49,09 D. 34,36
Lời giải:
Quy đổi hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 thành Fe và Fe2O3.
Fe (0,06) + 4HNO3 Fe(NO3)3 (0,06) + NO (0,06 mol) + 2H2O
nFe2O3 = (11,36 - 0,06.56)/160 = 0,05 mol
Fe2O3 (0,05) + 6HNO3 (0,1 mol) → 2Fe(NO3)3 + 3H2O
Vậy muối = (0,1 + 0,06). 242 = 38,72 (g)
→ Đáp án A
Câu 50. Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít hỗn hợp X gồm (NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối với hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 2,24l B. 5,6l
C. 4,48l D. 3,36l
Lời giải:
Ta có: Mx = 38 = (30 + 46)/2 là trung bình cộng nên nNO = nNO2
Có 56a + 64a = 12 ⇒ a = 0,1 mol ⇒ nFe = nCu = 0,1 mol
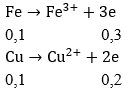
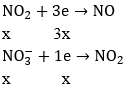
Áp dụng định luật bảo toàn electron: 4x = 0,5 ⇒ x = 0,125(mol)
Vậy: V = 0,125. 2. 22,4 = 5,6(lít)
→ Đáp án B
Câu 51. Nung nóng 16,8 gam hỗn hợp gồm Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là
A. 400 ml. B. 200 ml.
C. 800 ml. D. 600 ml.
Lời giải:
mO = 23,2 – 16,8 = 6,4g ⇒ nO = 0,4 mol
2H+ + O2- → H2O
⇒ nHCl = 2nO = 2. 0,4 = 0,8 mol ⇒ VHCl = 0,8/2 = 0,4l = 400ml
→ Đáp án A
Câu 52. Hoà tan a gam Fe vào dung dịch HCl thu được 2,24 lít khí (ở đktc) và dung dịch D. Cô cạn dung dịch D thu được m gam muối khan. Cho khối lượng muối trên vào 100ml dung dịch KMnO4 0,25M trong H2SO4, sau phản ứng hoàn toàn thu V lít khí (ở đktc). Giá trị V là:
A. 2,24. B. 0,28.
C. 1,4. D. 0,336.
Lời giải:
nFeCl2 = nH2 = 0,1mol; nKMnO4 = 0,025 mol
Fe2+ sẽ phản ứng trước với KMnO4/H+, mà thu được khí clo nên Fe2+ đã phản ứng hết, tiếp là Cl-
Bảo toàn e: nFe2+ + nCl- (pư) = 5. nMn+7 ⇒ nCl- (pư) = 0,025. 5 – 0,1 = 0,025
nFe2+ + nCl- (pư) = 5. nMn+7
⇒ nCl- (pư) = 0,025. 5 – 0,1 = 0,025 mol
⇒ nCl2 = 0,0125 mol ⇒ VCl2 = 0,28l
→ Đáp án B
Câu 53. Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dung dịch H2SO4 đặc nóng (dư), thu được 20,16 (lít) khí SO2 (sản phẩm khử duy nhất, ở đktc). Oxit MxOy là:
A. Cr2O3 B. FeO
C. Fe3O4 D. CrO
Lời giải:
Ta có: nCO = 0,8 mol; nSO2 = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron. H2SO4 đặc là chất oxi hóa nhận electron:
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
Tỉ lệ:
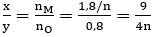
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3.
+ Nếu n = 2 → x: y = 9: 8 (loại vì không có đáp án phù hợp)
+ Nếu n = 3 → x: y = 3: 4
→ Đáp án C
Câu 54.Cho một đinh sắt lượng dư vào 200 ml dung dịch muối nitrat kim loại X có nồng độ 0,1M. Sau khi phản ứng xảy ra hoàn toàn, tất cả kim loại X tạo ra bám hết vào đinh sắt còn dư, thu được dung dịch D. Khối lượng dung dịch D giảm 0,16 gam so với dung dịch nitrat X lúc đầu. Kim loại X là
A. Đồng (Cu)
B. Thủy ngân (Hg)
C. Niken (Ni)
D. Bạc (Ag).
Lời giải:
Fe dư + 0,02 mol muối NO3- → ddD. Khối lượng dung dịch D giảm 0,16 gam so với dung dịch nitrat X lúc đầu.
nFe + 2M(NO3)n → nFe(NO3)2 + 2M
nFe = 0,02n/2 mol; nM = 0,02 mol.
Khối lượng dung dịch giảm 0,16 gam → mM - mFe phản ứng = 0,02MM - (0,02n/2) x 56 = 0,16
Biện luận → n = 2, MM = 64
→ Đáp án A
Câu 55. Cho 5,6 gam bột Fe tác dụng với 500 ml dung dịch AgNO3 0,5 M. Tính khối lượng muối thu được
A. 21,1g B. 10,55g
C. 42,2g D. 18g
Lời giải:
Fe (0,1) + 2AgNO3 (0,25) → Fe(NO3)2 + 2Ag
→ AgNO3 dư: 0,05 mol , Fe(NO3)2 tạo thành: 0,1 mol
Fe(NO3)2 (0,1) + AgNO3 (0,05) → Fe(NO3)3 + Ag
→ Fe(NO3)2 dư: 0,05 mol , Fe(NO3)3 tạo thành 0,05 mol
→ Tổng số mol Ag ở hai phản ứng: 0,25 mol → mAg = 0,25. 108 = 27 gam
Khối lượng muối: 0,05. 180 + 0,05. 242 = 21,1 gam
Chú ý phản ứng: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
Câu 56. X là hỗn hợp Fe3O4 và Fe2O3. Hòa tan m gam X trong dung dịch HCl dư được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 200ml dung dịch KI 0,5M được dung dịch Z và chất rắn E. Lọc tách E và sục khí Cl2 dư vào dung dịch Z được dung dịch F. Cho dung dịch F tác dụng với dung dịch NaOH dư được kết tủa G. Nung G đến khối lượng không đổi được (m + 0,24) gam chất rắn H. Tỉ lệ mol của Fe3O4 và Fe2O3 trong X là
A. 2: 3. B. 3: 2.
C. 1: 3. D. 3: 1.
Lời giải:
nFe3O4 = a mol, nFe2O3 = b mol
2Fe3+ + 2I- → 2Fe2+ + I2
⇒ nFe3+ = 0,1 ⇒ 2a + 2b = 0,1 ⇒ a + b = 0,05
mCRH = m + 0,24 g ⇒ 0,24g là khối lượng tăng do chuyển từ Fe3O4 thành Fe2O3 ⇒ 1,5a . 160 - 232a = 0,24 ⇒ 8a = 0,24 ⇒ 0,03 mol; b=0,02 mol
⇒ a: b = 3: 2
→ Đáp án B
Câu 57. Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
A. 10,5g B. 10,76g
C. 11,2g D. 12,8g
Lời giải:
Khối lượng AgNO3 = (250.4)/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
Cu (0,005) + 2AgNO3 (0,01) → Cu(NO3)2 + 2Ag (0,01 mol)
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
→ Đáp án B
Câu 58. Nhúng một thanh sắt vào dung dịch hỗn hợp chứa 0,03 mol AgNO3 và 0,04 mol Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng thanh sắt tăng m gam (coi toàn bộ kim loại sinh ra bám vào thanh sắt). Giá trị của m là
A. 1,44 B. 5,36
C. 2,72 D. 3,60
Lời giải:
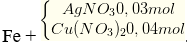
Khối lượng Fe tăng m gam.
Fe + 3Ag+ → Fe2+ + 2Ag↓
Fe + Cu2+ → Fe2+ + Cu↓
Ta có mFe tăng = mAg + mCu - mFe phản ứng = 0,03 x 108 + 0,04 x 64 - (0,015 + 0,04) x 56 = 2,72 gam
→ Đáp án C
Câu 59. Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hai giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là:
A. Cd B. Fe
C. Zn D. Cu
Lời giải:
Phương trình phản ứng:
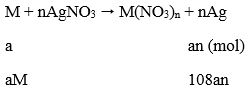
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)
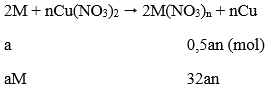
Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
→ Chon M = 32,5n
Khi n = 2 thì M = 65
Vậy M =Zn
→ Đáp án C
Câu 60. Cho m (g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí No, NO2 thoát ra ở (dktc). Giá trị của m là:
A. 70 B. 56
C. 84 D. 112
Lời giải:
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN (trong HNO3) = nN trong Fe(NO3)2 + nN trong NO, NO2
Hay: 1,28 = 2. nFe(NO3)2 + 0,38
nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy: mFe = 0,5.56 = m - 0,75m → m = 112 (g)
→ Đáp án D
Câu 61. Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch CuSO4 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch HNO3 2M biết phản ứng tạo ra NO.
A. 0,12l B. 0,15 l
C. 0,18l D. 0,2l
Lời giải:
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
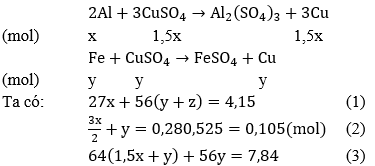
Phản ứng:
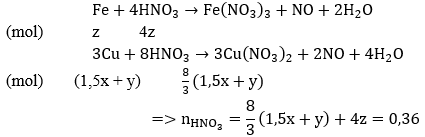
Vậy: VHNO3 = 0,36/2 = 0,18(lít)
→ Đáp án C
Câu 62. Hỗn hợp X gồm Cu và Fe có tỉ lệ khối lượng tương ứng là 7: 3. Lấy m gam X phản ứng hoàn toàn với dung dịch chứa 0,7 mol HNO3. Sau phản ứng còn lại 0,75m gam chất rắn và có 0,25 mol khí Y gồm NO và NO2. Giá trị của m là:
A. 40,5 B. 50,4
C. 50,2 D. 50
Lời giải:
Ta có: mFe = 3m/(3+7) = 0,3m (g); mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

- Quá trình nhận electron:
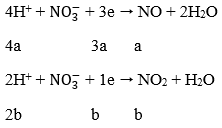
Áp dụng định luật bảo toàn electron:
0,25m/28 = 3a + b = 0,45 → m = 50,4
→ Đáp án B
Câu 63. Khử 4,8 gam một oxit của kim loại trong dãy điện hóa ở nhiệt độ cao cần 2,016 lít khí H2 đktc . Kim loại thu được đem hòa tan trong dung dịch HCl thu được 1,344 lít khí H2 đktc . Hãy xác định công thức hóa học của oxit đã dùng .
A. Fe2O3 B. MgO
C. Fe3O4 D. Al2O3
Lời giải:
Oxit chưa biết của kim loại nào → Gọi MxOy
MxOy (a) + yH2 (ay) → xM (ax) + yH2O
→ ay = 0,09 mol
2M (ax) + 2nHCl → 2MCln + nH2 (nax)
→ nax / 2 = 0,06 mol
Mà: 56ax + 16ay = 4,8
→ ax = 0,06
→ x: y = ax: ay = 0,06: 0,09 = 2: 3 ⇒ M2O3
→ n = 0,12: 0,06 = 2 ⇒ M hóa trị II
→ Chỉ có Fe thỏa mãn vì nó có hai hóa trị
Lưu ý: Bài toán này dễ nhầm lẫn nếu không để ý sự thay đổi hóa trị ở 2 phương trình.
Câu 64. Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là
A. 370. B. 220.
C. 500. D. 420.
Lời giải:
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x, nFe2(SO4)3 = y
→ mdd = 152x + 400y = 51,76
nFe = nFeSO4+2. nFe2(SO4)3 = x + 2y = 0,29
→ x = 0,13 mol, y = 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
→ b = 0,37.98/9,8% = 370g
→ Đáp án A
Câu 65. Hoà tan hoàn toàn 33,8 gam hỗn hợp gồm FeCl2 và NaF (có cùng số mol) vào một lượng nước dư, thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là:
A. 57,4 gam. B. 104,5 gam.
C. 82,8 gam. D. 79 gam.
Lời giải:
Trong 33,8gam hh FeCl2 và NaF đồng số mol: nFeCl2 = nNaF = 33,8/(127 + 42) = 0,2 mol
Cho dung dịch X vào AgNO3 dư:
FeCl2 + 2AgNO3 → 2AgCl + Fe(NO3)2
Fe(NO3)2 + AgNO3 → Ag + Fe(NO3)3
Ta có: nCR = AgCl + nAg = 0,2. 2. 143,5 + 0,2. 108 = 79g
→ Đáp án D
Câu 66. Hòa tan hoàn toàn 0,1 mol FeS2 trong 200 ml dung dịch HNO3 4M, sản phẩm thu được gồm dung dịch X và một chất khí thoát ra. Dung dịch X có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Giá trị của m là
A. 12,8. B. 6,4.
C. 9,6. D. 3,2.
Lời giải:
0,1 mol FeS2 + 0,8 mol HNO3 → dd X + ↑NO x mol.
ddX + tối đa m gam Cu y mol.
- Bản chất của phản ứng là quá trình nhường, nhận electron:
FeS2 → Fe+2 + 2S+6 + 14e
Cu → Cu+2 + 2e
N+5O3- + 4H+ + 3e → N+2O + 2H2O
Theo bảo bảo electron: 14 x nFeS2 + 2 x nCu = 3 x nNO → 14 x 0,1 + 2y = 3x (∗)
- Sau phản ứng trong dung dịch có Fe+2; Cu+2; NO3-; SO4-2
Theo bảo toàn điện tích 2 x nFe+2 + 2 x nCu+2 = 1 x nNO3- + nSO4-2 → 2 x 0,1 + 2y = 3x + 0,1 x 2 (∗∗)
Từ (∗) và (∗∗) → x = 0,6; y = 0,2 → mCu = 0,2 x 64 = 12,8 gam
→ Đáp án A
Câu 67. Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo thành trong dung dịch là
A. 35,7 gam B. 36,7 gam
C. 53,7gam D. 63,7 gam
Lời giải:
nCl- = 2nH2 = 2. 0,3 = 0,6 mol
mMuối = mKL = mCl- = 15,4 + 0,3 . 96 = 36,7 g
→ Đáp án D
Câu 68. Cho một hỗn hợp gồm có 1,12 gam Fe và 0,24 gam Mg tác dụng với 250 ml dung dịch CuSO_4. Phản ứng thực hiện xong, người ta thu được kim loại có khối lượng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO_4 đã dùng.
A. 0,1M B. 0,12M
C. 0,2M D. 0,05M
Lời giải:
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là: 0,03. 64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam)
Đặt khối lượng Fe tham gia ở (2) là x, khối lượng sắt dư là (1,12 – 56x) và khối lượng Cu sinh ra ở (2) là 64x.
Ta có: (1,12 - 56x) + 64x = 1,24 ⇒ x = 0,015
Lượng CuSO4 trong 250 ml dung dịch đã phản ứng hết:
0,015 + 0,01 = 0,025(mol)
Nồng độ mol của dung dịch CuSO4 đã dùng là: 0,025/0,25 = 0,1mol/lít
→ Đáp án A
Câu 69. Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là kim loại nào?
A. Zn B. Fe
C. Al D. Ni
Lời giải:
Khối lượng kim loại phản ứng là
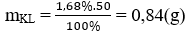
Số mol H2 là nH2 = 0,336/22,4 = 0,015 (mol)
2M + 2nHCl → 2MCln + nH2
Số mol của M là
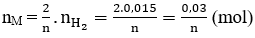
M = 0,84:(0,03/n) = 28n ⇒ M = 28n ⇒ n = 2, M = 56 ⇒ M: Fe
→ Đáp án B
Câu 70. Hòa tan 14,8 gam hỗn hợp gồm Fe và Cu vào lượng dư dung dịch hỗn hợp HNO3 và H2SO4 đặc nóng. Sau phản ứng thu được 10,08 lít NO2 (đktc) và 2,24 lít SO2 (đktc). Khối lượng Fe trong hỗn hợp ban đầu là:
A. 5,6 B. 8,4
C. 18 D. 18,2
Lời giải:
Gọi a, b lần lượt là số mol của Fe, Cu
56a + 64b = 14,8 (1)
- Quá trình nhường electron:
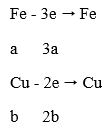
→ ∑ne nhường = (3a + 2b) mol
- Quá trinh nhận electron:
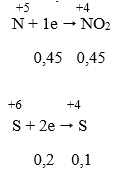
⇒ ∑ne nhận = 0,45 + 0,2 = 0,65 mol
Áp dụng định luật bảo toàn electron:
3a + 2b = 0,65 → a = 0,15 và b = 0,1 → mFe = 8,4 g
→ Đáp án B
Câu 71. Cho 100 ml dung dịch FeSO4 1M vào 500 ml dung dịch chứa đồng thời KMnO4 0,04 M và H2SO4 1M, thu được dung dịch X. Đem dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là:
A. 127,20. B. 128,98.
C. 152,28. D. 150,58.
Lời giải:
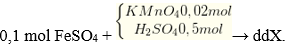
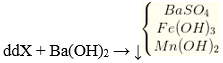
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
→ nFe3+ = 0,1 mol; ∑nSO42- = 0,1 + 0,5 = 0,6 mol; nMn2+ = 0,02 mol.
m↓ = mFe(OH)3 + mBaSO4 + mMn(OH)2 = 0,1 x 107 + 0,6 x 233 + 0,02 x 89 = 152,28 gam
→ Đáp án C
Câu 72. Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1l B. 0,12l
C. 0,2l D.0,24l
Lời giải:
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có: Fe3O4 (0,02) + 4H2SO4 → FeSO4 (0,02) + Fe2(SO4)3 + 4H2O
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 lit
→ Đáp án C
Câu 73. Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
A. 10,5g B. 10,76g
C. 11,2g D. 12,8g
Lời giải:
Khối lượng AgNO3 = (250.4)/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
Cu (0,005) + 2AgNO3 (0,01) → Cu(NO3)2 + 2Ag (0,01 mol)
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
→ Đáp án B
Câu 74. Cho 0,02 mol Fe vào dung dịch chứa 0,045 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là:
A. 4,32 B. 2,16
C. 1,08 D. 4,86
Lời giải:
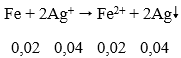
⇒ nAg+ dư = 0,045 - 0,04 = 0,005 mol. Khi đó xảy ra phản ứng:
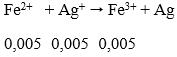
⇒ mAg = (0,04 + 0,005).108 = 1,86g
→ Đáp án D
Câu 75. Trước đây người ta thường trộn vào xăng chất Pb(C2H5)4. Khi đốt cháy xăng trong các động cơ, chất này thải vào không khí PbO, đó là một chất rất độc. Hằng năm người ta đã dùng hết 227,25 tấn Pb(C2H5)4 để pha vào xăng (nay người ta không dùng nữa). Khối lượng PbO đã thải vào khí quyển gần với giá trị nào sau đây nhất ?
A. 185 tấn. B. 155 tấn.
C. 145 tấn. D. 165 tấn.
Lời giải:
Ta có nPb(C2H5)4 =
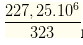
→ nPbO =
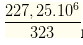
→ mPbO =
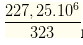
→ Đáp án B
Câu 76. Hòa tan hoàn toàn hỗn hợp X gồm kim loại A, Fe và các oxit của sắt bằng dung dịch H2SO4 loãng thu được dung dịch Y chỉ chứa 2 muối sunfat có khối lượng 130,4 gam và 0,5 mol khí H2. Cho Y tác dụng với dung dịch Ba(OH)2 dư (trong điều kiện không có không khí) thu được m gam kết tủa.Biết hidroxit của A không tan trong kiềm mạnh và nếu lấy 63 gam X thì có thể điều chế được tối đa 55 gam hỗn hợp kim loại.Giá trị của m gần nhất với
A. 280 B. 290
C. 300 D. 310
Lời giải:
X(Fe, A, oxit sắt) -H2SO4→ Dung dịch Y chỉ chứa 2 muối sunfat: 130,4 gam + 0,5 mol H2 + H2O
Coi hỗn hợp ban đầu gồm Fe, A, O. Trong 63 gam X thì mO = 8 gam
→ mkim loại = 6,875mO
Trong hỗn hợp X gọi số mol Fe, A, O lần lượt là x, y,z
Ta có nH2O = nO = z mol, nH2SO4 = z + 0,5
Vì dung dịch chỉ chứa 2 muối sunfat → dung dịch Y chứa An+: x mol, Fe2+: y mol và SO42-: 0,5 + z mol
→ mkim loại = 6,875.16z = 110z gam → mSO42- = 130,4 - 110z = 96.(z + 0,5) → z = 0,4 mol
Kết tủa thu được gồm Fe(OH)2: y mol, A(OH)n: x mol, BaSO4: 0,5 + z mol
Bảo toàn điện tích trong dung dịch Y → 2y + xn = 2.(0, 5+z) → nOH- = 1 + 2z
mkết tủa = mkim loại + mOH- + mBaSO4 = 110z + 17.(1 + 2z) + 233.(0,5 + z) = 377z + 133,5 = 284,5 gam.
→ Đáp án A
Câu 77. Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu đựơc m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (đktc). Giá trị của m1 và m2 lần lượt là:
A. 8,10 và 5,43
B. 1,08 và 5,16
C. 0,54 và 5,16
D. 1,08 và 5,43.
Lời giải:
Ta có: nCu(NO3)2 = 0,03 mol; nAgNO3 = 0,03 mol; nH2 = 0,015 mol
Chất rắn X + dd HCl dư → H2 ⇒ trong chất rắn X có Al dư
Cu(NO3)2 và AgNO3 hết
2Aldư (0,01) + 6HCl → 2AlCl3 + 3H2 (0,015)
Al phản ứng hết với dd Cu(NO3)2 và AgNO3
Quá trình nhận e:
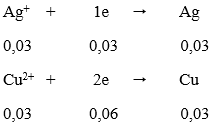
Tổng số mol e nhận = 0,06 + 0,03 = 0,09 mol
Quá trình nhường e:
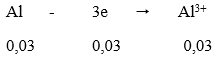
Vậy m2 = mAl dư + mCu + mAg = 0,01.27 + 0,03.64 + 0,03.108 = 5,43 gam
m1 = mAl ban đầu = (0,01 + 0,03).27 = 1,08g
→ Đáp án D
Câu 78. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ mol tương ứng là 1:2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là:
A. 68,2 B. 28,7
C. 10,8 D. 57,4
Lời giải:
nFeCl2 = 0,1 mol; nNaCl = 0,2 mol
Chất rắn gồm Ag và AgCl
⇒ mCR = 0,1. 108 + 143,5. (0,1. 2 + 0,2) = 68,2g
→ Đáp án A
Câu 79. Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn 18 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1: 1 là: (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít B. 0,6 lít
C. 0,8 lít D. 1,2 lít
Lời giải:
nFe = nCu = 0,15 mol
- Do thể tích dung dịch HNO3 cần dùng ít nhất → muối Fe2+
→ ∑ne cho = 2.(0,15 + 0,15) = 0,6 mol
- Theo ĐLBT mol electron: nH+ = nHNO3 = (0,6.4): 3 = 0,8 mol
→ VHNO3 = 0,8 lít
→ Đáp án C
Câu 80. Hòa tan hoàn toàn 29,68 gam hỗn hợp X gồm Cu, Fe và Fe3O4 bằng lượng vừa đủ dung dịch HCl 1M và H2SO4 0,5M thu được 0,896 lít khí H2 đktc và dung dịch Y chứa m gam chất tan. Cho từ từ dung dịch BaCl2 đến khi kết tủa cực đại thì dừng lại, cho tiếp AgNO3 vào sau phản ứng thu được 211,02 gam kết tủa. Mặt khác cho cùng lượng X trên tác dụng với dung dịch HNO3 đặc nóng lấy dư thu được 8.736 lít NO2 (đktc). Giá trị m là ?
A. 60,02 B. 52,21
C. 62,22 D. 55,04
Lời giải:
Gọi số mol Cu, Fe, Fe3O4 lần lượt là x, y, z mol → 64x + 56y + 232z = 29,68
X + HNO3 dư sinh 0,39 mol NO2 → 2x + 3y + z = 0,39
Để kết tủa cực đại gồm BaSO4, Ag, AgCl
Vì AgNO3 dư nên hình thành Fe3+, Cu2+
Bảo toàn electron → nAg + 2nH2 = 2nCu + 3nFe + nFe3O4 → nAg = 2x + 3y + z - 0,04.2
Bảo toàn nguyên tố H → nHCl + 2nH2SO4 = 2nH2 + 2nO (Fe3O4) = 0,08 + 8z
Mà nHCl = 2nH2SO4 → nHCl = 0,04 + 4z mol, nH2SO4 = 0,02 + 2x
→ nBaSO4 = nH2SO4 = 0,02 + 2z
nAgCl = 2nBaCl2 + nHCl = 2. (0,02 + 2z) + 0,04 + 4z = 0,08 + 8z mol
Kết tủa thu được 211, 02 gam → 233. (0,02 + 2z) + 143,5. (0,08 + 8z) + 108. (2x + 3y + z - 0,04.2) = 211, 02 → 216x + 324y + 1722z = 203,52
Ta có hệ
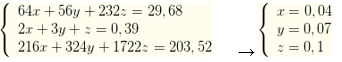
→ m = mkl + mSO42- + mCl- = 29,68 - 0,1.4.16 + 96. ( 0,02 + 0,2) + 35,5. ( 0,04 + 0,4) = 60,02 gam.
→ Đáp án A
Câu 81. Khử 4,8 gam một oxit kim loại trong dãy điện hóa ở nhiệt độ cao, cần 2,016 lít H2. Kim loại thu được đem hòa tan trong dung dịch HCl, thu được 1,344 lít H2. Biết các khí đo ở đktc. Vậy oxit cần tìm là:
A. FeO B. Fe2O3
C. CuO D. Ag2O
Lời giải:
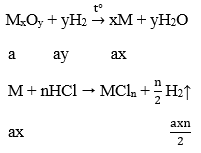
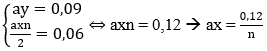
Ta có: (Mx + 16y)a = 4,8 → Max + 16ay = 4,8 (1)
Thay ay = 0,09 và ax = 0,12/n vào (1)
Ta có: M = 28n → n = 2 → M = 56: Fe
Thay n = 2 vào ta có: ax = 0,06
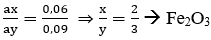
→ Đáp án B
Câu 82. Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hoà tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
A.112ml B. 224 ml
C. 336 ml D. 448 ml.
Lời giải:
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có:
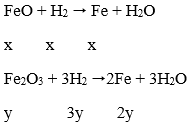
Có: x + 3y = 0,05 và 72x + 160y = 3,04
⇒ x = 0,02mol; y = 0,01mol
2FeO (0,02) + 4 H2SO4 → Fe2(SO4)3 (0,01 mol) + SO2 + 4H2O
Vậy VSO2 = 0,01. 22,4 = 0,224 lít hay 224ml
→ Đáp án B
Câu 83. Cho hỗn hợp có a mol Zn tác dụng với dung dịch chứa b mol Cu(NO3)2 và c mol AgNO3. Kết thúc phản ứng thu được dung dịch X và chất rắn Y. Biết a = b + 0,5c. Ta có:
A. Dung dịch X chứa 3 muối và Y chứa 2 kim loại.
B. Dung dịch X chứa 2 muối và Y chứa 2 kim loại.
C. Dung dịch X chứa 1 muối và Y có 2 kim loại.
D. Dung dịch X chứa 2 muối và Y có 1 kim loại.
Lời giải:
a = b + 0,5c ⇒ 2a = 2b + c
Như vậy, lượng Zn vừa đủ phản ứng với các chất trong dung dịch
Tóm lại, trong dung dịch X chỉ còn muối Zn(NO3)2 và trong Y có 2 kim loại là Cu và Ag
→ Đáp án C
Câu 84. Hòa tan hoàn toàn hỗn hợp gồm 0,01 mol Al; 0,05 mol Zn và 0,03 mol Fe cần vừa đủ 200ml dung dịch HCl 0,1M và H2SO4 a mol/l. Giá trị của a là?
A. 0,425 B. 0,5
C. 0,625 D. 0,75
Lời giải:
∑nH+ = 0,2. 0,2 + 0,2. 2a = 0,02 + 0,4a (mol)
∑ne cho = 0,01. 3 + 0,05. 2 + 0,03. 2 = 0,19 (mol)
Ta có: ne cho = ne nhận = nH+
0,02 + 0,4a = 0,19 → a = 0,425
→ Đáp án A
Câu 85. Cho m gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 tỷ lệ mol tương ứng là 8: 1: 2 , tan hết trong dung dịch H2SO4 (đặc/nóng). Sau phản ứng thu được dung dịch Y chứa hai muối và 2,6544 lít hỗn hợp khí Z gồm CO2 và SO2 (đktc). Biết Y phản ứng được với tối đa 0,2m gam Cu. Hấp thụ hoàn toàn Z vào dung dịch Ca(OH) 2 dư thì thu được m’ gam kết tủa. Giá trị của m’ là :
A. 11,82 B. 12,18
C. 18,12 D. 13,82
Lời giải:
Gọi số mol Fe, Fe3O4, FeCO3 lần lượt là 8x, x, 2x mol
Số mol của Cu là
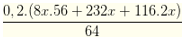
Dung dịch Y chứa 2 muối là FeSO4 và Fe2(SO4)3
Có nCO2 = nFeCO3 = 2x mol → nSO2 = 0,1185 - 2x mol
Bảo toàn electron cho toàn bộ quá trình → 2nFe + 2nCu = 2nFe3O4 + 2nSO2
→ 2. 8x + 2. 2,85x = 2.x + 2.(0,1185 - 2x) → x = 0,01
Hấp thụ khí vào dung dịch Ca(OH)2 thu được ↓ chứa
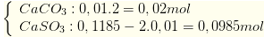
→ m = 0,02. 100 + 0,0985.120 = 13,82 gam
→ Đáp án D
Câu 86. Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít B. 0,6 lít
C. 0,8 lít D. 1,2 lít
Lời giải:
Lượng HNO3 tối thiểu cần dùng khi: Fe → Fe2+, Cu → Cu2+
Sơ đồ cho nhận e :
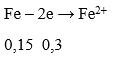
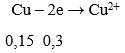
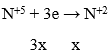
→ Theo định luật bảo toàn mol e: 0,3 + 0,3 = 3x → x = 0,2 mol
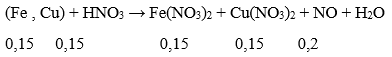
→ Bảo toàn nguyên tố N: Số mol HNO3 = 0,3 + 0,3 + 0,2 = 0,8 mol
→ Đáp án C
Câu 87. Cho 20 gam bột Fe vào dung dịch HNO3 và khuấy đến khi phản ứng xong thu V lít khí NO (đkc) và còn 3,2 gam kim lọai. Giá trị của V là
A. 2,24 lít B. 4,48 lít
C. 6,72 lít D. 5,6 lít
Lời giải:
Fe còn dư nên dung dịch chỉ gồm Fe2+
mFe(pư) = 20 - 3,2 = 16,8g ⇒ nFe = 0,3 mol
BT e: 3nNO = 2nFe = 2.0,3 = 0,6 mol ⇒ nNO = 0,2 mol ⇒ V = 4,48l
→ Đáp án B
Câu 88. Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là
A. 1,92. B. 3,20.
C. 0,64. D. 3,84.
Lời giải:
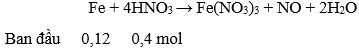
→ HNO3 hết, sau phản ứng có: Fe(NO3)3 0,1 mol; Fe dư: 0,02 mol
Lượng Cu tối đa đuợc hoà tan hết là khi nó tham gia cả hai phản ứng:
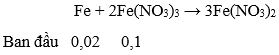
→ Sau phản ứng Fe(NO3)3 dư: 0,1 – 0,04 = 0,06 mol
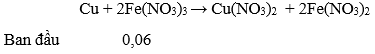
→ Số mol Cu tối đa được hoà tan là: 0,03 mol → mCu = 0,03.64 = 1,92 gam
→ Đáp án A
Câu 89. Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là:
A. 1,92 gam B. 3,20 gam
C. 0,64 gam D. 3,84 gam
Lời giải:
nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
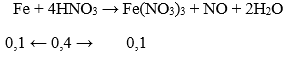
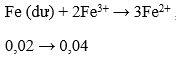
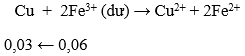
→ mCu = 0,03.64 = 1,92 gam
→ Đáp án A
Câu 90. Nung một lượng muối sunfua của một kim loại hóa trị không đổi trong bình chứa oxi dư thì thoát ra 5,6 lít khí X (đktc) và chất rắn Y. Chất rắn Y được nung với bột than dư tạo ra 41,4 gam kim loại. Nếu cho toàn bộ khí X đi chậm qua bột Cu dư nung nóng thì thể tích khí giảm đi 20%. Công thức của muối sunfua là
A. PbS. B. Cu2S.
C. ZnS. D. FeS.
Lời giải:
Khí X thu được gồm SO2 và O2
Thể tích khí giảm là của O2: ⇒ nSO2 = 0,2 mol
Giả sử kim loại hóa trị n
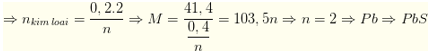
→ Đáp án A
Câu 91. Khử hoàn toàn 0,1 mol oxit sắt bằng khí CO ở nhiệt độ cao, rồi dẫn sản phẩm tạo thành vào dung dịch nước vôi trong dư, thấy tạo thành 30 gam kết tủa. Xác định công thức của oxit sắt.
A. Fe2O3 B. FeO
C. Fe3O4 D. Cả A và B
Lời giải:
Phản ứng:
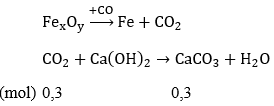
nCO2 = nCO = 0,3 (mol) = nO trong oxit
Cứ 0,1 mol FexOy có 0,3 mol nguyên tử O ⇒ y = 3 ⇒ x = 2
Công thức của oxit là Fe2O3
→ Đáp án A
Câu 92. Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được V lít khí NO duy nhất (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được 77,44 gam muối khan. Giá trị của V là:
A. 2,688 lít B. 2,24 lít
C. 4,48 lít D. 5,6 lít
Lời giải:
Giả sử hỗn hợp gồm Fe và O
nFe = nFe(NO3)3 = 77,44/242 = 0,32 mol
⇒ mO = 22,72 - 0,32. 56 = 4,8 g ⇒ nO = 0,3 mol
BT e: 3nFe = 2nO + 3nNO ⇒ nNO = (3.0,32 – 2.0,3 )/3 = 0,12 mol
⇒ V = 2,688l
→ Đáp án A
Câu 93. Cho m gam bột Fe vào 800ml dung dịch hỗn hơp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là:
A. 17,8 và 4,48
B. 17,8 và 2,24
C. 10,8 và 4,48
D. 10,8 và 2,24
Lời giải:
Ta có: nCu(NO3)2 = 0,16 mol → nCu2+ = 0,16 mol; nNO3- = 0,32 mol
nH2SO4 = 0,2 mol → nH+ = 0,4 mol
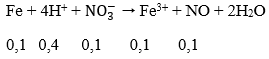
VNO = 2,24 lít
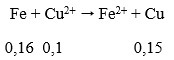
Do Fe nên tiếp tục xảy ra phản ứng:
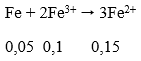
nFe phản ứng = 0,1 + 0,05 + 0,16 = 0,31 mol
0,6m (g) hỗn hợp bột kim loại sau phản ứng gồm Fe dư và Cu sinh ra:
m - mFe pư + mCu = 0,6m → m - 0,31.56 + 64.0,16 = 0,6m
→ m = 17,8 (g)
→ Đáp án B
Câu 94. Nung nóng 12,6 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15g B. 9g
C.18g D. 24g
Lời giải:
Ta có: nFe = 0,225 mol và nSO2 = 0,1875 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e:
O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
0,675 = 2x + 0,375 → x = 0,15
Mặt khác ta có: nên: m = 12,6 + 0,15.16 = 15 (gam).
→ Đáp án A
Câu 95. Người ta nướng 1 tấn quặng cancosin có 9,2% Cu2S và 0,77% Ag2S về khối lượng, biết hiệu suất quá trình điều chế Cu và Ag lần lượt đạt 75% và 82%. Khối lượng Cu và Ag thu được lần lượt là
A. 25,6 kg và 2,55 kg.
B. 55,2 kg và 5,5 kg.
C. 51,8 kg và 10,03 kg.
D. 24,8 kg và 7,89 kg.
Lời giải:
• 1 tấn quặng cancosin có 9,2% Cu2S và 0,77% Ag2S về khối lượng, Hđiều chế Cu = 75%, Hđiểu chế Ag = 82%.
• 1 tấn quặng cancosin có mCu2S = 1000 x 9,2: 100 = 92 kg.
1Cu2S → 2Cu
Ta có theo phương trình mCu (LT) = 92.2.64/160 = 73,6g
Mà H = 75 % → mCu thực tế = 73,6 x 75: 100 = 55,2 kg.
• 1 tấn quặng cancosin có mAg2S = 1000 x 0,77: 100 = 7,7 kg.
1Ag2S → 2Ag
Ta có theo phương trình mAg(LT) = 7,7. 2. 108/248 = 6,71kg
Mà H = 82 % → mAg thực tế = 6,71 x 82: 100 = 5,5 kg
→ Đáp án B
Câu 96. Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g B. 4,4g
C. 4,08g D. 5,4g
Lời giải:
Phản ứng xảy ra theo thứ tự:
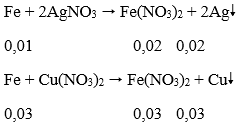
→ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)
→ Đáp án C
Câu 97. Cho m gam Fe vào dung dịch chứa đồng thời H2SO4 và HNO3 thu được dung dịch X và 4,48 lít NO duy nhất. Thêm tiếp H2SO4 vào X thì lại thu được thêm 1,792 lít khí NO duy nhất nữa và dung dịch Y. Dung dịch Y hòa tan vừa hết 8,32 gam Cu không có khí bay ra (các khí đo ở đktc). Khối lượng của Fe đã cho vào là:
A. 16,24 gam. B. 11,2 gam.
C. 16,8 gam. D. 9,6 gam.
Lời giải:
Số oxi hóa cuối cùng của Fe là +2
nNO = 0,2 + 0,08 = 0,28 mol; nCu = 0,13 mol
BT e: 2nFe + 2nCu = 3nNO
⇒ 2nFe = 3. 0,28 – 2. 0,13 = 0,58 mol ⇒ nFe = 0,29 mol
⇒ mFe = 0,29. 56 = 16,24g
→ Đáp án A
Câu 98. Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M B. 0,5M
C. 0,65M D. 0,8M
Lời giải:
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:
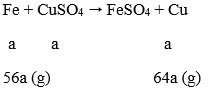
Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4]= 0,75M
→ Đáp án A
Câu 99. Nhúng một lá kim loại M (hóa trị II) nặng 56 gam vào 200 ml dung dịch AgNO3 1M cho đến khi phản ứng xảy ra hoàn toàn. Lọc dung dịch, đem cô cạn đượng 18,8 g muối khan kim loại M là:
A. Mg B. Zn
C. Cu D. Fe
Lời giải:
Ta có: nAgNO3 = 0,2 mol
M (0,2) + 2AgNO3 (0,1) → M(NO3)2 + 2Ag
M + 62,2 = 18,8/0,1 = 188 → M = 64
→ Đáp án C
Câu 100. Khi cho cùng một lượng kim loại M tác dụng với dung dịch HCl và H2SO4 đặc nóng thì khối lượng SO2 sinh ra gấp 48 lần H2 sinh ra. Mặt khác, khối lượng muối clorua bằng 31,75% khối lượng muối sunfat. Vậy M là:
A. Fe B. Cu
C. Al D. Mg
Lời giải:
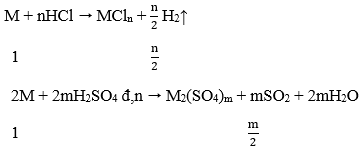
Ta có: khối lượng SO2 = (m/2). 64 = 32m (g)
Khối lượng H2 = (n/2). 2 = n (g)
Theo đề ra: 32m = 48n → m/n = 3/2
Vậy M có 2 hóa trị là 2 và 3.
Mặt khác:
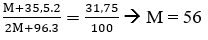
Vậy M là Fe
→ Đáp án A
Câu 101. Cho hỗn hợp A gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO_3 thấy thoát ra 0,448 lít khí NO duy nhất (đktc). Tính khối lượng muối trong dung dịch thu được.
A. 54g B. 42g
C. 36g D. 32g
Lời giải:
Ta có: nNO = 0,02 (mol); nFe ban đầu = 0,0375 (mol)
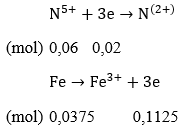
Nếu Fe phản ứng hết, số mol electron nhường = 0,0375 x 3 = 0,1125 > 0,06 Fe dư, Cu chưa phản ứng với dung dịch HNO3.

Như vậy sau khi phản ứng kết thúc Fe dư, Cu chưa phản ứng muối tạo ta là Fe(NO3)2: mFe(NO3)2 = 0,03 x 180 = 54(gam)
→ Đáp án A
Câu 102. Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
A. 600ml B. 200ml
C. 800ml D. 400ml
Lời giải:
Theo Đl bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) → nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
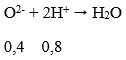
VHCl = 0,8: 2 = 0,4 (lít) = 400ml
→ Đáp án D
Câu 103. Nhúng một đinh sắt vào 150ml dung dịch CuSO4. Sau khi phản ứng xảy ra hoàn toàn, lấy đinh sắt sấy khô, thấy khối lượng tăng lên 1,2g. Vậy nồng độ ban đầu của CuSO4 là:
A. 1M B. 2,5M
C. 2M D. 0,5M
Lời giải:
Phương trình phản ứng:
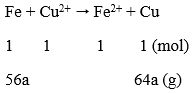
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol
CM (CuSO4) = 0,15/0,15 = 1M
→ Đáp án A
Câu 104. Hòa tan m gam hỗn hợp A gồm Cu, Ag trong dung dịch HNO3 thu được dung dịch B chứa hỗn hợp 7,06g muối và 0,05 mol NO2 (duy nhất). Giá trị của m là:
A. 2,2 B. 3,06
C. 2,58 D. 3,96
Lời giải:
0,05 mol NO2 đã nhận 0,05 mol e
⇒ số mol điện tích (+) tạo ra là 0,05 mol ⇒ Số mol NO3- là 0,05 mol
⇒ m = mmuối - mNO3- = 7,06 - 0,05.62 = 3,96g
→ Đáp án D
Câu 105. Khử m gam bột CuO bằng khí H2 ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hòa tan hết X cần vừa đủ 1 lít dung dịch HNO3 1M, thu được 4,48 lít NO (đktc). Hiệu suất của phản ứng khử CuO bằng bao nhiêu?
A. 70% B. 75%
C. 80% D. 85%
Lời giải:
CuO (0,3) + H2 -to→ Cu (0,3 mol) + H2O
Số mol HNO3: nHNO3 = 1.1 = 1 mol
Số mol NO: nNO = 4,48/22,4 = 0,2 mol
3Cu (0,3) + 8HNO3 (0,8) → 3Cu(NO3)2 + 2NO (0,2 mol) + 4H2O
HNO3 còn 1 - 0,8 = 0,2 mol → CuO dư
CuO (0,1) + 2HNO3 (0,2 mol) → Cu(NO3)2 + H2O
Ban đầu 0,4 mol CuO, phản ứng 0,3 mol CuO
Hiệu suất H = (0,3/0,4). 100% = 75%
→ Đáp án B
Câu 106. Cho 40 g hỗn hợp các oxit gồm ZnO, FeO, Fe3O4 và CuO tác dụng với 100ml dung dịch HCl 5M thì thu được dung dịch X. Khối lượng muối trogn dung dịch X là:
A.53,75 B. 54,25
C. 62,25 D. 40,8
Lời giải:
nHCl = 0,1. 5 = 0,5 mol → mHCl = 18,25g
nH2O tạo ra = 1/2. nHCl = 0,25 mol
Áp dụng định luật bảo toàn khối lượng ta có:
moxit + mHCl = mmuối + mH2O
mmuối = moxit + mHCl + mH2O
mmuối = 40 + 18,25 - 0,25.18 = 153,75g
→ Đáp án A
Câu 107. Cho m gam Fe tác dụng với dung dịch HNO3 thấy sinh ra 0,1 mol NO là sản phẩm khử duy nhất của HNO3 và còn lại 1,6 gam Fe không tan. Giá trị của m là:
A. 5,6 B. 7,2
C. 8,4 D. 10
Lời giải:
Do Fe còn dư nên dung dịch chỉ chứa Fe(NO3)2
2nFe = 3nNO ⇒ nFe = 3/2 . 0,1 = 0,15 mol
mFe = 0,15. 56 + 1,6 = 10g
→ Đáp án D
Câu 108. Nhúng một đinh sắt vào 150ml dung dịch CuSO4. Sau khi phản ứng xảy ra hoàn toàn, lấy đinh sắt sấy khô, thấy khối lượng tăng lên 1,2g. Vậy nồng độ ban đầu của CuSO4 là:
A. 1M B. 2,5M
C. 2M D. 0,5M
Lời giải:
Phương trình phản ứng:
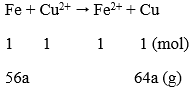
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol
CM (CuSO4) = 0,15/0,15 = 1M
→ Đáp án A
Câu 109. Khử 16 gam hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO và PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 gam. Tính thể tích khí CO đã tham gia phản ứng (đktc).
A. 22,4l. B. 4,48 l.
C. 5,6 l. D. 6,72 l.
Lời giải:
Áp dụng ĐLBTKL:
Ta có: nCO2 = nCO = x mol
moxit + mCO = mchất rắn + mCO2
→ 28x - 44x = 11,2 - 16
→ x = 0,3
Vậy VCO = 0,3. 22,4 = 6,72 lít
→ Đáp án D
Câu 110. Ngâm một vật bằng Cu có khối lượng 15g trong 340g dung dịch AgNO3 6%. Sau một thời gian lấy vật ra thấy khối lượng AgNO3 trong dung dịch giảm 25%. Khối lượng của vật sau phản ứng là
A. 3,24g B. 2,28g
C. 17,28g D. 24,12g.
Lời giải:
Ta có: mAgNO3 = (340.6)/100 = 20,4 (g) → nAgNO3 = 0,12 mol
Khối lượng AgNO3 giảm đi 25% chính là lượng AgNO3 phản ứng.
Vậy: nAgNO3 phản ứng = 0,12. 25% = 0,03 mol
Phản ứng: Cu (0,015) + 2AgNO3 (0,03) → Cu(NO3)2 (0,03) + 2Ag
mvật = 15 + (0,03.108 - 0,015.64) = 17,28 (g)
→ Đáp án C
Câu 111. Hòa tan hoàn toàn m (g) một oxit sắt bằng H2SO4 đặc nóng thu được a mol SO2 (duy nhất). Mặt khác, sau khi khử hoàn toàn m (g) oxit trên bằng H2 ở nhiệt độ cao rồi cho toàn bộ lượng sắt tạo thành vào H2SO4 đặc nóng dư thì thu được 9a mol SO2 (duy nhất). Vậy oxit sắt là:
A. FeO B. Fe2O3
C. Fe3O4 D. FeO hoặc Fe2O3.
Lời giải:
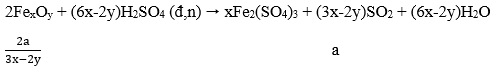
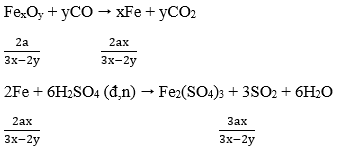
Ta có:
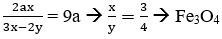
→ Đáp án C
Câu 112. Nung nóng 16,8 gam bột sắt ngoài không khí, sau một thời gian thu được m gam hỗn hợp X gồm các oxit sắt và sắt dư. Hòa tan hết hỗn hợp X bằng H2SO4 đặc nóng thu được 5,6 lít SO2 (đktc). Hãy xác định khối lượng của hỗn hợp X.
A. 40g B. 20g
C.25g D. 32g
Lời giải:
Áp dụng bảo toàn electron cho các quá trình oxi hóa và khử tổng hợp từ các giai đoạn của các phản ứng.
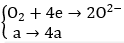
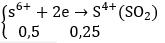
Ta có: nFe = 16,8/56 = 0,3(mol); nSO2 = 5,6/22,5 = 0,25(mol)
Theo bảo toàn electron ta có: 4a + 0,5 = 0,9 ⇒ a = 0,1(mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mFe + mO2 = 16,8 + 32a = 16,8 + 32.0,1 = 20(gam)
→ Đáp án B
Câu 113. Đốt cháy hoàn toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml B.21,5 ml
C. 23,4 ml D. 19,6 ml
Lời giải:
→ Đáp án B
Câu 114. Một hỗn hợp gồm Fe và Fe2O3. Nếu cho khí CO dư nung nóng đi qua m gam hỗn hợp trên, sau khi phản ứng hết thu được 11,2 g Fe. Nếu ngâm m gam hỗn hợp trên trong dung dịch Cu(NO3)2 dư, phản ứng xong thu được chất rắn có khối lượng tăng thêm là 0,4g. Vậy m có giá trị là:
A. 2,24 B. 16,8
C. 13,8 D. 14,4
Lời giải:
∑nFe = 11,2/56 = 0,2 mol
Khi ngâm m gam vào dung dịch Cu(NO3)2 thì chỉ có Fe phản ứng:
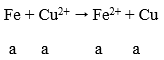
Δm = 64a - 56a = 8a → nFe = 0,4/8 = 0,05 mol
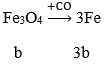
Ta có: 0,05 + 2b = 0,2 → b = 0,05 mol
m = 0,05.56 + 0,05.232 = 14,4g
→ Đáp án D
Câu 115. Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vủa đủ dung dịch H2SO4 10% thu được 2,24 lít khí H2 (đktc). Khối lượng dung dịch thu được sau phản ứng là:
A. 101,48 gam B. 101,68 gam
C. 97,80 gam D. 88,20 gam
Lời giải:
Ta có: nH2SO4 = nH2 = 0,1 mol
mH2SO4 = 0,1. 98 = 9,8 gam → mdd H2SO4 = (9,8. 100)/10 = 98 gam
Áp dụng định luật bảo toàn khôi lượng:
mhỗn hợp KL + mdd H2SO4 = mdd sau phản ứng + mH2
mdd sau phản ứng = mhỗn hợp KL + mdd H2SO4 - mH2 = 3,68 + 98 - 0,1.2 = 101,48 gam
→ Đáp án B
Câu 116. Cho hỗn hợp bột gồm 0,03 mol Al, 0,02 mol Zn và 0,01 mol Mg vào dung dịch CuCl2 dư thu được rắn X. Cho X tác dụng với dung dịch HNO3 dư thu được khí NO có số mol là
A. 0,04 B. 0,06
C. 0,03 D. 0,05
Lời giải:
∑ne nhường = 0,03.3 + 0,02.2 + 0,01.2 = 0,15 mol
Do CuCl2 dư nên kim loại phản ứng hết, X có Cu và HNO3 dư nên Cu cũng phản ứng hết
= ∑ne Cu2+ nhận = ∑e N+5 nhận
3.a = 0,15 ⇒ a = 0,05
→ Đáp án D
Câu 117. Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g B. 4,4g
C. 4,08g D. 5,4g
Lời giải:
Phản ứng xảy ra theo thứ tự:
Fe (0,01) + 2AgNO3 → Fe(NO3)2 + 2Ag↓ (0,02)
Fe (0,03) + Cu(NO3)2 → Fe(NO3)2 (0,03) + Cu↓ (0,03)
⇒ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)
→ Đáp án C
Câu 118. Điện phân 200ml dung dịch Cu(NO3)2 đến khi bắt đầu có khí thoát ra ở catot thì dừng lại. Để yên dung dịch cho đến khi khối lượng catot không thay đổi thì thấy khối lượng catot tăng lên 3,2 gam so với ban đầu. Vậy nồng độ của dung dịch Cu(NO3)2 trước khi điên phân là:
A. 1M B. 2M
C. 1,5M D. 3M
Lời giải:
Gọi a là số mol Cu(NO3)2 trước khi điện phân:
Phương trình phản ứng:
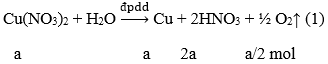
Khi khí bắt đầu thoát ra ở catot (H2 thoát ra do điện phân nước) nghĩa là Cu đã được giải phóng hoàn toàn ở catot. Sau khi để yên dung dịch, sẽ xảy ra phản ứng sau đây:
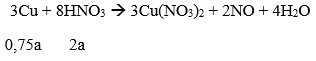
Số mol Cu dư sau phản ứng (2) là 0,25a
Ta có: 0,25a = 3,2/64 → a = 0,2 (mol)
→ Nồng độ của Cu(NO3)2 ban đầu là 1M
→ Đáp án A
Câu 119. Dùng khí CO dư để khử 1,2g hỗn hợp gồm CuO và oxit sắt. Sau phản ứng thu được 0,88g chất rắn. Nếu hòa tan hỗn hợp chất rắn này trong dung dịch HCl dư thì thu được 0,224 lít H2(đkct). Công thức của oxit sắt là:
A. Fe3O4 B. FeO
C. Fe2O3 D. FeO hoặc Fe3O4
Lời giải:
Gọi a, b là số mol CuO và FexOy, viết sơ đồ phản ứng ta có:
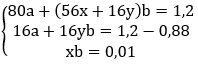
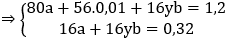
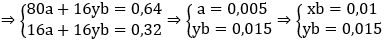
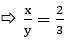
→ Đáp án C
Câu 120. Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư). Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là:
A. 58,52% B. 51,85%
C. 48,15% D. 41,48%
Lời giải:
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất trong hỗn hợp rắn Z có Cu và Fe dư.
Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
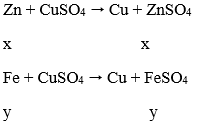
Ta có hệ:
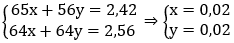
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g) → %Fe = (1,4/2,7). 100% = 51,85%.
→ Đáp án B
Câu 121. Cho 28 gam Fe hòa tan trong 256 ml dung dịch H2SO4 14% (có khối lượng riêng 1,095 g/ml), có khí hiđro thoát ra. Sau khi kết thúc phản ứng, đem cô cạn dung dịch thì thu được m gam một tinh thể muối ngậm 7 phân tử nước (nmuối: nnước = 1: 7). Trị số của m là
A. 116,8 gam B. 70,13 gam
C. 111,2 gam D. 139 gam
Lời giải:
mH2SO4 = 256. 1,095. 0,14 = 39,2448 g ⇒ nH2SO4 (0,4) < nFe (0,5)
nFeSO4 = nH2SO4 = 0,4 mol
mFeSO4. 7H2O = 0,4 . 278 = 111,2 g
→ Đáp án C
Câu 122. Cho 10 g Fe vào dung dịch HNO3 loãng dư thu được sản phẩm khử NO duy nhất. Sau khi phản ứng xảy ra hoàn toàn, còn dư 1,6g Fe. Thể tích NO thoát ra ở điều kiện tiêu chuẩn là:
A. 2,24 B. 3,36
C. 4,48 D. 11,2
Lời giải:
mFe phản ứng = 10 - 1,6 = 8,4g → nFe phản ứng = 8,4/56 = 0,15 mol
Do Fe dư nên sau khi Fe bị HNO3 oxi hóa thành Fe3+ thì toàn bộ Fe3+ lại bị khử thành Fe2+ nên có phản ứng:
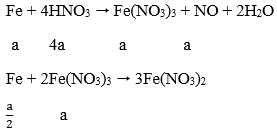
Ta có: a + a/2 = 0,15 → a = 0,1 mol
VNO = 0,1.22,4 = 2,24 lít
→ Đáp án A
Câu 123. Hòa tan a gam FeSO4.7H2O trong nước, được 300 ml dung dịch A. Thêm H2SO4 vào 200 ml dung dịch A, dung dịch hỗn hợp này làm mất màu 30ml dung dịch KMnO4 0,1M. Vậy a có giá trị là:
A. 62,55g B. 65,44g
C. 63,35g D. 55,67g
Lời giải:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Theo phương trình: nFeSO4 = 0,015 mol
Trong 300ml có: nFeSO4 = (0,015.300)/20 = 0,225 mol
mFeSO4.7H2O = a = 62,55 (g)
→ Đáp án A
Câu 124. Cho m gam bột Zn vào 500ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
A. 32,50 B. 20,80
C. 29,25 D. 48,75
Lời giải:
Ta có: nFe2(SO4)3 = 0,12 mol → nFe3+ = 0,24 mol
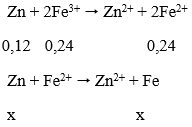
Ta có: mdd tăng = mZn phản ứng - mFe sinh ra
9,6 = 0,12 + x.65 - 56.x → x = 0,2
Vậy: mZn = (0,12 + 0,2).56 = 20,8 (g)
→ Đáp án B
Câu 125. Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO_3, thu được V lít hỗn hợp X gồm(NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối vơi hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 3,36l B. 4,48l
C. 5,6l D. 1,2 l
Lời giải:
Ta có: Mx = 38 = (30 + 46)/2 là trung bình cộng nên nNO = nNO2
Trong 12 gam hỗn hợp có 0,1 mol Fe và 0,1 mol Cu
Fe → Fe3+ + 3e
Cu → Cu2+ + 2e
⇒ ∑nelectron do chất khử cho = 0,5(mol)

Áp dụng định luật bảo toàn electron: 4x = 0,5 ⇒ x = 0,125(mol)
Vậy V = 0,125. 2. 22,4 = 5,6(lít)
→ Đáp án C
Câu 126. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 18,90 gam B. 37,80 gam
C. 39,80 gam D. 28,35 gam
Lời giải:
Ta có: nZn = 13/65 = 0,2 mol và nN2 = 0,448/22,4 = 0,02 mol
ne nhường = 2.nZn = 0,4 mol > ne nhận = 10.nN2 = 0,2 mol → phản ứng tạo thành NH4NO3.
nNH4NO3 = (0,4 - 0,2)/8 = 0,025 mol
Khối lượng muối trong dung dịch X là = 180.0,2 + 80.0,025 = 39,80 gam
→ Đáp án C
Câu 127. Cho tan hoàn toàn 58 gam hỗn hợp gồm Fe, Cu, Ag trong dung dịch HNO3 2M thu được 0,15 mol NO; 0,05 mol N2O và dung dịch D. Cô cạn dung dịch D, khối lượng muối khan thu được là:
A. 120,4 gam B. 89,8 gam
C. 116,9 gam D. 110,7 gam
Lời giải:
Nhận xét: Nếu chỉ dùng phương pháp bảo toàn electron thông thường, ta cũng chỉ lập được 2 phương trình 3 ẩn số và sẽ gặp khó khăn trong việc giải. Để tính khối lượng muối NO_3^- trong bài toán trên ta có công thức:
nNO2 (trong muối) - a.nX
Trong đó: a là số electron mà N nhận để tạo X
Như vậy: mmuối khan = mFe, Cu, Ag + mNO3-
nNO3- = 3.nNO + 8.nN2O = 3.0,15 + 8.0,05 = 0,85 mol
mmuối khan = 58 + 0,95.62 = 110,7 (g)
→ Đáp án D
Câu 128. Để m gam phôi bào sắt ngoài không khí, sau một thời gian Fe bị oxi hóa thành hỗn hợp X gồm 4 chất rắn có khối lượng 27,2 gam. Hòa tan vừa hết X trong 300 ml dung dịch HCl nồng độ a mol/l thấy thoát ra 3,36 lít khí H2 (đktc) và dung dịch Y. Cho tiếp dung dịch HNO3 tới dư vào dung dịch Y được dung dịch Z chứa hỗn hợp FeCl3, Fe(NO3)3, HNO3 dư và có 2,24 lít NO duy nhất thoát ra (đktc). Giá trị của m và a lần lượt là
A. 22,4 gam và 3M
B. 16,8 gam và 2M
C. 22,4 gam và 2M
D. 16,8 gam và 3M
Lời giải:
Giả sử X gồm Fe và O:
nFe = x; nO = y
⇒ mX = 56a + 16b = 27,2 (1)
BT e: 3ne = 2nO + 3nNO + 2nH2
⇒ 3x = 2y + 3. 0,1 + 0,15 .2 ⇒ 3x = 2y + 0,6 (2)
Từ (1) và (2) ⇒ x = 0,4 mol; y = 0,3 mol
⇒ mFe = 0,4. 56 = 22,4 g
mH+ = 2.nO + 2.nH2 = 2. 0,3 + 2. 0,15 = 0,9 mol ⇒ a= 3M
→ Đáp án C
Câu 129. Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là:
A. 74,69% B. 95,00%
C. 25,31% D. 64,68%
Lời giải:
Sơ đồ: m(g) 0,95m (g) hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKL ta có:
mO = m - 0,95m = 0,05m (g) ⇒ nO = 3,125.10-3m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3m (mol)
⇒ %PbS (đã bị đốt cháy) =
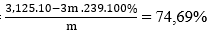
→ Đáp án A
Câu 130. Đốt cháy hòa toàn 15,4g hỗn hợp X gồm các kim loại Fe, Mg, Al thu được 25,1 g hỗn hợp các oxit Y. Hòa tan B bằng HCl 2M thì cần dùng thể tích là:
A. 0,6 lít B. 0,525 lít
C. 0,6125 lít D. 0,74 lít
Lời giải:
m = moxit - mkim loại = 25,1 - 15,3 = 9,8g
nO = 9,8/16 = 0,6125 mol
nH+ = 2nO = 0,6125. 2 = 1,225 mol
VHCl = 1,25/2 = 0,6125 (lít)
→ Đáp án C
Câu 131. Nhúng một đinh sắt vào 150ml dung dịch CuSO4. Sau khi phản ứng xảy ra hoàn toàn, lấy đinh sắt sấy khô, thấy khối lượng tăng lên 1,2g. Vậy nồng độ ban đầu của CuSO4 là:
A. 1M B. 2,5M
C. 2M D. 0,5M
Lời giải:
Phương trình phản ứng:
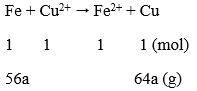
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol
CM (CuSO4) = 0,15/0,15 = 1M
→ Đáp án A
Câu 132. Cho 4,32 gam hỗn hợp gồm Zn, Fe và Cu vào cốc đựng dung dịch chứa 0,08 mol CuSO4. Sau phản ứng thu được dung dịch B và kết tủa C. Kết tủa C có:
A. Cu B. Cu, Fe, Zn
C. Cu, Fe D. Cu, Zn
Lời giải:
4,32/65 < n(Fe,Zn) < 4,32/56 → 0,0664 < nFe, Zn < 0,077
Ta thấy chỉ có Zn và Fe phản ứng hết với CuSO4 mà nFe, Zn < nCuSO4 nên Zn và Fe phản ứng hết.
CuSO4 dư → Kết tủa chỉ có Cu
→ Đáp án A
Câu 133. Hòa tan 5,6g Fe trong dung dịch HNO3 thu được khí NO duy nhất và dung dịch X. Thêm NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong điều kiện không có oxi thu được chất rắn Z. Còn nung Y trong không khí thì thu được chất rắn T có khối lượng mT = mZ + 0,32. Vậy Y có khối lượng là:
A. 10,42 B. 11,2
C. 10,36 D. 13,4
Lời giải:
Z có FeO và Fe2O3
Ta có: nFeO = nO = 0,32/16 = 0,02 mol
nFe(OH)2 = 0,02 mol
nFe(OH)3 = nFe - nFe(OH)2 = 0,1 - 0,02 = 0,08 mol
mY = 0,02.90 + 0,08.107 = 10,36g
→ Đáp án C
Câu 134. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 18,90 gam B. 37,80 gam
C. 39,80 gam D. 28,35 gam
Lời giải:
Ta có: nZn = 13/65 = 0,2 mol và nN2 = 0,448/22,4 = 0,02 mol
ne nhường = 2.nZn = 0,4 mol > ne nhận = 10.nN2 = 0,2 mol → phản ứng tạo thành NH4NO3.
nNH4NO3 = (0,4 - 0,2)/8 = 0,025 mol
Khối lượng muối trong dung dịch X là = 180.0,2 + 80.0,025 = 39,80 gam
Lưu ý: Đề bài không nói thu được khí X duy nhất nên có thể có muối NH4NO3 tạo thành.
→ Đáp án C
Câu 135. Hòa tan 4,76 gam hỗn hợp Zn, Al có tỉ lệ mol 1:2 trong 400ml dung dịch HNO3 1M vừa đủ, được dung dịch X chứa m gam muối khan và thấy có khí thoát ra. Giá trị của m là:
A. 25,8 gam B. 26,9 gam
C. 27,8 gam D. 28,8 gam
Lời giải:
Ta có: nZn = 0,04 mol; nAl = 0,08 mol
Do phản ứng không tạo khí nên trong dung dịch tạo NH4NO3. Trong dung dịch có: 0,04 mol Zn(NO3)2 và 0,08 mol Al(NO3)3.
Vậy số mol NO3- còn lại để tạo NH4NO3 là:
0,4 - 0,04.2 - 0,08.3 = 0,08 mol
Do đó trong dung dịch tạo 0,04 mol NH4NO3
m = 0,04.189 + 0,08.213 + 0,04.80 = 27,8 gam
→ Đáp án C
Câu 136. Cho hỗn hợp gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thấy thoát ra 0,448 lít khí NO(đktc). Tính khối lượng muối thu được trong dung dịch, biết các phản ứng xảy ra hoàn toàn.
A. 4,5g B. 3,6g
C. 2,4g D. 5,4g
Lời giải:
Phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (2)
Từ (1) ⇒ nFe = nFe(NO3)3 = nNO = 0,448/22,4 = 0,02(mol)
Từ (2) ⇒ nFe = 1/2 nFe(NO3)2 = 0,01(mol)
nFe(NO3)2 = 3/2 nFe(NO3)3 = 0,03(mol)
nFedu = 0,0375 - 0,02 - 0,01 = 0,0075(mol)
Fe dư nên Cu chưa phản ứng.
⇒ mFe(NO3)3 = 180. 0,03 = 5,4(gam)
→ Đáp án D
Câu 137. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam B. 23,2 gam
C. 11,6 gam D. 34,8 gam
Lời giải:
Fe3O4 -+H2, to→ FeO , Fe -H2SO4 (0,6 mol)→ FeSO4
Nhận thấy sau phản ứng chỉ thu được FeSO4 → nFeSO4 = nSO42- = 0,6 mol
Bảo toàn nguyên tố Fe → nFe3O4 = 0,6: 3 = 0,2 mol
→ m = 46,4 gam.
→ Đáp án A
Câu 138. Đốt cháy hòa toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml B. 21,5 ml
C. 23,4 ml D. 19,6 ml
Lời giải:
mO = moxit - mkim loại = 4,66 - 3,86 = 0,8g
nO = 0,8/16 = 0,05 mol
nO = 2nH+ = nH2SO4 = 0,05 mol
V = (0,05. 98. 100)/(20. 1,14) = 21,5 ml
→ Đáp án C
Câu 139. Để định lượng Fe2+ trong mẫu phân tích người ta dùng phương pháp chuẩn độ đicromat dựa vào sơ đồ phản ứng sau:
Fe2+ + H+ + Cr2O72- → Fe3+ + Cr2+ + H2O
Hãy tính khối lượng Fe2+ trong dung dịch X biết đã dùng hết 30ml K2Cr2O7 0,1M.
A. 0,56 B. 0,112
C. 1,008 D. 1,56
Lời giải:
nK2Cr2O7 = 0,03.0,1 = 0,003 mol
Phương trình phản ứng:
6Fe2+ (0,03.6) + 14H+ + Cr2O72- (0,03) → 6Fe3+ +2Cr3+ + 7H2O
mFe = 0,03. 6. 56 = 1,008g
→ Đáp án C
Câu 140. Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hòa tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là: (Biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít B. 0,6 lít
C. 0,8 lít D. 1,2 lít
Lời giải:
Fe (0,15) + 4HNO3 (0,6) → Fe(NO3)3 (0,15) + NO + 2H2O
Cu (0,075) + 2Fe(NO3)3 (0,15) → 2Fe(NO3)2 + Cu(NO3)2
3Cu (0,075) + 8HNO3 (0,2) → 3Cu(NO3)2 + 2NO + 4H2O
Số mol HNO3 cần dùng là: 0,6 + 0,2 = 0,8 mol
Thể tích dung dịch HNO3 1M cần dùng là:
VHNO3 = 0,8/1 = 0,8 (l)
→ Đáp án C
Câu 141. Nung nóng 29 gam oxit sắt với khí CO dư, sau phản ứng, khối lượng chất rắn còn lại là 21 gam. Công thức oxit là
A. FeO B. Fe3O4
C. Fe2O3 D. FeO hoặc Fe3O4
Lời giải:
Gọi số mol CO tham gia phản ứng là x → số mol CO2 tạo thành là x mol
Vì lượng CO dư → chất rắn chỉ chứa Fe → nFe = 0,375 mol
Bảo toàn khối lượng → 29 + 28x = 44x + 21 → x = 0,5 mol → nO = 0,5
→ nFe: nO = 0,375: 0,5 = 3:4 → Công thức của oxit sắt là Fe3O4
→ Đáp án B
Câu 142. Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hòa tan hoàn toàn một hốn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít B. 0,6 lít
C. 0,8 lít D. 1,2 lít
Lời giải:
→ Đáp án C
Fe (0,15) + 4HNO3 (0,6) → Fe(NO3)3 (0,15) + NO + 2H2O
Cu (0,075) + 2Fe(NO3)3 (0,15) → 2Fe(NO3)2 + Cu(NO3)2
3Cu (0,075) + 8HNO3 (0,2) → 3Cu(NO3)2 + 2NO + 4H2O
Số mol HNO3 cần dùng là: 0,6 + 0,2 = 0,8 mol
Thể tích dung dịch HNO3 1M cần dùng là:
VHNO3 = 0,8/1 = 0,8 (l)
→ Đáp án C
Câu 143. Cho 18,5 gam hỗn hợp X gồm Fe và Fe3O4 tác dụng với 200ml dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và 1,46 gam kim loại. Nồng độ mol của dung dịch HNO3 là:
A. 2M B. 2,4M
C. 2,5M D. 3,2M
Lời giải:
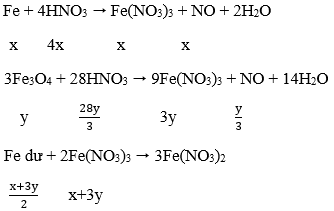
Ta có:
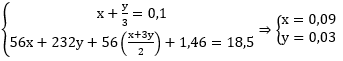
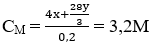
Câu 144. Khử hoàn toàn m gam hỗn hợp các oxit FeO, Fe2O3 và Fe3O4 thu được khí CO2 và Fe. Hấp thụ khí CO2 bằng nước vôi trong dư thu được a gam kết tủa. Hòa tan hoàn toàn Fe trong dung dịch HCl dư thu được V lít H2 (đktc). Mối liên hệ giữa m, V và a là:
A. m = 5V + 1,6a
B. m = 1,25V + 0,16a
C. m = 2,5V + 0,16a
D. m = 2,5V + 1,6a
Lời giải:
(FeO, Fe2O3, Fe3O4) + CO → Fe + CO2
CO2 + Ca(OH)2 dư → a gam ↓ CaCO3
Fe + HCl dư → V lít H2↑
• nFe = nH2 = V/22,4 mol; nCO = nCO2 = a/100 mol.
Theo bảo toàn khối lượng mhỗn hợp oxit = mFe + mCO2 - mCO
→ m = V/22,4 x 56 + a/100 x 44 - a/100 x 28 = 2,5V - 0,16a
→ Đáp án C
Câu 145. Dẫn từ từ V lít khí CO ở (đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. V có giá trị là:
A. 1,120 B. 0,896
C. 0,448 D. 0,224
Lời giải:
Ta có: nCaCO3 = 4/100 = 0,04 mol
Ca(OH)2 + CO2 (0,04) → CaCO3↓ (0,04) + H2O
Trong phản ứng khử CuO, Fe2O3 bằng CO, ta luôn có:
nCO = nCO2 = 0,04 mol
⇒ VCO = 0,04. 22,4 = 0,896 lít
→ Đáp án B
Câu 146. Điện phần 500ml dung dịch CuSO4 0,2M (điện cực trơ) cho đến khi catot thu được 3,2 gam kim loại thì thể tích khí (đktc) thu được ở anot là:
A. 3,36 lít B. 1,12 lít
C. 0,56 lít D. 2,24 lít
Lời giải:
Ta có: nCu = 0,05 mol < nCuSO4 = 0,1 mol → CuSO4 dư, catot chỉ có Cu2+ bị điện phân, ở anot nước bị điện phân.
Tại catot:
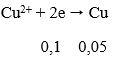
Tại anot:
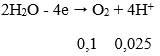
⇒ nO2 = 0,025 → VO2 = 0,56 lít
→ Đáp án C
Câu 147. Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7:3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là:
A. 448 B. 40,5
C. 33,6 D. 50,4
Lời giải:
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có: nHNO3 = 0,7; nNO + nNO2 = 0,25 mol; số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
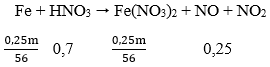
Áp dụng ĐLBT nguyên tố N ta có:
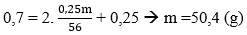
→ Đáp án D
Câu 148. Thổi một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp gồm CuO, Fe2O3, FeO, Al2O3 nung nóng thu được 2,5 gam chất rắn. Toàn bộ khí thoát ra sục vào nước vôi trong dư thấy có 15 gam kết tủa trắng. Khối lượng của hỗn hợp oxit kim loại ban đầu là:
A. 7,4 gam B. 4,9 gam
C. 9,8 gam D. 23 gam
Lời giải:
Các phương trình hóa học:
MxOy + yCO -to→ xM + yCO2
Ca(OH)2 + CO2 → CaCO3 + H2O
Ta có: moxit = mkim loại + moxi
Trong đó: n[O] = nCO = nCO2 = nCaCO3 = 15/100 = 0,15 mol
moxit = 2,5 + 0,15.16 = 4,9 gam
→ Đáp án B
Câu 149. Nhúng một đinh sắt vào 150ml dung dịch CuSO4. Sau khi phản ứng xảy ra hoàn toàn, lấy đinh sắt sấy khô, thấy khối lượng tăng lên 1,2g. Vậy nồng độ ban đầu của CuSO4 là:
A. 1M B. 2,5M
C. 2M D. 0,5M
Lời giải:
Phương trình phản ứng:
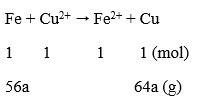
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol
CM (CuSO4) = 0,15/0,15 = 1M
⇒ Đáp án A
Câu 150. Hòa tan hỗn hợp gồm 0,1 mol Fe và a mol Cu vào dung dịch HNO3 loãng dư thu được 5,6 lít hỗn hợp NO và N2 (đktc) có tỷ khối hơi so với H2 là 14,5. Vậy a có giá trị là:
A. 0,6625 B. 0,6225
C. 0,0325 D. 0,165
Lời giải:
Gọi x, y là số mol của N2 và NO trong hỗn hợp.
Ta có:
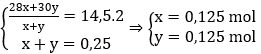
Quá trình cho electron
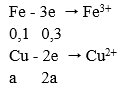
Quá trình nhận electron:
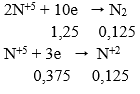
Ta có: ∑ne cho = ∑ne nhận → 0,3 + 2a = 1,25 + 0,375
→ a = 0,6625 mol
→ Đáp án A

