6 dạng bài tập về Este trong đề thi Đại học có giải chi tiết - Hoá học lớp 12
6 dạng bài tập về Este trong đề thi Đại học có giải chi tiết
Với 6 dạng bài tập về Este trong đề thi Đại học có giải chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Este từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

- Este đơn chức: RCOOR’
- Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đơn chức: R(COOR’)n
- Este đa chức được tạo bởi axit cacboxylic đơn chức và ancol đa chức: (RCOO)nR’
- Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đa chức (cùng có n nhóm chức): R(COO)nR’
Dạng 1: Lý thuyết và hoàn thành sơ đồ phản ứng của este
Phương pháp: Sử dụng các kiến thức về tính chất vật lí, hóa học, điều chế hiđrocacbon và dẫn xuất
Ví dụ 1 :
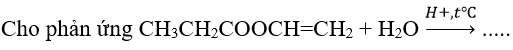
Sản phẩm thu được từ phản ứng trên gồm:
A. CH3CH2COOH + CH2=CHOH
B. CH2=CHCOOH + CH3CH2OH
C. CH3CH2COOH + CH3CHO
D. CH3CH2OH + CH3CHO
Hướng dẫn giải :
CH3CH2COOCH=CH2 + H2O 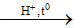
Do CH2 = CH2 – OH sinh ra không bền (do có nhóm – OH gắn vào C không no) nên sẽ chuyển thành chất bền hơn là CH3CHO.
Vậy sản phẩm thu được sau phản ứng là CH3CH2COOH và CH3CHO.
→ Đáp án C
Ví dụ 2 : Dãy nào sau đây được xếp đúng theo trật tự nhiệt độ sôi của các chất tăng dần?
A. Etyl axetat, etyl clorua, ancol etylic, axit axetic
B. Ancol etylic, etylaxetat, etyl clorua, axit axetic
C. Axit axetic, ancol etylic, etyl clorua, etylaxetat
D. Etyl clorua, etylaxetat, ancol etylic, axit axetic
Hướng dẫn giải :
Để so sánh nhiệt độ sôi của các chất hữu cơ lưu ý:
- Trước phải so sánh những hợp chất có khả năng tạo liên kết hiđro ( liên kết liên hiđro liên phân tử) và độ bên của các liên kết này. Những hợp chất có liên kết hiđro có nhiệt độ sôi cao hơn như: axit cacboxylic, ancol
- Những hợp chất không tạo được liên kết hiđro thì phải so sánh phân tử khối của chúng, phân tử khối càng lớn nhiệt độ sôi càng lớn
- Các nhóm hút e ( -Cl, -NO2,...) làm giảm nhiệt độ sôi; nhóm đẩy e (-OH; ankyl,...) làm tăng nhiệt độ sôi.
Tổng quát:
Hiđrocacbon < dẫn xuất halogen < andehit < xeton, este < amin < ancol< axit
→ Đáp án D
Ví dụ 3 : Khi thực hiện phản ứng este hóa giữa axit R(COOH)m và ancol R’(OH)n thì este thu được có công thức là:
A. Rn(COO)m.nR’m
B. (RCOO)m.nR’
C. R(COOR’)m.n
D. Rm(COO)n.mR’n
Hướng dẫn giải :
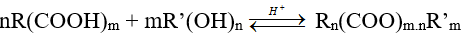
→ Đáp án A
Ví dụ 4 : Benzyl axetat là một este có mùi thơm của hoa nhài. Công thức của benzyl axetat là
A.C6H5-COO-CH3
B.CH3-COO-CH2-C6H5
C.CH3-COO-C6H5
D.C6H5-CH2-COO-CH3
→ Đáp án B
Dạng 2: Viết công thức cấu tạo este và gọi tên
Phương pháp:
- Sử dụng cách gọi tên của este
- Sử dụng độ bất bão hòa (Δ) để xác định số nhóm chức este trong phân tử và liên kết bội trong R và R’:
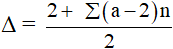
- Nếu este đa chức có thể xuất phát từ:
+ Axit đơn chức, ancol đa chức
+ Axit đa chức, ancol đơn chức
+ Axit và ancol đều đa chức
- Ngoài este, còn xuất hiện các đồng phân khác chức như: axit cacboxylic, andehit – rượu; xeton – rượu,...
Lưu ý: Một số trường hợp, sử dụng các đáp án để biện luận
Ví dụ 1 : Một este có công thức phân tử là C4H6O2, khi thủy phân trong môi trường axit thu được axetanđehit. Công thức cấu tạo thu gọn của este đó là:
A. CH3-COO-CH=CH2
B.CH2=CH-COOCH3
C. HCOO-C(CH3)=CH2
D. HCOO-CH=CH-CH3
Hướng dẫn giải :

→ Đáp án A
Ví dụ 2 : Este không no mạch hở có tỉ khối hơi so với oxi bằng 3,125 và khi tham gia phản ứng xà phòng hóa tạo ra một anđehit và một muối của axit hữu cơ. Hỏi có bao nhiêu công thức cấu tạo phù hợp với X?
A.4 B.2 C.3 D.5
Hướng dẫn giải :
Meste = 100
Theo đề bài tạo ra một anđehit và một muối của axit hữu cơ, nên este X phải chứa gốc ancol đơn chức không no nên X có dạng R(COO-CH=CH-R’)n
- Nếu n = 1 ⇒ R + R’ = 30
+ R là H ⇒ R’ = 29 (C2H5) hoặc ngược lại R = 29(C2H5) và R’ = 1 (H)
Ta có X là: HCOOCH=CH-C2H5 hoặc HCOOCH= C(CH3)2 hoặc C2H5COOCH=CH2
+ R = 15 (CH3) ⇒ R’ = 15 (CH3) ⇒ X là: CH3COOCH=CH-CH3
- Nếu n =2 ⇒ loại (MX > 100)
⇒ Có 4 công thức cấu tạo phù hợp với X
→ Đáp án
Ví dụ 3 : Thủy phân este có công thức phân tử C4H8O2 (với xúc tác axit) thu được 2 sản phẩm hữu cơ X và Y. Từ X có thể điều chế trực tiếp ra Y. Vậy chất X là:
A. Ancol metylic
B. Ancol etylic
C. Axit fomic
D. Etyl axetat
Hướng dẫn giải :
Từ X có thể điều chế trực tiếp ra Y mà este no đơn chức mạch hở ⇒ X và Y có cùng số C; X là ancol, Y là axit
⇒ Este là: CH3COOC2H5 ⇒ X là C2H5OH: Ancol etylic
→ Đáp án B
Dạng 3: Đốt cháy este
Phương pháp:
Este no đơn chức mạch hở: CnH2nO2 ( n≥2)
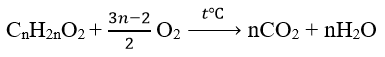
Ta có:
nCO2 = nH2O
Este không no, đơn chức, mạch hở, có 1 liên kết đôi C=C trong phân tử: CnH2n-2O2(n≥3)
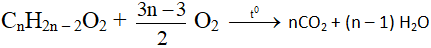
Ta có: nCO2 > nH2O
neste = nCO2 – nH2O
Este không no, đơn chức, mạch hở có k liên kết đôi C=C trong phân tử: CnH2n – 2kO2
Este bất kì: CxHyOz (x, z ≥2)
Sử dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải bài toán
Chú ý: Với bài toán đốt cháy hỗn hợp ta sử dụng công thức trung bình để giải
Ví dụ 1 : Đốt cháy hoàn toàn 4,2g một este E thu được 6,16g CO2; 2,52g H2O. Công thức cấu tạo của E là:
A. HCOOC2H5
B.CH3COOCH3
C. HCOOCH3
D. CH3COOC2H5
Hướng dẫn giải :
nCO2 = 0,14 mol; nH2O = 0,14 mol
nCO2 = nH2O ⇒ este no đơn chức: CnH2nO2
CnH2nO2 → nCO2
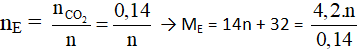
⇒ n =2 ⇒ C2H4O2
⇒ CTCT E: HCOOCH3
→ Đáp án C
Ví dụ 2 : Chất X chứa C, H, O có tỉ lệ khối lượng mC: mO = 3: 2 và khi đốt cháy hết X thu được CO2 và hơi nước theo tỉ lệ thể tích VCO2: VH2O = 4: 3 ( các thể tích đo ở cùng điều kiện nhiệt độ và áp suất). Biết X đơn chức, mạch hở và sau khi thủy phân X bởi dung dịch NaOH thu được rượu bậc 1. Công thức cấu tạo của X là:
A. CH3 – CH = CH – COOH
B. CH2=CH – COOC2H5
C. CH2 = CH – COOCH3
D. CH2=CH – COOCH3 hoặc HCOOCH2-CH=CH2
Hướng dẫn giải :
Gọi CTPT của X là: CxHyOz
mC: mO = 3: 2⇒ 12x: 16z = 3: 2 ⇒ z = x/2
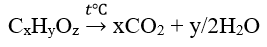
VCO2: VH2O = 4: 3 ⇒ x: y/2 = 4: 3 ⇒ y = 3/2x
⇒x: y: z = 2: 3: 1 ⇒ CTĐG của X là: C2H3O
X là đơn chức, mạch hở, phản ứng với NaOH sinh ra rượu vậy X là este đơn chức ⇒ CTPT của X là: C4H6O2
⇒ CTCT: CH2-CH – COOCH3 hoặc HCOOCH2 – CH=CH2
→ Đáp án D
Ví dụ 3 : Đốt cháy hoàn toàn 14,6g chất X gồm C, H, O thu được 1,344 lít khí CO2 (ở đktc) và 0,90g H2O. Tỉ khối hơi của X so với Hiđro bằng 73. Biết khi thủy phân 0,1 mol X bằng dung dịch KOH, ta có thể thu được 0,2 mol rượu etylic và 0,1 mol muối Y. Chất X có công thức cấu tạo là:
A. CH3COOC2H5
B. HCOOC2H5
C. H2C(COOC2H5)2
D. C2H5OOC – COOC2H5
Hướng dẫn giải :
dX/H2 = 73 ⇒ MX = 146 ⇒ nX = 0,01 mol
nCO2 = 0,06 mol; nH2O = 0,05 mol
Gọi CTPT X: CxHyOz
CxHyOz → xCO2 + y/2 H2O
0,01 0,01x 0,005y (mol)
0,01x = 0,06 ⇒ x = 6;
0,005y = 0,05 ⇒ y =10
MX = 146 ⇒ z = 4 ⇒ CTPT X: C6H10O4
thủy phân 0,1 mol X bằng dung dịch KOH, ta có thể thu được 0,2 mol rượu etylic và 0,1 mol muối Y ⇒ X là este của axit hai chức và rượu ancol etylic
⇒ X: C2H5OOC – COOC2H5
→ Đáp án D
Dạng 4: Thủy phân este – phản ứng xà phòng hóa
Este đơn chức
Phương pháp:
nNaOH: neste = 1: 1
Trừ trường hợp este tạo bởi axit và phenol ( dẫn xuất phenol) ta có:
nNaOH: neste = 2: 1; sản phẩm tạo thành gồm 2 muối
Các sản phẩm thủy phân có thể xảy ra:
- Sản phẩm gồm muối + ancol ⇒ este của axit và ancol
- Sản phẩm gồm muối + andehit ⇒ este không no (RCOO-CH=CH-R’)
- Sản phẩm gồm 2 muối ⇒ este của axit và phenol
Nếu bài toán có hỗn hợp, chúng ta nên sử dụng công thức trung bình để giải toán
Ví dụ 1 : Có 0,15 mol hỗn hợp 2 este đơn chức phản ứng vừa đủ với 0,25 mol NaOH và tạo thành hỗn hợp 2 muối và 1 rượu có khối lượng tương ứng là 23,9g và 2,3g. Vậy 2 muối đó là:
A. CH3COOC6H5 và CH3COOC2H5
B. CH3COOC6H5 và CH3COOCH3
C. HCOOC6H5 và CH3COOH
D. HCOOC6H5 và HCOOH
Hướng dẫn giải :

→ Đáp án A
Ví dụ 2 : Một este đơn chức, mạch hở có khối lượng là 12,9 gam tác dụng vừa đủ với 150ml dung dịch KOH 1M. Sau phản ứng thu được một muối và anđehit. Công thức cấu tạo của este là:
A. HCOOCH=CH – CH3
B. CH3COOCH=CH2
C. C2H5COOCH=CH2
D. HCOOCH=CH – CH3 và CH3COOCH = CH2
Hướng dẫn giải :
neste = nKOH = 0,15 mol
CTPT của este: CxHyO2
Khối lượng phân tử của este: M = 12x + y + 32 = 12,9: 0,15 = 86
⇒ 12x + y = 54 ⇒ x = 4; y =6 ⇒ CTPT este: C4H6O2
Do thủy phân được 1 muối và 1 anđehit ⇒ Este có công thức cấu tạo:
HCOOCH=CH – CH3 và CH3COOCH=CH2
→ Đáp án D
Ví dụ 3 : Hỗn hợp gồm 2 este đồng phân đều được tạo ra từ một axit no đơn chức và rượu no đơn chức. Trong cùng điều kiện 1 lít hơi hỗn hợp X nặng gấp 2 lần 1 lít CO2. Khi thủy phân 35,2g hỗn hợp X bằng 4 lít dung dịch NaOH 0,2M sau đó cô cạn thì được 44,6g chất rắn khan. Công thức của 2 este trong X là:
A. C2H5COOCH3 và CH3COOC2H5
B. HCOOC3H7 và CH3COOC2H5
C. HCOOC3H7 và C2H5COOCH3
D. Chỉ có B, C đúng
Hướng dẫn giải :

→ Đáp án D
Este đa chức
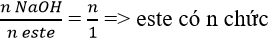
- Axit đa + rượu đơn: R(COOR’)n ( n ≥ 2)
- Axit đơn + rượu đa: (RCOO)nR’ (n ≥ 2)
- Axit đa + rượu đa: R(COO)nR’
Đặc biệt: mmuối = meste + mkiềm ⇒ este vòng
Nếu bài toán có hỗn hợp, chúng ta nên sử dụng công thức trung bình để giải toán
Ví dụ 1 : 0,01 mol este X ( chỉ chứa chức este) tác dụng vừa đủ với 20ml dung dịch NaOH 1M tạo sản phẩm chỉ có 1 rượu và một muối có số mol bằng nhau. Mặt khác khi xà phòng hóa 1,29g este X cần vừa đủ 60ml dung dịch KOH 0,25M và thu được 1,665g muối. Este X có công thức là:
A. (COO)2C2H4
B. CH2(COO)2C2H4
C. C2H4(COO)2C2H4
D. C4H8(COO)2C2H4
Hướng dẫn giải :
nNaOH = 0,2 mol = 2nx
⇒X là este hai chức; nrượu = nmuối
⇒X là este của rượu hai chức và axit 2 chức
⇒X có dạng R(COO)2R’
nKOH = 0,015
R(COO)2R’ + 2KOH → R(COOK)2 + R’(OH)2
0,0075 ← 0,015 → 0,0075 (mol)
MR(COOK)2 = 1,665: 0,0075 = 222
⇒ R = 56 ( - C4H8 - )
M X = 1,29: 0,0075 = 172 ⇒ R’ = 28 ( -C2H4-)
X là: C4H8(COO)2C2H4
→ Đáp án D
Ví dụ 2 : Khi thủy phân 0,01 mol este X ( chỉ chứa este) cần vừa đủ 1,2g NaOH thu được rượu đa chức và một muối của axit đơn chức. Mặt khác thủy phân 6,35g X cần vừa đủ 3g NaOH và được 7,05g muối. Este đó là:
A. (C2H3COO)3C3H5
B. (CH3COO)3C3H5
C. (HCOO)3C3H5
D. (C2H5COO)3C3H5
Hướng dẫn giải :
nNaOH = 0,03 = 3 n este ⇒ este 3 chức, mà thủy phân X thu được muối của axit đơn chức ⇒ X có dạng (RCOO)3R’
(RCOO3R’ + 3NaOH → 3RCOONa + R’(OH)3
Áp dụng định luật bảo toàn khối lượng:
mrượu = meste + mNaOH – mmuối= 6,35 + 3 – 7,05 = 2,3g
nrượu = 1/3 nNaOH = 3/3.40 = 0,025
Mrượu = 2,3: 0,025 = 92 ⇒ R’ = 41 (-C3H5)
nRCOONa = nNaOH = 0,075 ⇒ MRCOONa = 94 ⇒ R=27 (-C2H3)
⇒ X là: (C2H3COO)3C3H5
→ Đáp án A
Dạng 5: Hiệu suất của phản ứng este hóa
Phương pháp:
Khi tính hiệu suất: cần so sánh tỉ lệ số mol của axit và rượu theo phản ứng và theo giả thiết để khẳng định hiệu suất phản ứng được tính theo chất nào.
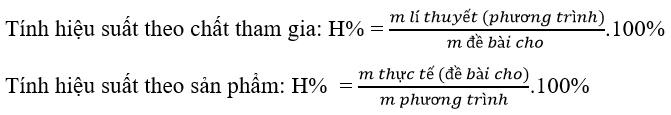
Ví dụ 1 : Cho 200g axit axetic tác dụng với 50g rượu etylen glycol ta thu được 87,6g X. Hiệu suất của phản ứng là:
A. 36%
B. 74,4%
C. 63%
D. 47%
Hướng dẫn giải :
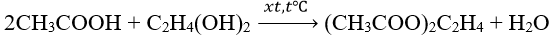
nCH3COOH = 10/3 ; nC2H4(OH)2 = 25/31
Ta có nCH3COOH > 2nC2H4(OH)2 ⇒ hiệu suất tính theo C2H4(OH)2
nseste thực tế = 0,6 ⇒ nC2H4(OH)2 pư = 0,6
H = 0,6/(25/31) .100% =74,4%
→ Đáp án B
Ví dụ 2 : Khi cho 10,6g hỗn hợp X gồm HCOOH và CH3COOH (có số mol bằng nhau) tác dụng với 6,9g C2H5OH (xúc tác H2SO4) khi hiệu suất phản ứng đạt 80% thì khối lượng este thu được là:
A. 12,96g
B. 9,72g
C. 13,48g
D. 7,52g
Hướng dẫn giải :
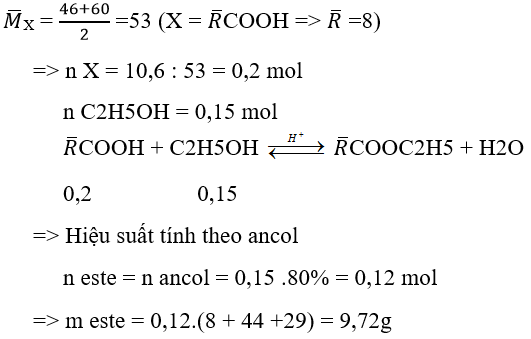
→ Đáp án B
Dạng 6: Hằng số cân bằng của phản ứng este hóa
Phương pháp:
- Hằng số cân bằng:
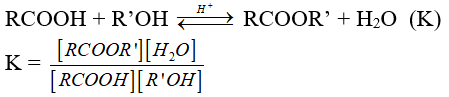
- Nguyên lí chuyển dịch cân bằng Lơ-sa-tơ-li-ê: Khi bất kỳ hệ thống nào ở trạng thái cân bằng trong một thời gian dài bị thay đổi nồng độ, nhiệt độ, thể tích, hoặc áp suất, thì hệ thống sẽ tự điều chỉnh phần nào để chống lại những hiệu ứng của sự thay đổi và một trạng thái cân bằng mới được thiết lập
Ví dụ 1 : Trộn 1 mol axit axetic với 1 mol rượu etylic. Khi số mol các chất trong hỗn hợp không thay đổi nữa, nhận thấy lượng este thu được là 2/3 mol. Hằng số cân bằng (K) của phản ứng là:
A. 2 B.4 C.6 D.8
Hướng dẫn giải :

→ Đáp án B
Ví dụ 2 : Trong phản ứng thủy phân sau:
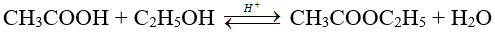
Để tăng hiệu suất phản ứng ( tăng tỉ lệ % este bị thủy phân) nên:
1) Thêm H2SO4
2) Thêm HCl
3) Thêm NaOH
4) Thêm H2O
Trong bốn biện pháp trên, biện pháp nào là đúng:
A. 1,2 B. 3,4 C. Chỉ có 3 D. Chỉ có 4
Hướng dẫn giải :
- Xúc tác axit chit làm tăng vận tốc phản ứng chứ không tăng hiệu suất phản ứng
- Thêm NaOH; NaOH sẽ phản ứng với CH3COOH, làm giảm nồng độ của CH3COOH, vì vậy cân bằng sẽ chuyển dịch theo chiều thuận.
- Nước là chất tham gia phản ứng. Khi thêm nước, cân bằng chuyển dịch theo chiều thuận
→ Đáp án B