5 dạng bài tập về kim loại trong đề thi Đại học có giải chi tiết - Hoá học lớp 12
5 dạng bài tập về kim loại trong đề thi Đại học có giải chi tiết
Với 5 dạng bài tập về kim loại trong đề thi Đại học có giải chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập kim loại từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Dạng 1: Kim loại tác dụng với axit
-Với dung dịch HCl, H2SO4 loãng: Các kim loại đứng trước H trong dãy hoạt động hóa học sẽ phản ứng sinh ra muối + khí H2
-Với H2SO4 đặc nóng, HNO3: Hầu hết các kim loại ( trừ Au, Pt) bị oxi hóa lên mức oxi hóa cao nhất
-Al, Cr, Fe bị thụ động bởi HNO3, H2SO4 đặc nguội
Chú ý:
+ Nên sử dụng phương trình ion để giải các bài toàn
+ Với dạng bài này nên vận dụng các định luật bảo toàn khối lượng, bảo toàn e để giải toán
+ Khi NO3- trong môi trường axit có tính oxi hóa mạnh như HNO3
Ví dụ 1 : Hỗn hợp X gồm Cu và kim loại M hóa trị II. Cho X tác dụng với dung dịch HCl dư thu được 11,2l khí (đktc), chất rắn Y nặng 10g và dung dịch Z. Thêm NaOH dư vào Z thu được kết tủa T. Nung T đến khối lượng không đổi thu được 20g chất rắn. Kim loại M và khối lượng hỗn hợp X là:
A. Mg và 30g B. Mg và 22g C. Fe và 38g D. Zn và 42,5g
Hướng dẫn giải :
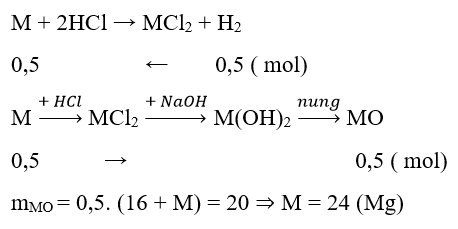
→ Đáp án B
Ví dụ 2 : Cho a gam bột nhôm tác dụng hết với dung dịch HNO3 loãng thì thu được 0,896l (đktc) khí X gồm N2O và NO có tỉ khối hơi so với hiđro bằng 18,5. Gía trị của a là:
A. 19,80g B. 18,90g C. 1,98g D. 1,89g
Hướng dẫn giải :
Dựa vào sơ đồ đường chéo ta tính được nN2O = nNO = 0,02 mol
ne nhận = 8nN2O + 3nNO = 0,22mol = ne nhận = 3nAl
⇒ a = mAl = 1,98
→ Đáp án C
Ví dụ 3 : Cho m gam bột Fe vào 800ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO( sản phẩm khử duy nhất, ở đktc). Gía trị m và V lần lượt là:
A. 17,8 và 4,48 B. 17,8 và 2,24
C. 10,8 và 4,48 D. 10,8 và 2,24
Hướng dẫn giải :

→ Đáp án B
Dạng 2: Kim loại tác dụng với muối
Phương pháp :
- Kim loại N có tính khử mạnh ( đứng trước) và không tan trong nước đẩy được kim loại có tính khử yếu hơn ra khỏi muối
- Trường hợp hỗn hợp nhiều kim loại tác dụng với hỗn hợp nhiều muối, thì phản ứng xảy ra ưu tiên theo thứ tự ưu tiên: chất oxi hóa mạnh tác dụng với chất khử mạnh trước để tạo ra chất oxi hóa yếu hơn và chất khử yêu hơn ( hay ưu tiên kim loại mạnh phản ứng với muối của kim loại yếu trước)
Lưu ý: Trong các bài toán thường sử dụng dữ kiện tăng ( giảm) khối lượng kim loại sau phản ứng
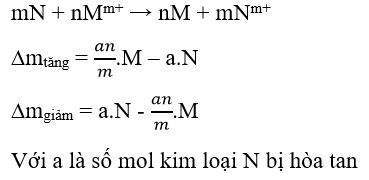
Ví dụ 1 : Nhúng một lá kim loại M ( hóa trị II) nặng 56g vào dd AgNO31M sau một thời gian lấy lá kim loại M ra rửa sạch sấy khô cân lại thấy khối lượng kim loại nặng 54g và thấy thể tích dung dịch AgNO3 dùng hết 200ml . Kim loại M là:
A. Mg B. Zn C. Cu D. Fe
Hướng dẫn giải :
M + 2AgNO3 → M(NO3)2 + 2Ag
nAgNO3 = 0,2 mol =nAg ⇒ nM = 0,1 mol
mkim loại giảm = mM pư – mAg sinh ra = 0,1.M – 0,2.108 = 2
⇒ M = 64 (Cu)
→ Đáp án C
Ví dụ 2 : Cho hỗn hợp kim loại gồm Al, Fe vào dung dịch Y gồm 2 muối Cu(NO3)2 và AgNO3, sau phản ứng thu được chất rắn Z gồm 3 kim loại. 3 kim loại đó là:
A. Al, Fe, Cu
B. Al, Fe, Cu
C. Ag, Cu, Fe
D. Cu, Ag, Fe
Hướng dẫn giải : Sau khi Al phản ứng hết với muối thì Fe sẽ phản ứng vì Z gồm 3 kim loại nên Fe dư và 2 kim loại được đẩy ra khỏi muối là Ag và Cu
→ Đáp án D
Ví dụ 3 : Hòa tan hoàn toàn hỗn hợp gồm 2,8 gam Fe và 1,6 gam Cu trong 500 ml dung dịch hỗn hợp HNO3 0,1M và HCl 0,4M, thu được khí NO (khí duy nhất) và dung dịch X. Cho X vào dung dịch AgNO3 dư, thu được m gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5 trong các phản ứng. Giá trị của m là
A. 34,10. B. 28,70. C. 29,24. D. 30,05.
Hướng dẫn giải :

→ Đáp án D
Dạng 3: Dạng bài về nhiệt luyện
Phương pháp :
Sử dụng phương pháp bảo toàn nguyên tố
CO + [O] → CO2
H2 + [O] → H2O
Ta thấy: n[O] oxit = nCO2 hoặc n[O] oxit = nH2O
Chú ý : CO, H2 chỉ khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa hóa học
Ví dụ 1 : Cho luồng khí CO ( dư) đi qua 9,1g hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3g chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là:
A. 0,8g B. 8,3g C. 2,0g D. 4,0g
Hướng dẫn giải :
mc/r giảm = 9,1 – 8,3 = 0,8g
Al2O3 không bị khử ⇒ mc/r giảm = mO(CuO) = 0,8g
n[O] = nCuO = 0,05 ⇒ mCuO = 4g
→ Đáp án D
Ví dụ 2 : Dẫn luồng khí CO dư qua ống đựng một bột oxit sắt ( FexOy) ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84g sắt và dẫn khí sinh ra vào nước vôi trong dư thì thu được 2g kết tủa. Công thức phân tử của FexOy là:
A. Fe3O4
B. FeO
C. Fe2O3
D. Fe2O
Hướng dẫn giải :
n↓ = nCO2 = nO oxit = 0,02mol
nFe = 0,015
x: y = nFe: nO = 0,015: 0,02 = 3:4 ⇒ Fe3O4
→ Đáp án A
Ví dụ 3 : Cho một luồng CO qua ống sứ đựng 0,04 mol hỗn hợp X gồm FeO và Fe2O3 đốt nóng. Sau khi kết thúc thí nghiệm thu được chất rắn Y gồm 4 chất, nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư thu được 9,062 gam kết tủa. Khối lượng của FeO và Fe2O3 trong 0,04 mol hỗn hợp X lần lượt là:
A. 0,72 gam và 4,6 gam.
B. 0,84 gam và 4,8 gam.
C. 0,84 gam và 4,8 gam.
D. 0,72 gam và 4,8 gam.
Hướng dẫn giải :
nBaCO3 = nCO2 = nCO = nO(oxit) = 0,046 mol
mX = mY + mO(oxit) = 4,784 + 0,046.16 = 5,52g
Ta có: nFeO + nFe2O3 = 0,04
mFeO + mFe2O3 = 5,52g
⇒ nFeO = 0,01; nFe2O3 = 0,03 mol
⇒ mFeO = 0,72g ; mFe2O3 = 4,8g
→ Đáp án D
Dạng 4: Kim loại tác dụng với nước
Phương pháp :
- Cho kim loại kiềm, kiềm thổ vào nước thu được dung dịch chứa ion OH-
- Phương trình phản ứng
M + H2O → M+ + OH- + 1/2H2
M + 2H2O → M2+ + 2OH- + H2
- Nhận thấy: nOH- = 2nH2
- Nếu có kim loại Al thì OH- tác dụng với Al
Al + H2O + OH- → AlO2- + 3/2H2
Ví dụ 1 : Hòa tan hoàn toàn 8,94g hỗn hợp gồm Na, K và Ba vào nước thu được dung dịch X và 2,688l H2 (đktc). Dung dịch Y gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4:1. Trung hòa dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là:
A. 13,70g B. 18,46g C. 12,78g D. 14,62g
Hướng dẫn giải :
Ta có nH2 = 0,12 mol ⇒ nOH- = 2nH2 = 0,24 mol
Ta có: nOH- = nH+ = nHCl + 2 nH2SO4 = 0,24
Mà nHCl: nH2SO4 = 4: 1
⇒ nHCl = 0,16mol; nH2SO4 = 0,04
mmuối = mkim loại + mgốc axit = mkim loại + mSO42- + mCl-
mmuối = 8,94 + 0,04.96 + 0,16.35,5 = 18,46g
→ Đáp án B
Ví dụ 2 : Cho hỗn hợp gồm Na và Al có tỉ lệ số mol tương ứng là 1: 2 vào nước dư. Sau khi phản ứng xảy ra hòa toàn, thu được 8,96l khí H2 ( ở đktc) và m gam chất rắn không tan. Gía trị của m là:
A. 10,8 B. 5,4 C. 7,8 D. 43,2
Hướng dẫn giải :

→ Đáp án B
Dạng 5: Điện phân
Phương pháp : Viết đúng phương trình điện phân: Cần phải nắm vững các quá trình xảy ra ở các điện cực. Nên làm theo thứ tự:
- Viết phương trình điện li để xác định những ion có trong dung dịch điện phân
- Viết các quá trình ở các điện cực:
+ Ở cực dương anot ( +): Thứ tự mất e: Trước tiên anion gốc axit không có oxi (Cl, Br,…) sau đó đến H2O
H2O → 1/2O2 + H+ + 2e
+ Ở cực âm catot (-): Thứ tự nhận e: Trước tiên các cation kim loại Mn+ ( Kim loại M yếu hơn Al), sau đó đến H2O
H2O + e → 1/2H2 + OH-
- Sau đó tổ hợp các quá trình xảy ra ở các điện cực ta được phương trình điện phân
Chú ý :
Nếu ở cực âm catot có nhiều cation kim loại ( kể cả H+) thì sự nhận e ưu tiên xảy ra đối với cation có tính oxi hóa mạnh hơn
Do bản chất của phản ứng điện phân là oxi hóa – khử nên khi giải toán có thể vận dụng phương pháp bảo toàn e
Phương pháp điện phân dung dịch muối được dùng để điều chế kim loại có tính khử trung bình hay yếu ( kim loại sau Al)
Xác định khối lượng các chất thu được ở điện cực theo công thức Faraday: m = (A.I.t)/(n.F)
Trong đó: m: Khối lượng chất thu được ở điện cực (g)
A: Khối lượng mol nguyên tử của các chất thu được ở điện cực
n: Số e mà nguyên tử hoặc ion đã cho hoặc nhận
I: Cường độ dòng điện (A)
t: Thời gian điện phân ( s)
F: Hằng số Faraday = 96500 culông/mol
Số mol electron cho ( nhận): ne = It/F
Ví dụ 1 : Điện phân 400ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở anot thoát ra 3,36l khí (đktc) thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 100ml dung dịch HNO3 0,6M. Dung dịch sau trung hòa tác dụng AgNO3 dư sinh ra 2,87g kết tủa trắng. Nồng độ mol của mối muỗi trong dung dịch trước điện phân là:
A. [CuCl2] = 0,3M; [KCl] = 0,02M
B. [CuCl2]=0,25M; [KCl] = 3M
C. [CuCl2] = 2,5M; [KCl]=0,3M
D. [CuCl2]=0,3M; [KCl]=0,2M
Hướng dẫn giải : D
(K): K+, Cu2+, H2O (A): Cl-, H2O
Dung dịch sau khi điện phân được trung hòa bằng HNO3; nHNO3 = 0,06
⇒ Ở (K) sau khi Cu2+ điện phân hết, xảy ra sự điện phân của H2O
Cu2+ +2e → Cu
H2O + e → OH- + 1/2H2
nOH- = nHNO3 = 0,06 mol
Dung dịch sau điện phân tạo kết tủa với AgNO3, nAgCl = 0,02 mol
⇒ Ở (A) Cl- chưa bị điện phân hết
Khí thoát ra ở (A) là Cl2, n Cl2 = 0,15mol
2Cl- → Cl2 + 2e
ne cho = 2nCl2 = 0,3 = ne nhận = nOH- + 2nCu2+
⇒ nCu2+ =nCuCl2= 0,12mol ⇒ [CuCl2] = 0,12: 0,4 = 0,3M
nCl- = 2 nCl2 + nAgCl = 0,32 = nKCl + 2 nCuCl2
⇒ nKCl = 0,08 ⇒ [KCl] = 0,08: 0,4 = 0,2M
→ Đáp án D
Ví dụ 2 : Điện phân điện cực trơ dung dịch chứa 0,02 mol NiSO4 với cường độ dòng điện I = 5A trong 6 phút 26 giây. Khối lượng catot tăng lên bao nhiêu gam
A. 0,02g B. 0,25g D. 0,75g D. 0,59g
Hướng dẫn giải :
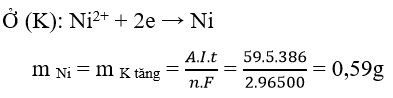
→ Đáp án D
Ví dụ 3 : Điện phân dung dịch chứa 0,02 mol FeSO4 và 0,06 mol HCl với cường độ dòng điện I = 1,34A trong 2 giờ (điện cực trơ có màng ngăn). Bỏ qua sự hoà tan của khí clo trong H2O, coi hiệu suất điện phân là 100%. Khối lượng kim loại thoát ra ở catot và thể tích khí (đktc) thoát ra ở anot là:
A. 1,12 gam và 0,896 lít.
B. 0,56 gam và 0,448 lít.
C. 5,6 gam và 4,48 lít.
D. 11,2 gam và 8,96 lít.
Hướng dẫn giải :

→ Đáp án A

