Cách giải bài tập Phản ứng nhiệt nhôm hay, chi tiết - Hoá học lớp 12
Cách giải bài tập Phản ứng nhiệt nhôm hay, chi tiết
Với Cách giải bài tập Phản ứng nhiệt nhôm hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Phản ứng nhiệt nhôm từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Dựa vào phản ứng:
2yAl + 3MxOy → yAl2O3 + 3xM
M là các kim loại có tính khử trung bình và yếu.
2yAl + 3FexOy → yAl2O3 + 3xFe
- Các trường hợp có thể xảy ra:
+ Hiệu suất phản ứng H = 100% (phản ứng xảy ra hoàn toàn). Nếu cho sản phẩm tác dụng với dung dịch kiềm có H2 thoát ra, thì sản phẩm có Al dư, Fe và Al2O3.
+ Hiệu suất H < 100% ( phản ứng xảy ra không hoàn toàn). Khi đó sản phẩm có Al dư, Al2O3, FexOy dư, Fe.
Ví dụ minh họa
Bài 1: Sau khi thực hiện phản ứng nhiệt nhôm với Fe3O4 thu được chất rắn A và nhận thấy khối lượng nhiệt nhôm tăng 0,96(g). Cho A tác dụng với dung dịch NaOH dư thu được 0,672 lít khí (đktc), (giả sử các phản ứng đều xảy ra với hiệu suất 100%). Khối lượng của A là:
A. 1,08g B. 1,62g C. 2,1g D. 5,1g
Hướng dẫn:
8Al + 3Fe3O4 −tº→ 9Fe + 4Al2O3
Khối lượng nhôm tăng chính là khối lượng của nguyên tố oxi.
nO (trong Al2O3) = 0,96/16 = 0,06 mol
nAl2O3 = 1/3 n O= 0,06/3 = 0,02 mol
Theo phản ứng: nFe = 9/4 .nAl2O3 = 9/4.0,02 = 0,045 mol
Hỗn hợp A sau phản ứng tác dụng với NaOH dư tạo ra khí H2. Chứng tỏ sau phản ứng nhiệt nhôm, nhôm còn dư:
Ta có: nH2 = 0,672/22,4 = 0,03 mol
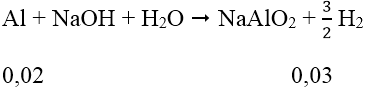
Vậy: mA = mAl dư + mAl2O3 = 0,02.27 + 0,045.56 + 0,02.102 = 5,1 (g)
Bài 2: Trộn 0,81 gam bột Al với bột Fe2O3 và CuO rồi nung nóng để tiến hành phản ứng nhiệt nhôm, thu được hỗn hợp X. Hòa tan X trong dung dịch HNO3 loãng, nóng, thu được V lit khí NO (đktc). Giá trị của V là:
A. 0,224 lit B. 2,24 lit.
C. 6,72 lit D. 0,672 lit
Hướng dẫn:
Ta có: nA1 = 0,03 (mol)
Các phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe (1)
2Al + 3CuO → Al2O3 + 3Cu (2)
Gọi số mol Al tham gia phản ứng (1) là x, tham gia phản ứng (2) là y.
Theo (1): nFe = nAl = x (mol)
Theo (2): nCu = 3/2 nAl = 3/2.y (mol)
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (4)
Theo (3): nNO/( 3) = nFe = x (mol).
Theo (4): nNO/(4) = 2/3 .nCu = 2/3 .x. 3/2 .x .y = y(mol)
⇒ nNO = x + y = 0,03 (mol) ⇒ VNO = 0,03 x 22,4 = 0,672 (lit).
Bài 3: Trộn 5,4g bột Al với 17,4g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng, dư thì thu được 5,376 lít H2 (dktc). Hiệu suất của phản ứng nhiệt nhôm là:
A. 62,5% B. 60% C. 20% D. 80%
Hướng dẫn:
Ta có:
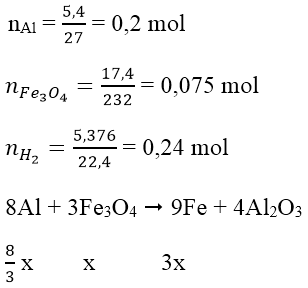
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
Hỗn hợp rắn sau phản ứng gồm Al dư, Fe3O4 dư, Al2O3 và Fe.
Theo phản ứng: nAl phản ứng = 8/3 x mol ⇒ nAl dư = (0,2 - 8/3 x) mol
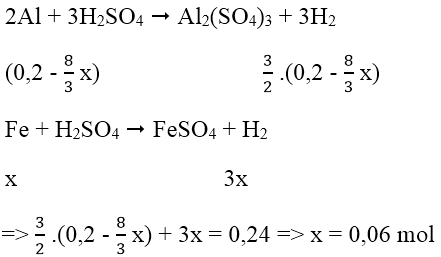
Vậy H = 0,06/0,075.100% = 80%
B. Bài tập trắc nghiệm
Bài 1: Đốt nóng hỗn hợp X gồm Fe2O3 và bột Al trong môi trường không có không khí. Nếu cho những chất còn lại sau phản ứng tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2; còn nếu cho tác dụng với dung dịch HCl dư thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là:
A. 0,3 B. 0,4 C. 0,25 D. 0,6
Lời giải:
Đáp án: A
Khi cho Al phản ứng với NaOH hoặc HCl thì số mol H2 thu được là như nhau:
nH2 = 0,3 mol ⇒ nAl = 0,2 mol
Từ đó suy ra nH2 do Fe tạo ra = 0,4 - 0,3 = 0,1 mol
nFe = 0,1 mol ⇒ nAl đã phản ứng tạo Fe là 0,1 mol vì:
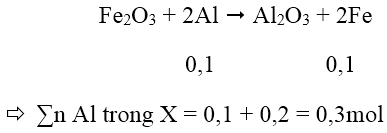
Bài 2: Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3, Fe và Fe3O4
Lời giải:
Đáp án: B
8Al + Fe3O4 −tº→ 4Al2O3↓ + 9Fe
⇒ nFe3O4/nAl = 3/8 < 1/3 ⇒ Al còn Fe3O4 hết
⇒ Hỗn hợp sản phẩm gồm Al2O3, Fe và Al
Bài 3: Nung hỗn hợp gồm 10,8 gam gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại M trong Y là:
A. 5,6 gam
B. 22,4 gam
C. 11,2 gam
D. 16,6 gam
Lời giải:
Đáp án: D
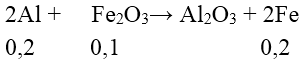
⇒ Khối lượng kim loại trong Y = mFe + mAl dư
= 56.0,2 + 10,8 -27.0,2 = 16,6 g
Bài 4: Trộn 10,8 g bột Al với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiêt nhôm là
A. 80%
B. 90%
C. 70%
D. 60%
Lời giải:
Đáp án: A
Ta có: nAl = 10,8 / 27 = 0,4 mol ;
nFe3O4 = 34,8 / 232 = 0,15 mol
nH2 = 10,752 / 22,4 = 0,48 mol
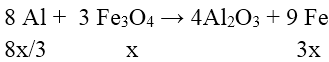
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng :
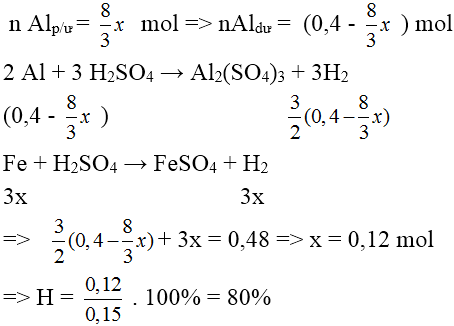
Bài 5: Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g
B. 56,1 g
C. 65,1g
D. 51,6 g
Lời giải:
Đáp án: B
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
Bài 6: Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
A. 75 % và 0,54 mol B. 80 % và 0,52 mol
C. 75 % và 0,52 mol D. 80 % và 0,54 mol
Lời giải:
Đáp án: D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
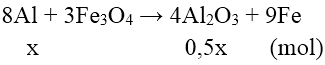
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 → x = 0,16 mol → Hphản ứng = 0,16/0,2 = 80%
BT e ⇒ nH+phản ứng = 2.nFe + 3.n Al + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
→ nH2SO4phản ứng = 1,08/2 = 0,54mol
Bài 7: Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80
Lời giải:
Đáp án: A
nAl dư = 2nH2/ 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100% = 60%
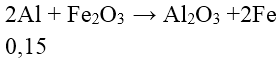
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
Bài 8: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
A. 45,6 gam B. 57,0 gam
C. 48,3 gam D. 36,7 gam
Lời giải:
Đáp án: C
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
- Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
PTHH:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2.3 = 0,6 mol
→ nFe3O4 = 0,15mol
Áp dụng nguyên tố với Fe: n =Fe = 3nFe3O4 = 3.0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam

