Bài tập về Hợp chất của Sắt cực hay, có lời giải chi tiết - Hoá học lớp 12
Bài tập về Hợp chất của Sắt cực hay, có lời giải chi tiết
Với Bài tập về Hợp chất của Sắt cực hay, có lời giải chi tiết Hoá học lớp 12 tổng hợp 30 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hợp chất của Sắt từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

Bài 1:Cho các phản ứng:
(1) Fe3O4 + 4H2SO4(loãng) → FeSO4 + Fe2(SO4)3 + 4H2O
(2) FeO + H2O → Fe(OH)2
(3) Fe(NO3)2 + HCl → FeCl3 + NO + H2O
(4) FeS + H2SO4(đặc nóng) → Fe2(SO4)3 + H2S + H2O
Có bao nhiêu phản ứng viết đúng ?
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
Đáp án: A
(1) Đúng
Bài 2: Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
A. FeO, NO. B. Fe2O3, NO2 và O2.
C. FeO, NO2 và O2. D. FeO, NO và O2.
Lời giải:
Đáp án: B
4Fe(NO3)2 -to→ 2Fe2O3 + 8NO2 + 5O2
Bài 3: Muối sắt được dùng làm chất diệt sâu bọ có hại cho thực vật là
A. FeCl3. B. FeCl2.
C. FeSO4. D. (NH4)SO4. Fe2(SO4)3.24H2O.
Lời giải:
Đáp án: C
Muối FeSO4 được dùng làm chất diệt sâu bọ có hại cho thực vật, pha chế sơn, mực và dùng trong kĩ thuật nhuộm vải.
Bài 4: Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X.
Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
A. FeO. B. Fe3O4.
C. Fe2O3 . D. FeO hoặc Fe2O3.
Lời giải:
Đáp án: B
Dung dịch X phản ứng được với Cu → dung dịch X chứa ion Fe3+
Dung dịch X phản ứng với KMnO4 → dung dịch X chứa ion Fe2+
Vậy oxit sắt có công thức Fe3O4.
Bài 5: Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
- Thêm NaOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
- Cho bột Cu vào phần 2.
- Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá - khử là
A. 2. B. 3.
C. 4. D. 5.
Lời giải:
Đáp án: B
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O (1)
Phần 1:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl (2)
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (3)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (4)
Phần 2:
2FeCl3 + Cu → 2FeCl2 + CuCl2 (5)
Phần 3:
2FeCl2 + Cl2 → 2FeCl3 (6)
Các phản ứng oxi hóa khử là: (4), (5), (6).
Bài 6: Khi điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
A. một lượng sắt dư . B. một lượng kẽm dư.
C. một lượng HCl dư. D. một lượng HNO3 dư.
Lời giải:
Đáp án: A
Dung dịch FeCl2 dễ bị không khí oxi hóa thành muối Fe3+ . Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Không dùng HCl sẽ không ngăn cản quá trình tạo Fe3+.
Bài 7: Một loại quặng trong tự nhiên đã loại bỏ hết tạp chất. Hoà tan quặng này trong axit HNO3 thấy có khí màu nâu bay ra, dung dịch thu được cho tác dụng với dung dịch BaCl2 thấy có kết tủa trắng xuất hiện (không tan trong axit). Quặng đó là
A. Xiđerit. B. Manhetit .
C. Hematit. D. Pirit.
Lời giải:
Đáp án: D
Nhận thấy khi thêm BaCl2 thấy xuất hiện kết tủa trắng không tan trong axit là BaSO4 → Trong dung dịch X chứa ion SO42- → quặng chứa S → quặng pirit FeS2.
Bài 8: Thổi hỗn hợp khí CO và H2 đi qua a gam hỗn hợp gồm CuO và Fe3O4 có tỉ lệ mol 1:2, sau phản ứng thu được b gam chất rắn X. Hòa tan hoàn toàn b gam X bằng dung dịch HNO3 loãng dư, thu được dung dịch Y (không chứa ion Fe2+). Cô cạn dung dịch Y thu được 41 gam muối khan. Giá trị của a là
A. 9,8. B. 10,6.
C. 12,8. D. 13,6.
Lời giải:
Đáp án: D
nCu = a mol;
nFe3O4 = 2a mol;
→ nCu(NO3)2 = a; nFe(NO3)3 = 6a mol
mmuối = mCu(NO3)2 + mFe(NO3)3 → 188a + 242.6a = 41 → a = 0,025 mol
→ a = 0,025.80 + 0,025.2.232 = 13,6 gam.
Bài 9: Dung dịch X gồm FeCl2 và FeCl3 được chia làm hai phần bằng nhau:
Phần 1: Tác dụng với dung dịch NaOH dư ở ngoài không khí thu được 0,5 mol Fe(OH)3.
Phần 2: Tác dụng với dung dịch AgNO3 thu được 1,3 mol AgCl. Tỉ lệ mol của FeCl2 và FeCl3 là
A. 4:1. B. 3:2.
C. 1:4. D. 2:3.
Lời giải:
Đáp án: D
Đặt số mol FeCl2 và số mol FeCl3 trong mỗi phần lần lượt là a và b mol
Phần 1: Bảo toàn Fe có
nFe(OH)3 = nFeCl2 + nFeCl3 → a + b = 0,5
Phần 2: Bảo toàn Cl có
nAgCl = 2.nFeCl2 + 3.nFeCl3 → 2a + 3b = 1,3
Giải hệ phương trình được a = 0,2 và b = 0,3
→ a: b = 2: 3.
Bài 10: Cho m gam Mg vào dung dịch chứa 0,18 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 6,72 gam chất rắn. Giá trị của m là
A. 2,88 gam. B. 4,32 gam.
C. 2,16 gam. D. 5,04 gam.
Lời giải:
Đáp án: D
Nếu Mg dư hoặc vừa đủ:
mchất rắn = mFe + mMg (dư) ≥ nFe = 0,18.56 = 10,08 gam
mà chỉ thua được 6,72 gam chất rắn nên Mg phản ứng hết → nFe = 0,12 mol.
Mg (0,09) + 2Fe3+ (0,18 mol) → Mg2+ + 2Fe2+
Mg (0,12) + Fe2+ → Mg2+ (0,12 mol) + Fe
→ nMg = 0,09 + 0,12 = 0,21 mol → mMg = 0,21.24 = 5,04 gam.
Bài 11: Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được V lít khí NO duy nhất (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được 77,44 gam muối khan. Giá trị của V là
A. 2,688 lít. B. 2,24 lít.
C. 4,48 lít. D. 5,6 lít.
Lời giải:
Đáp án: A
Quy đổi hỗn hợp sắt và oxit sắt thành hỗn hợp gồm Fe (x mol) và O (y mol).
→ 56x + 16y = 22,72.
mmuối = mFe(NO3)3 = 0,32 mol.
Bảo toàn Fe có nFe = x = nmuối = 0,32 mol → y = 0,3 mol.
Áp dụng định luật bảo toàn electron có:
nFe.3 = nO.2 + nNO.3 → nNO = 0,12
→ V = 0,12.22,4 = 2,688 lít.
Bài 12: Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam. B. 23,2 gam.
C. 11,6 gam. D. 34,8 gam.
Lời giải:
Đáp án: A
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4 = nSO42- = naxit = 0,6 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,6: 3 = 0,2 mol
→ m = 0,2.232 = 46,4 gam.
Bài 13: Nung nóng 29 gam oxit sắt với khí CO dư, sau phản ứng, khối lượng chất rắn còn lại là 21 gam. Công thức oxit sắt là
A. FeO. B. Fe3O4.
C. Fe2O3. D. FeO hoặc Fe3O4.
Lời giải:
Đáp án: B
Gọi số mol CO tham gia phản ứng là a → số mol CO2 tạo thành là a mol
Vì lượng CO dư → chất rắn chỉ chứa Fe → nFe = 0,375 mol.
FexOy + yCO → xFe + yCO2
Bảo toàn khối lượng → moxit + mCO = mFe + mCO2 → 29 + 28a = 44a + 21
→ a = 0,5 mol → nO = 0,5 mol
→ nFe: nO = 0,375: 0,5 = 3:4 → Công thức của oxit sắt là Fe3O4.
Bài 14: Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là
A. Fe3O4. B. Fe2O3.
C. FeO. D. không xác định được.
Lời giải:
Đáp án: A
Giả sử oxit sắt gồm FeO a mol và Fe2O3 b mol.
Theo bài ra ta có PTHH:
FeO (a) + H2SO4 (a mol) → FeSO4 + H2O
Fe2O3 (b) + 3H2SO4 (3b mol) → Fe2(SO4)3 + 3H2O
moxit = 25,52 gam → 72x + 160y = 25,52
naxit = 0,44 mol → a + 3b = 0,44
→ a = b = 0,11 mol.
→ Oxit sắt là Fe3O4 (Fe3O4 = FeO.Fe2O3).
Bài 15: Hòa tan m gam hỗn hợp X gồm FeO, Fe(OH)2, FeCO3, Fe2O3, Fe3O4 có cùng số mol tác dụng với dung dịch H2SO4 loãng, dư thu được 1,568 lít khí CO2 (đktc) và dung dịch Y. Dung dịch Y có thể làm mất màu bao nhiêu ml dung dịch KMnO4 1M ?
A. 112 ml. B. 84 ml.
C. 42 ml. D. 56 ml.
Lời giải:
Đáp án:
Gọi số mol các chất trong X đều bằng nhau và đều bằng a mol.
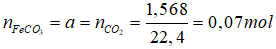
Cho X tác dụng với H2SO4 loãng
FeO (a) + H2SO4 → FeSO4 (a mol) + H2O
Fe(OH)2 (a) + H2SO4 → FeSO4 (a mol) + 2H2O
FeCO3 (a) + H2SO4 → FeSO4 (a) + CO2 (a mol) + H2O
Fe3O4 (a) + 4H2SO4 → FeSO4 (a mol) + Fe2(SO4)3 + 4H2O
∑nFe2+ = 4a = 4 × 0,07 = 0,28 mol.
Cho dung dịch Y tác dụng với KMnO4:
Theo bảo toàn electron: 1 × nFe2+ = 5 × nKMnO4 → nKMnO4 = 0,28: 5 = 0,056 mol
→ VKMnO4 = 0,056: 1 = 0,056 lít = 56ml.
Bài 16: Cho phương trình hóa học sau:
aFeSO4 + bKMnO4 + cH2SO4 → dFe2(SO4)3 + eK2SO4 + fMnSO4 + gH2O.
Tỉ lệ a: b là
A. 5. B. 2,5.
C. 4. D. 3.
Lời giải:
Đáp án: A
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
a: b = 10: 2 = 5.
Bài 17: Cho phản ứng hóa học sau:
FeO + HNO3 → Fe(NO3)3 + NO + H2O
Tổng hệ số cân bằng (là các số nguyên và tối giản) của phản ứng hóa học đó là
A. 15. B. 25.
C. 24. D. 22.
Lời giải:
Đáp án: D
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Tổng hệ số cân bằng = 3 + 10 + 3 + 1 + 5 = 22.
Bài 18: Chất nào sau đây được dùng để pha chế sơn chống gỉ?
A. FeO. B. Fe(OH)2.
C. Fe2O3. D. FeCl3.
Lời giải:
Đáp án: C
Fe2O3 được dùng để pha chế sơn chống gỉ.
Bài 19: Nhiệt phân hoàn toàn chất X trong không khí thu được Fe2O3. Chất X là
A. Fe(NO3)2. B. Fe(OH)2.
C. Fe(NO3)3. D. A, B, C đúng.
Lời giải:
Đáp án: D
Nhiệt phân các chất Fe(NO3)2; Fe(NO3)3 và Fe(OH)2 trong không khí:
4Fe(NO3)2 -to→ 2Fe2O3 + 8NO2 + 5O2
4Fe(NO3)3 -to→ 2Fe2O3 + 12NO2 + 3O2
O2 + 4Fe(OH)2 -to→ 2Fe2O3 + 4H2O
Bài 20: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 5. B. 6.
C. 8. D. 7.
Lời giải:
Đáp án: D
Phản ứng của các chất Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3 với HNO3 đặc, nóng đều là phản ứng oxi hóa – khử.
Bài 21: Phản ứng nào sau đây chứng minh hợp chất Fe(II) có tính khử?
A. 3 FeO + 10 HNO3 → 3 Fe(NO3)3 + 5 H2O + NO
B. Fe(OH)2 + 2 HCl → FeCl2 + 2 H2O.
C. FeCl2 + 2 NaOH → Fe(OH)2 + 2 NaCl
D. FeO + CO → Fe + CO2.
Lời giải:
Đáp án: A
3 FeO + 10 HNO3 → 3 Fe(NO3)3 + 5 H2O + NO
Số oxi hóa của Fe tăng từ +2 lên +3 do đó FeO có tính khử.
Bài 22:Cho 17,4g FeCO3 tác dụng với dung dịch HNO3 dư thu được V lít khí (đktc, NO là sản phẩm khử duy nhất). Giá trị của V là
A. 4,48. B. 5,6.
C. 6,72. D. 8,96.
Lời giải:
Đáp án: A
3FeCO3 (0,15) + 10HNO3 → 3Fe(NO3)3 + NO (0,05) + 3CO2 (0,15) + 5H2O
nkhí = 0,05 + 0,15 = 0,2 mol → V = 0,2.22,4 = 4,48 lít.
Bài 23: Để thu được kim loại Fe từ dung dịch Fe(NO3)2 theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây:
A. Zn. B. Fe.
C. Na. D. Ca.
Lời giải:
Đáp án: A
Zn + Fe(NO3)2 → Zn(NO3)2 + Fe.
Bài 24: Cho hỗn hợp X gồm Fe3O4, Cu vào dung dịch HCl dư thấy còn một phần chất rắn chưa tan. Vậy các chất tan trong dung dịch sau phản ứng là:
A. FeCl3, FeCl2, HCl. B. FeCl3, FeCl2, CuCl2.
C. FeCl2, CuCl2, HCl. D. FeCl3, CuCl2, HCl.
Lời giải:
Đáp án: C
Sau phản ứng còn Cu chưa tan, dung dịch sau phản ứng chứa FeCl2, CuCl2 và HCl dư.
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Bài 25: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư), thu được dung dịch X. Trong các chất: H2S, NaOH, Cu, Fe(NO3)2, KMnO4, BaCl2, Cl2 và Al; số chất có khả năng phản ứng được với dung dịch X là
A. 8. B. 7.
C. 6. D. 5.
Lời giải:
Đáp án: A
Dung dịch X gồm Fe2+; Fe3+; H+; SO42-
Các chất thỏa mãn: H2S, NaOH, Cu, Fe(NO3)2, KMnO4, BaCl2, Cl2 và Al
Bài 26: Khử hoàn toàn 2,32 gam Fe3O4 bằng CO dư, thu được chất rắn X. Hoà tan X bằng dung dịch HCl dư, thu được V ml H2 (đktc). Giá trị của V là:
A. 0,448. B. 0,672.
C. 448. D. 672.
Lời giải:
Đáp án: D
-BTe→ nH2 = nFe = 3nFe3O4 = 0,03 → V = 0,03.22,4 = 0,672l = 672 ml
Bài 27: Thành phần chính của quặng manhetit là
A. FeCO3. B. Fe2O3.
C. FeS2. D. Fe3O4.
Lời giải:
Đáp án: D
Bài 28: Khi nung nóng Fe với chất nào sau đây thì tạo ra hợp chất sắt (II) ?
A. S. B. Dung dịch HNO3.
C. O2. D. Cl2.
Lời giải:
Đáp án: A
Fe + S → FeS.
Bài 29: Dung dịch Fe2(SO4)3 không phản ứng với chất nào sau đây?
A. NaOH. B. Ag.
C. BaCl2. D. Fe.
Lời giải:
Đáp án: B
Bài 30: Trường hợp không đúng giữa tên quặng sắt và hợp chất sắt chính có trong quặng sắt là
A. hematit nâu chứa Fe2O3. B. manhetit chứa Fe3O4.
C. xiderit chứa FeCO3. D. pirit chứa FeS2.
Lời giải:
Đáp án: 4
Hematit nâu chứa Fe2O3.nH2O.

