Bài toán sắt tác dụng với dung dịch muối hay, chi tiết - Hoá học lớp 12
Bài toán sắt tác dụng với dung dịch muối hay, chi tiết
Với Bài toán sắt tác dụng với dung dịch muối hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập sắt tác dụng với dung dịch muối từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

1. Phương pháp
- Vận dụng ý nghĩa của dãy điện thế cực chuẩn: Cr, Fe, Cu có thể đẩy kim loại yếu hơn ra khỏi muối như Ag, Hg…
Fe + Cu2+ → Fe2+ + Cu
Fedư + 2Ag+ → Fe2+ + 2Ag
Fe + 3Ag+dư → Fe3+ + 3Ag
- Với dạng bài tập: từ kim loại mạnh, tạo thành kim loại yếu hơn, có sự thay đổi về khối lượng nên vận dụng phương pháp tăng giảm khối lượng.
* Phương pháp tăng giảm khối lượng: Từ độ tăng( giảm) theo đề và tăng (giảm) theo PTHH ta tìm được số mol của các chất
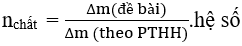
Nếu gặp trường hợp một kim loại tác dụng với hỗn hợp muối ( hoặc ngược lại ) thì phản ứng nào có khoảng cách giữa 2 kim loại xa hơn thì sẽ xảy ra trước. Khi phản ứng này kết thúc thì mới xảy ra các phản ứng khác.
Ví dụ: Cho hỗn hợp Fe và Cu vào dung dịch AgNO3 thì Fe phản ứng trước, Cu phản ứng sau (vì nếu còn Fe thì không thể tồn tại muối của Cu )
* Phương pháp tăng giảm khối lượng vẫn có thể áp dụng trong trường hợp bài tập vừa có phản ứng tăng, vừa có phản ứng giảm:
Cho Fe và Zn tác dụng với Cu(NO3)2 thì độ tăng khối lượng:
Δm = |mFe + mZn - mCu| (không cần tính riêng theo từng phản ứng)
2. Ví dụ minh họa
Ví dụ 1: Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Lời giải:
Chọn đáp án: B
Giải thích:
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
(mol) a a
mtăng = (64 - 56). a = 1 => a = 0,125 mol
nFe = 0,125mol => nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
%mFe = (0,125×56)/15. 100% = 46,67%
=> %mCu = 53,33%
Ví dụ 2: Hòa tan hoàn toàn 28g Fe vào dung dịch AgNO3 dư thì khối lượng chất rắn thu được là bao nhiêu?
A. 108g
B. 10,8 g
C. 162 g
D. 21,6g
Lời giải:
Chọn đáp án: C
Giải thích:
nFe = 0,5 mol
Do Ag+ dư nên phản ứng tạo muối Fe3+
Fe + 3Ag+ → Fe3+ + 3Ag
=> nAg = 3. nFe = 3. 0,5 = 1,5 mol
=> mAg = 1,5.108 = 162 g
3. Bài tập vận dụng
Câu 1: Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4 khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
A. 0,1M
B. 0,15M
C. 0,12M
D. 0,2M
Lời giải:
Chọn đáp án: A
Giải thích:
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol => nCuSO4 = 0,1 mol
Từ (1) => 0,1 mol Mg tác dụng với 0,1 mol CuSO4, sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng: 0,01. (64 – 24) = 0,4 (gam)
=> Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng:
0,52 – 0,4 = 0,12 g
Fe + CuSO4 → FeSO4 + Cu (2)
=> nCuSO4 (2) = (1 × 0,12)/(64 - 56) = 0,015 mol
=> CM(CuSO4) = (0,01 + 0,015)/0,25 = 0,1 (mol/l)
Câu 2: Cho một hỗn hợp gồm có 1,12 gam Fe và 0,24 gam Mg tác dụng với 250 ml dung dịch CuSO4. Phản ứng thực hiện xong, người ta thu được kim loại có khối lượng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 đã dùng.
A. 0,1M
B. 0,12M
C. 0,2M
D. 0,05M
Lời giải:
Chọn đáp án: A
Giải thích:
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là: 0,03. 64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 - 0,64 = 1,24 (gam)
Đặt mFe (2) = x
=> mFe (dư) = (1,12 – 56x) và mCu (2) = 64x.
Ta có: (1,12 - 56x) + 64x = 1,24 => x = 0,015
nCuSO4 = 0,015 + 0,01 = 0,025(mol)
CM (CuSO4) = 0,025/0,25 = 0,1 mol/l
Câu 3: Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu đựơc m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (đktc). Giá trị của m1 và m2 lần lượt là:
A. 8,10 và 5,43
B. 1,08 và 5,16
C. 0,54 và 5,16
D. 1,08 và 5,43.
Lời giải:
Chọn đáp án:
Giải thích:
Ta có: nCu(NO3)2 = 0,03 mol; nAgNO3 = 0,03 mol; nH2 = 0,015 mol
Chất rắn X + dd HCl dư → H2 => trong chất rắn X có Al dư
=> Cu(NO3)2 và AgNO3 hết
2Aldư + 6HCl → 2AlCl3 + 3H2
0,01 0,015 mol
Al phản ứng hết với dd Cu(NO3)2 và AgNO3
Quá trình nhận e:
Ag+ + 1e → Ag
0,03 0,03 0,03
Cu2+ + 2e → Cu
0,03 0,06 0,03
Tổng số mol e nhận = 0,06 + 0,03 = 0,09 mol
Quá trình nhường e:
Al - 3e → Al3+
0,03 0,03 0,03
Vậy m2 = mAl dư + mCu + mAg = 0,01. 27 + 0,03. 64 + 0,03. 108 = 5,43 gam
m1 = mAl ban đầu = (0,01 + 0,03). 27 = 1,08g
Câu 4: Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g
B. 4,4g
C. 4,08g
D. 5,4g
Lời giải:
Chọn đáp án: C
Giải thích:
Phản ứng xảy ra theo thứ tự:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
0,01 0,02 0,02
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
0,03 0,03 0,03
⇒ Fe tan hết
m = 0,02. 108 + 0,03. 64 = 4,08 (g)
Câu 5: Cho m g bột Fe vào 200ml dung dịch 2 muối AgNO3 0,15M và Cu(NO3)2 0,1 M, sau 1 thời gian thu được 3,84g hỗn hợp kim loại và dung dịch X. Cho 3,25g bột Zn vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 3,895g hỗn hợp kim loại và dung dịch Y. Giá trị của m là:
A. 0,56
B. 1,435
C. 2,8
D. 2,24
Lời giải:
Chọn đáp án: D
Giải thích:
nAgNO3 = 0,03 mol và nCu(NO3)2 = 0,02 mol => nNO3- = 0,07 mol
nZn = 0,05mol > 1/2. nNO3- nên Zn dư
nZn phản ứng = 1/2. nNO3- = 0,035mol
Bảo toàn khối lượng cho kim loại:
m + 0,03. 108 + 0,02. 64 + 3,25 = 3,84 + 3,895 + 0,035. 65
=> m = 2,24
Câu 6: Cho đinh sắt vào 200ml dung dịch CuSO4 sau phản ứng thấy khối lượng đinh sắt tăng thêm 1,6g. Tính nồng độ CuSO4 ban đầu?
A. 0,2M
B. 0,5M
C. 1M
D. 0,4M
Lời giải:
Chọn đáp án: C
Giải thích:
Fe + CuSO4 → FeSO4 + Cu
Cứ 1 mol Fe phản ứng với 1 mol Cu2+ thì khối lượng tăng 8g
=> nCu2+ = 1,6/8 = 0,2 mol
CM (CuSO4) = 0,2/0,2 = 1M

