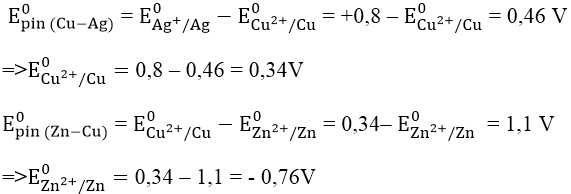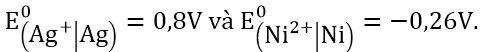Cách giải các dạng bài tập về dãy điện hóa kim loại hay, chi tiết - Hoá học lớp 12
Cách giải các dạng bài tập về dãy điện hóa kim loại hay, chi tiết
Với Cách giải các dạng bài tập về dãy điện hóa kim loại hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập dãy điện hóa kim loại từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Xác định thế điện cực chuẩn, suất điện động chuẩn của pin điện hóa
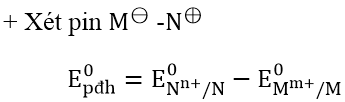
+ Chiều phản ứng: Viết cặp oxi hóa - khử có thế điện cực nhỏ ở bên trái, cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình phản ứng oxi hóa - khử theo quy tắc α.
Ví dụ minh họa
Bài 1: Tính thế điện cực chuẩn E0 của những cặp oxi hóa khử sau:
a. E0 (Cr3+/Cr), biết suất điện động chuẩn của pin điện hóa Cr -Ni là +0,51V và E0 (Ni2+/Ni) = -0,23V.
b. E0 (Mn2+/Mn), biết suất điện động chuẩn của pin điện hóa Cd -Mn là +0,79V và E0 (Cd2+/Cd) = -0,40V.
Hướng dẫn:
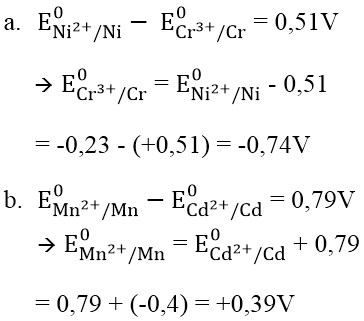
Bài 2: Biết phản ứng oxi hóa khử xảy ra trong một pin điện hóa là:
Fe + Ni2+ → Fe2+ + Ni
a. Hãy xác định các điện cực âm và dương của pin điện hóa.
b. Viết các phản ứng oxi hóa và phản ứng khử xảy ra trên mỗi điện cực.
c. Tính suất điện động chuẩn pin điện hóa.
Hướng dẫn:
a. Ni (+); Fe (-)
b. Phản ứng trên các điện cực:
Cực (-): Fe → Fe2+ + 2e
Cực (+): Ni2+ + 2e → Ni
c. E0pin = -0,23 - (-0,44) = 0,21 V
Bài 3: Tính thế điện cực chuẩn E0 của các cặp oxi hóa khử sau:
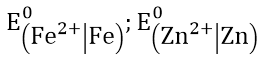
Hướng dẫn:
+) Pin điện hóa Fe – Ni: cực (-) là Fe; cực dương (+) là Ni
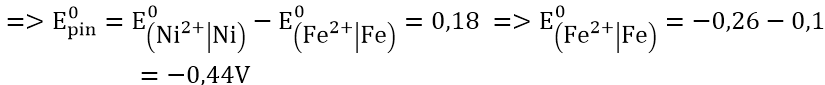
+) Pin điện hóa Zn – Ag: cực (-) là Zn; cực (+) là Ag.
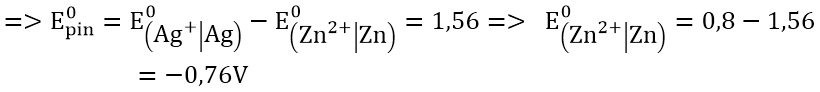
B. Bài tập trắc nghiệm
Bài 1: Cho pin điện hóa 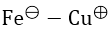
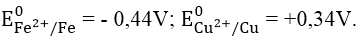
A. 0,78V B. - 0,78V C. - 0,1V D. 0,2V
Lời giải:
Đáp án: A
Ta có: E0pđh = E0Cu2+/Cu - E0Fe2+/Fe = 0,34 - (-0,44) = 0,78V
Bài 2: Cho E0pđh của pin được tạo bởi giữa Sn2+/Sn và Ag+/Ag là 0,94V. Biết E0Ag+/Ag = 0,8V. Vậy E0Sn2+/Sn có giá trị là:
A. -1,74V B. 1,74V C. -0,14V D. 0,14V
Lời giải:
Đáp án: C
Ta có:
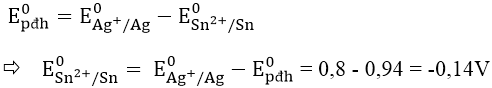
Bài 3: Cho suất điện động chuẩn của các pin điện hóa: Zn - Cu là 1,1V; Cu - Ag là 0,46V. Biết thể tích điện cực chuẩn E0Ag+/Ag = + 0,8V. Thế điện cực chuẩn E0Zn2+/Zn và E0Cu2+/Cu có giá trị lần lượt là:
A. -0,76V và +0,34V B. -1,46V và -0,34V
C. +1,56V và +0,64V D. -1,56V và +0,64V
Lời giải:
Đáp án: A
Ta có:
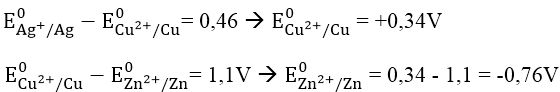
Bài 4: Biết E0Ag+/Ag = + 0,8V, E0Fe3+/Fe2+ =0,77V
Vậy nhận định nào sau đây đúng?
A. Ion Fe3+ oxi hóa được Ag. B. Ion Fe2+ bị oxi hóa bởi Ag+.
C. Ion Ag+ bị khử bởi ion Fe3+. D. Ion Fe2+ oxi hóa được Ag.
Lời giải:
Đáp án: B
Dựa vào E0 ta có thể viết phương trình phản ứng:
Ag+ + Fe2+ → Fe3+ + Ag↓
Bài 5: Tính thế điện cực chuẩn của cặp oxi hóa - khử sau:
E0Zn2+/Zn, biết rằng E0pin(Zn-Cu) = 1,10V và E0Cu2+/Cu = +0,34V.
A. -0,76V B. 0,42 V C. -0,38 V D. 0,24V
Lời giải:
Đáp án: A
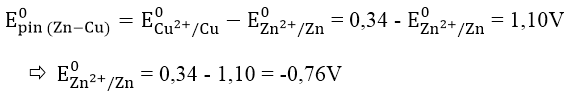
Bài 6: Có pin điện hóa được tạo thành từ những cặp oxi hóa - khử sau:
Fe2+/Fe và Ag+/Ag
Hãy tính suất điện động của mỗi pin điện hóa, biết rằng:
E0Ag+/Ag = + 0,8V; E0Fe2+/Fe = -0,44V.
A. 0,36V B. -1,24V C. 1,24V D. -0,36V
Lời giải:
Đáp án: C
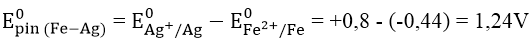
Bài 7: Cho suất điện động chuẩn E0 của các pin điện hóa: E0 (Cu - X) = 0,46V; E0 (Y - Cu) = 1,1V; E0 (Z - Cu) = 0,47V (X, Y, Z là ba kim loại). Dãy các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là:
A. Z, Y, Cu, X B. X, Cu, Z, y C. Y, Z, Cu, X D. X, Cu, Y, Z
Lời giải:
Đáp án: B
E0 (Cu - X) = 0,46V > 0 → Tính khử của X < Cu
E0 (Y - Cu) = 1,1V > E0 (Z - Cu) = 0,47V > 0 → Tính khử của Y > Z > Cu.
Tóm lại: tính khử tăng dần theo chiều X, Cu, Z, Y.
Bài 8: Cho suất điện động chuẩn của các pin điện hóa: Zn-Cu là 1,1V; Cu-Ag là 0,46V. Biết thế điện cực chuẩn E0Ag+/Ag = +0,8V. Thế điện cực chuẩn E0Zn2+/Zn và E0Cu2+/Cu lần lượt là:
A. -0,76V và +0,34V.
B. -1,46V và -0,34V.
C. +1,56V và +0,64V.
D. -1,56V và +0,64V.
Lời giải:
Đáp án: A