Cách giải Bài tập về muối của Fe, Cu, Ag, Zn hay, chi tiết - Hoá học lớp 12
Cách giải Bài tập về muối của Fe, Cu, Ag, Zn hay, chi tiết
Với Cách giải Bài tập về muối của Fe, Cu, Ag, Zn hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập muối của Fe, Cu, Ag, Zn từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

I. Ví dụ minh hoạ
Ví dụ 1: Cho m gam bột Cu vào 200 ml dung dịch AgNO3 0,2M. sau một thời gian thu được 3,12 gam chất rắn X và dung dịch Y. Cho 1,95 gam bột Zn vào dung dịch Y đến phản ứng hoàn toàn thu được 3,45 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất. Giá trị của m là
Lời giải:
Giải thích:
Bảo toàn N: nAgNO3 = 0,04mol → nZn(NO3)2 = 0,02 mol
Bảo toàn khối lượng cho kim loại:
m + 0,04. 108 + 1,95 = 3,12 + 3,45 + 0,02.65
→ m = 1,6 gam
Ví dụ 2: Sục khí H2S dư vào dung dịch muối có chứa m gam hỗn hợp gồm CuCl2 và FeCl3 lọc tách được 0,3 mol hỗn hợp chất kết tủa và dung dịch X. Cho dung dịch KOH dư vào dung dịch X. Lọc kết tủa nung ngoài không khí được 32 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Lời giải:
Giải thích:
FeCl3 + H2S → FeCl2 + S + HCl
→ kết tủa có CuS và S
32 gam chất rắn là Fe2O3 với n = 0,2 mol
→ nS = 0,2 mol → nCuS = 0,1 mol
→ m = 78,5 g
Ví dụ 3: Hoà tan 5,64g Cu(NO3)2 và 1,7g AgNO3 vào nước được 101,43g dung dịch A. Cho 1,57g hỗn hợp X bột kim loại gồm Zn và Al vào dung dịch A rồi khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn thu được phần rắn B và dung dịch D chỉ chứa 2 muối. Ngâm B trong dung dịch H2SO4 loãng không thấy có khí thoát ra. Tính C% mỗi muối có trong dung dịch D
Lời giải:
Giải thích:
Dung dịch sau phản ứng chỉ có 2 muối và hỗn hợp chất rắn không tan suy ra phản ứng vừa đủ
Gọi a,b là số mol của Zn và Al → 65a + 27b = 1,57
nCu+ = 0,03; nAg+ = 0,01 → ne = 0,07
→ 2a + 3b = 0,07
→ a = 0,02mol; b = 0,01 mol
→ mZn(NO3)2 = 3,78gam; mAl(NO3)3 = 2,13 gam
mdd = 101,43 – 64. 0,03 – 108. 0,01 + 65. 0,02 + 27. 0,01 = 100
→ % mZn(NO3)2 = 3,78%
% mAl(NO3)3 = 2,13%
II. Bài tập vận dụng
Câu 1: Khi cho từ từ dung dịch NH3 vào dung dịch CuSO4 cho đến dư thì:
A. Sau một thời gian mới thấy kết tủa xuất hiện.
B. Không thấy kết tủa xuất hiện.
C. Có kết tủa xanh xuất hiện sau đó tan ra.
D. Có kết tủa xanh xuất hiện và không tan.
Lời giải:
Chọn đáp án: C
Giải thích:
+ Quá trình 1: 2NH3 + Cu2+ + 2H2O → Cu(OH)2↓ + 2NH4+
+ Quá trình 2: 4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2.
Hiện tượng quan sát được: Ban đầu xuất hiện kết tủa màu xanh Cu(OH)2 sau đó kết tủa tan ra.
Giải thích quá trình 2: Sở dĩ NH3 còn đôi e chưa tham gia liên kết, ion Cu2+ còn obitan trống nên hai phân tử này kết hợp với nhau bằng các liên kết cho nhân tạo hợp chất phức.
Câu 2: Nung 22,8 gam hỗn hợp X gồm Cu(NO3)2 và CuO trong khí trơ. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn Y. Cho toàn bộ Y phản ứng vừa đủ với 300 ml dung dịch HCl 1M. Phần trăm khối lượng của CuO trong X là:
A. 17,54%.
B. 35,08%.
C. 52,63%.
D. 87,72%.
Lời giải:
Chọn đáp án: A
Giải thích:
Nhiệt phân: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
Với axit: CuO + 2HCl → CuCl2 + H2O
→ nCuO + nCu(NO3)2 = 0,5nHCl = 0,15 mol
80. nCuO + 188. nCu(NO3)2 = 22,8 g
→ nCuO = 0,05 mol; nCu(NO3)2 = 0,1 mol
→ %mCuO (X) = 17,54%
Câu 3: Ngâm một vật bằng Cu có khối lượng 15 gam trong 340 gam dung dịch AgNO3 6%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 25%. Khối lượng vật sau phản ứng là giá trị nào sau đây?
A. 10,76 gam.
B. 21,52 gam.
C. 17,28 gam.
D. 12,56 gam.
Lời giải:
Chọn đáp án: C
Giải thích:
phản ứng Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
ban đầu có nAgNO3 ban đầu = (340. 0,06)/170 = 0,12 mol.
khối lượng AgNO3 giảm 25% tức đã phản ứng 0,25. 0,12 = 0,03 mol.
Nghĩa là có 0,015 mol Cu phản ứng với 0,03 mol AgNO3
→ mvật Cu sau phản ứng = 15 – 0,015. 64 + 0,03. 108 = 17,28 gam.
Câu 4: Cho NH3 đến dư vào dd hỗn hợp AlCl3 và ZnCl2 thu được kết tủa X. Nung X đến khối lượng không đổi được chất rắn Y. Cho H2 dư đi qua Y được chất rắn Z. Z chứa:
A. ZnO và Al
B. Zn và Al2O3
C. Al2O3
D. ZnO và Al2O3
Lời giải:
Chọn đáp án: C
Giải thích:
(AlCl3, ZnCl2)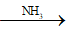

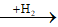
Do Zn2+ tạo phức vơi NH3 nên chất rắn Y chỉ có Al(OH)3
Câu 5: Điện phân 200 ml một dung dịch chứa 2 muối là Cu(NO3)2, AgNO3 với cường độ dòng điện là 0,804A đến khi bọt khí bắt đầu thoát ra ở cực âm thì mất thời gian là 2 giờ, khi đó khối lượng của cực âm tăng thêm 4,2 gam. Nồng độ mol của Cu(NO3)2 trong dung dịch ban đầu là
A. 0,075M.
B. 0,1M.
C. 0,05M.
D. 0,15M.
Lời giải:
Chọn đáp án: A
Giải thích:
Khi bọt khí bắt đầu thoát ra ở catot thì Ag+: x mol và Cu2+: y mol đều bị điện phân hết.
Khối lượng catot tăng thêm 4,2 gam → 4,2 = 108x + 64y
Số electron trao đổi trong quá trình điện phân là ne = (0,804. 2. 3600)/96500 = 0,06 mol
→ x + 2y = 0,06
Giải hệ → x = 0,03 và y = 0,015
Nồng độ mol của Cu(NO3)2 trong dung dịch X là: 0,015: 2 = 0,075M
Câu 6: Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 4 B. 2
C. 3 D. 1
Lời giải:
Chọn đáp án: D
Giải thích:
2Cu(NO3)2 →t o 2CuO + 4NO2 + O2
4NO2 + O2 + 2H2O → 4HNO3
Gọi số mol NO2 là 4x , số mol của O2 là x mol
→ 46. 4x + 32. x = 6,58 - 4,96 → x = 0,0075 mol
→ nHNO3 = nNO2 = 4x = 0,03 mol
→ pH = -log[H+]= -log 0,1 = 1.
Câu 7: Cho các phản ứng xảy ra sau đây:
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
(2) Mn + 2HCl → MnCl2 + H2↑
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là
A. Ag+, Mn2+, H+, Fe3+.
B. Mn2+, H+, Ag+, Fe3+.
C. Ag+, Fe3+, H+, Mn2+.
D. Mn2+, H+, Fe3+, Ag+.
Lời giải:
Chọn đáp án: D
Giải thích:
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ → tính oxi háo của Fe3+ < Ag+
(2) Mn + 2HCl → MnCl2 + H2↑ tính oxi hóa của Mn2+ < H+
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là Mn2+, H+, Fe3+, Ag+.
Câu 8: Cho 18,4 gam hỗn hợp X gồm Cu2S, CuS, FeS2 và FeS tác dụng hết với HNO3 (đặc nóng dư) thu được V lít khí chỉ có NO2 (ở đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 46,6 gam kết tủa, còn khi cho toàn bộ Y tác dụng với dung dịch NH3 dư thu được 10,7 gam kết tủa. Giá trị của V là
A. 38,08
B. 11,2
C. 24,64
D. 16,8
Lời giải:
Chọn đáp án: A
Giải thích:
BTNT: nS = nBaSO4 = 0,2 mol
nFe = nFe(OH)3 = 0,1mol
→ nCu = 0,1 mol
Bảo toàn electron:
6nS + 3nFe + 2nCu = nNO2
→ nNO2 = 1,7 mol
→ V = 38,08 lít

