Cách giải bài tập Tính oxi hóa của hợp chất Crom 6 (VI) hay, chi tiết - Hoá học lớp 12
Cách giải bài tập Tính oxi hóa của hợp chất Crom 6 (VI) hay, chi tiết
Với Cách giải bài tập Tính oxi hóa của hợp chất Crom 6 (VI) hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Tính oxi hóa của hợp chất Crom 6 (VI) từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

I. Phương pháp
1. Oxit Cr2O3
Cr2O3 là một oxit axit, tác dụng với nước tạo ra axit:
CrO3 + H2O → H2CrO4: ax cromic
2CrO3 + H2O → H2Cr2O7: ax đicromic
CrO3 có tính oxi hóa mạnh, một số chất vô cơ và hữu cơ như S, P, C, C2H5OH bốc cháy khi tiếp xúc với CrO3
2. Muối crom (VI)
- Muối cromat: natri cromat Na2CrO4 và kali cromat K2CrO4 là muối của axit cromic, có màu vàng của ion cromat CrO42-
- Muối đicromat: natri cromat Na2Cr2O7 và kali đicromat K2Cr2O7 là muối của axit đicromat, có màu da cam của ion đicrom Cr2O72-
+ Trong môi trường axit: 2CrO42- + 2H+ → Cr2O72- + H2O
Cromat(màu vàng), chuyển hóa thành đicromat (màu da cam)
+ Trong môi trường kiềm: Cr2O72- + 2OH- → 2CrO42- + H2O
Đicromat (màu da cam), chuyển hóa thành cromat (màu vàng)
- Tính oxi hóa của muối cromat và đicromat
Các muối cromat và đioxit có tính oxi hóa mạnh, muối crom (VI) bị khử thành muối crom (III).
+ Trong môi trường H+ (H2SO4): Cr+6 → Cr2(SO4)3
Ví dụ: K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 +7H2O
+ Trong môi trường trung tính hoặc bazo: Cr+6 → Cr(OH)3
Ví dụ: K2Cr2O7 + 3H2S + H2O → 2Cr(OH)3 + 3S + 2KOH
II. Bài tập minh họa
Câu 1: Cho 17g H2S tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được 1 đơn chất. Tính khối lượng đơn chất thu được?
A. 16g
B. 32g
C. 4,8g
D. 8g
Lời giải:
Chọn đáp án: A
Giải thích:
K2Cr2O7 + 3H2S + H2O → 2Cr(OH)3 + 3S + 2KOH
nH2S = 0,5 mol
nS = nH2S = 0,5 mol => mS = 0,5. 32 = 16g
Câu 2: Trong dung dịch 2 ion cromat và đicromat cho cân bằng thuận nghịch:
2CrO42- + 2H+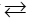
Hãy chọn phát biểu đúng:
A. dd có màu da cam trong môi trường bazơ.
B. ion CrO42- bền trong môi trường axit
C. ion Cr2O72- bền trong môi trường bazơ.
D. dung dịch có màu da cam trong môi trường axit
Lời giải:
Chọn đáp án: D
Giải thích:
CrO42- bền trong môi trường bazơ có màu vàng.
Cr2O72- bền trong môi trường axit có màu da cam
Câu 3: Khối lượng K2Cr2O7 tác dụng vừa đủ với 0,6 mol FeSO4 trong H2SO4 loãng là
A. 26,4 gam.
B. 27,4 gam.
C. 28,4 gam.
D. 29,4 gam.
Lời giải:
Chọn đáp án: D
Giải thích:
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Bảo toàn e: 6. nK2Cr2O7 = 1. nFeSO4
=> nK2Cr2O7 = 0,6/6 = 0,1 mol
=> mK2Cr2O7 = 0,1. 294 = 29,4 gam
Câu 4: Để oxi hóa hoàn toàn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi có mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng là:
A. 0,015 mol và 0,04 mol
B. 0,015 mol và 0,08 mol
C. 0,03 mol và 0,08 mol
D. 0,03 mol và 0,04 mol
Lời giải:
Chọn đáp án: B
Giải thích:
2CrCl3 + 3Cl2 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
0,01 0,015 0,08
nKOH = 8. nCrCl3 = 0,08 mol
nCl2 = 3/2. nCrCl3 = 0,015 mol

