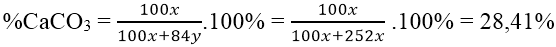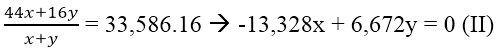Cách giải các dạng bài tập về muối cacbonat hay, chi tiết - Hoá học lớp 12
Cách giải các dạng bài tập về muối cacbonat hay, chi tiết
Với Cách giải các dạng bài tập về muối cacbonat hay, chi tiết Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập muối cacbonat từ đó đạt điểm cao trong bài thi môn Hoá học lớp 12.

A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Có 2 dạng thường gặp: phản ứng nhiệt phân và phản ứng trao đổi (với axit → khí; với muối → kết tủa)
* Lưu ý: Khi cho từ từ dung dịch HCl vào hỗn hợp muối cacbonat và hiđro cacbonat, phản ứng xảy ra theo trình tự:
Đầu tiên: H+ + CO2-3 → HCO-3
Sau đó: HCO-3 + H+ → CO2 + H2O
Ví dụ minh họa
Bài 1: Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
A. 0,03 B. 0,01 C. 0,02 D. 0,015
Hướng dẫn:
Ta có: nHCl = 0,03 mol; nNa2CO3 = 0,02 mol; nNaHCO3 = 0,02 mol
Pứ:
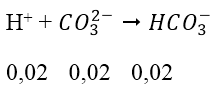
nH+ còn = 0,01 mol và trong dd đang có nHCO-3 = 0,02 + 0,02 = 0,04 mol
Do H+ dư nên tiếp tục xảy ra phản ứng:
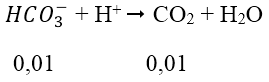
Đáp án B.
Bài 2: Cho 19,2 gam hỗn hợp muối cacbonat của kim loại hóa trị I và muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl dư, thu được 4,48 lít một chất khí (đktc). Tính khối lượng muối tạo ra trong dung dịch.
Hướng dẫn:
Gọi công thức hai muối cacbonat là M2CO3 và M'CO3
M2CO3 + 2HCl → 2MCl + CO2 + H2 O
M'CO3 + 2HCl → M'Cl2 + CO2 + H2 O
Áp dụng phương pháp tăng giảm khối lượng:
1 mol muối cacbonnat tạo thành muối clorua ⇒ khối lượng tăng.
35,5 .2 – 60 = 11 (gam) ⇒ nCO2 = nmuối cacbonat = 0,2(mol)
⇒ mmuối clorua = mmuối cacbonlat + 0,2.11 = 19,2 + 2,2 = 21,4(gam)
Bài 3: Khi nung 30 gam hỗn hợp CaCO3 và MgCO3 thì khối lượng chất rắn thu được sau phản ứng chỉ bằng một nửa khối lượng ban đầu. Tính thành phần % theo khối lượng các chất ban đầu:
A. 28,41% và 71,59% B. 13% và 87%
C. 40% và 60% D. 50,87% và 49,13%
Hướng dẫn:
Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
PTP Ư:
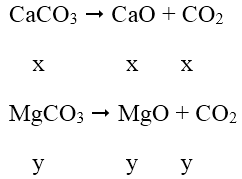
Theo đề bài ta có phương trình: 56x + 40y = (100x + 4y)/2
Hay x/y = 1/3
Vậy:
%MgCO3 = 100% - 28,41%
B. Bài tập trắc nghiệm
Bài 1: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M, KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là :
A. 4,48
B. 3,36
C. 2,24
D. 1,12
Lời giải:
Đáp án: D
nCO32- = 0,15 mol ; nHCO3- = 0,1 mol ; nH+ = 0,2 mol
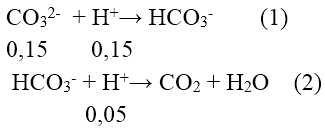
Nhỏ từ từ từng giọt HCl nên phản ứng xảy ra theo trình tự
Sau phản ứng (1) nH+ còn: 0,2 - 0,15 = 0,05 (mol) nên HCO3- dư.
⇒ VCO2 = 0,05.22,4 = 1,12 lít
Bài 2: Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối (CaCO3 và MgCO3) trong hỗn hợp là phương án nào sau đây?
A. 35,2% và 64,8% B. 70,4% và 29,6%
C. 85,49% và 14,51% D. 17,6% và 82,4%
Lời giải:
Đáp án: B
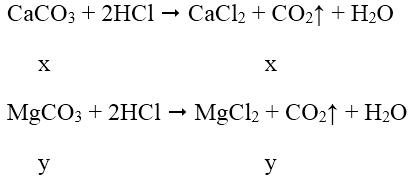
Số mol CO2 là nCO2 = 0,672/22,4 = 0,03 mol
Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
Theo bài ra ta có hệ pt:
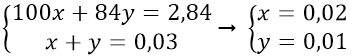
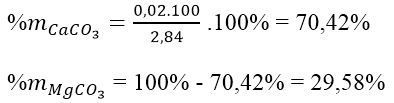
Bài 3: Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00
B. 0,75
C. 1,25
D. 1,00
Lời giải:
Đáp án: C
nOH- = nNaOH + 2nCa(OH)2 = 0,05 mol
nCO2 = 0,672/22,4 = 0,03 mol
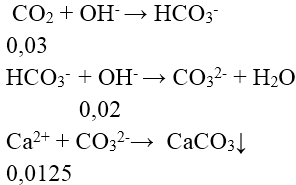
⇒ x = 0,0125.100 = 1,25 g
Bài 4: Cho 3,9 gam hỗn hợp 2 muối Na2CO3 và K2SO3 tác dụng với 200 ml dung dịch HCl, ta thu được một hỗn hợp khí A có tỉ khối hơi so với metan là 3,583 và dung dịch B. Để trung hòa lượng axit còn dư trong dung dịch B ta phải dùng hết 100 ml dung dịch Ba(OH)2 0,2M. Vậy % Na2CO3 và K2SO3 trong hỗn hợp ban đầu là:
A. 60,5% và 39,5%
B. 64% và 36%
C. 64,6% và 35,4%
D. 25,14% và 74,86%
Lời giải:
Đáp án: D
Gọi x, y là số mol cảu Na2CO3 và K2SO3 trong hỗn hợp.
Phương trình phản ứng xảy ra:
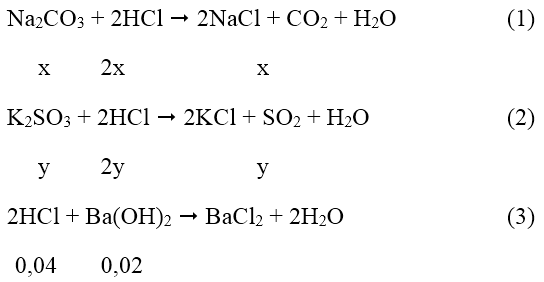
Theo đề bài ta có: 106x + 158y = 3,9 (I)
Mặt khác:
⇒ X = 0,00925 mol; y = 0,0185 mol
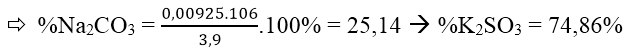
Bài 5: Cho 9,125 gam muối hiđrocacbon phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Công thức của muối hiđrocacbon là:
A. NaHCO3 B. Mg(HCO3)2 C. Ba(HCO3)2 D. Ca(HCO3)2
Lời giải:
Đáp án: B
Gọi công thức muối hiđrocacbonat: M(HCO3)n
PT: 2M(HCO3)n + nH2SO4 → M2(SO4)n + 2nCO2 + 2nH2O
Ta thấy:
2 mol M(HCO3)n → 1 mol M2(SO4)n thì khối lượng giảm:
2,61n - 96n = 26n (g)
Vậy x mol M(HCO3)n → M2(SO4)n thì khối lượng giảm:
9,125 - 7,5 = 1,625 (g)
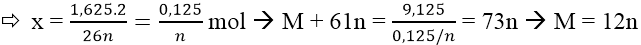
Cặp nghiệm phù hợp là: n = 2 và M = 24 (Mg)
Công thức của muối hiđrocacbonat là Mg(HCO3)2.
Bài 6: Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaOH 0,2M , sau phản ứng thu được số mol CO2 là:
A. 0,03
B. 0,01
C. 0,02
D. 0,015
Lời giải:
Đáp án: B
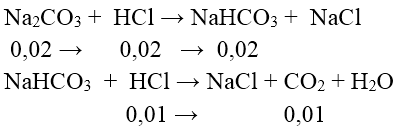
⇒ n CO2 = 0,01mol
Bài 7: Hòa tan hoàn toàn 12,4 gam hỗn hợp gồm 2 muối cacbonat của kim loại hóa trị II và hóa trị III vào H2SO4 loãng; dư thu được 1,12 lít khí ở đktc. Vậy khối lượng muối thu được sau khi cô cạn dung dịch là:
A. 12,8g B. 14,2g C. 13,6g D. 14,6g
Lời giải:
Đáp án: B
Khi thay thế 1 mol muối cacbonat bằng muối sunfat của cùng một kim loại. Khối lượng muối kim loại tăng lên là: 96 - 60 = 36g
nCO2 = 1,12/22,4 = 0,05 mol
Δm = 0,05.36 = 2,8 (g)
mmuối = 12,4 + 1,8 = 14,2 (g)
Bài 8: Nung nóng 100 g hỗn hợp NaHCO3 và Na2CO3 đến khối lượng không đổi thu được 69g hỗn hợp rắn. % khối lượng của NaHCO33 trong hỗn hợp là:
A. 80% B. 70% C. 80,66% D. 84%
Lời giải:
Đáp án: D
Phản ứng: 2NaHCO3 −tº→ Na2CO3 + CO2 + H2O
Cứ 2 mol NaHCO3 phản ứng thì khối lượng giảm 2.84 - 106 = 62 (g)
Vậy x mol NaHCO3 phản ứng thì khối lượng giảm 100 - 69 = 31 (g)
x = 31.2/62 = 1 (mol)
mNaHCO3 = 84 (g) ⇒ %NaHCO3 = 84%