Tổng hợp Lý thuyết chương Phân biệt một số chất vô cơ đầy đủ, chi tiết nhất - Hoá học lớp 12
Tổng hợp Lý thuyết chương Phân biệt một số chất vô cơ đầy đủ, chi tiết nhất
Tài liệu Tổng hợp Lý thuyết chương Phân biệt một số chất vô cơ đầy đủ, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về chương Phân biệt một số chất vô cơ từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

- Lý thuyết Cách nhận biết một số cation trong dung dịch Xem chi tiết
- Lý thuyết Cách nhận biết một số anion trong dung dịch Xem chi tiết
- Lý thuyết Cách nhận biết một số chất khí Xem chi tiết
- Lý thuyết Chuẩn độ axit - bazo, chuẩn độ oxi hóa - khử Xem chi tiết
- Lý thuyết về Nhận biết một số chất vô cơ Xem chi tiết
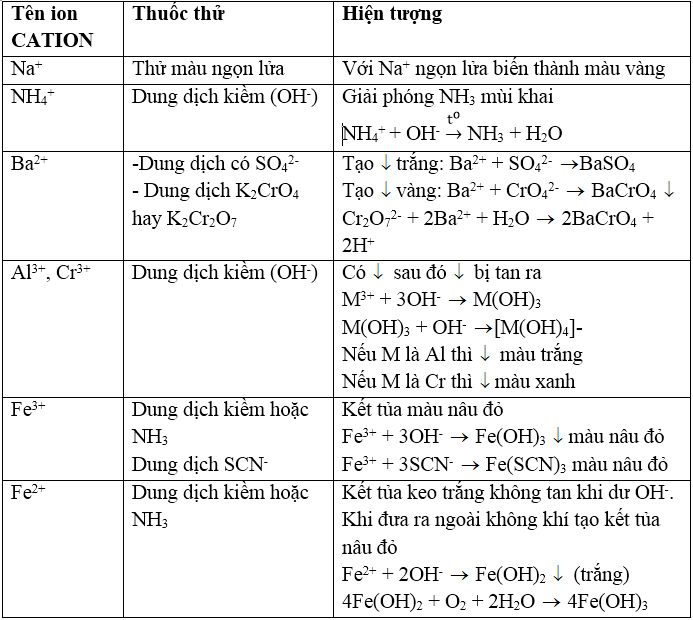
Cách nhận biết một số cation trong dung dịch
I. Nguyên tắc nhận biết
Để nhận biết 1 ion trong dung dịch, người ta thêm vào dung dịch 1 thuốc thử tạo với ion đó 1 sản phẩm đặc trưng như: chất kết tủa, hợp chất có màu, chất khí, sủi bọt, ……
II. Nhận biết các cation kim loại kiềm và NH4+
1. Nhận biết cation Na+
Đốt muối natri rắn hoặc các dung dịch muối bằng ngọn lửa không màu thì ngọn lửa nhuốm màu vàng tươi.
2. Nhận biết cation K+
Đốt muối kali rắn hoặc các dung dịch muối kali, ta được ngọn lửa màu tím.
3. Nhận biết ion NH4+
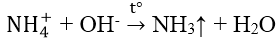
III. Nhận biết cation Ca2+, Ba2+
1. Nhận biết cation Ba2+: dùng dung dịch thuốc thử K2CrO4 hoặc K2Cr2O7
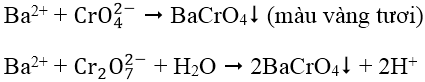
BaCrO4 không tan trong dung dịch CH3COOH loãng, nên trong môi trường axit axetic có thể phân biệt được Ba2+ trong dung dịch chứa Ca2+.
2. Nhận biết cation Ca2+
Trong môi trường axit yếu (pH = 4 - 5). Dung dịch chứa ion CrO42- tạo kết tủa với ion Ca2+ khí tan trong dung dịch CH3COOH loãng.
Chú ý: Các ion Ba2+ và Pb2+ cũng phản ứng tương tự, nên cần tách chúng trước khi nhận biết Ca2+ nếu trong dung dịch có chúng.
IV. Nhận biết cation Al3+, Cr3+
- Thêm từ từ dung dịch kiềm vô dung dịch chứa các ion này, đầu tiên tạo các hiđroxit M(OH)3 kết tủa, sau đó kết tủa tan trong thuốc thử dư:
M3+ + 3OH- → M(OH)3↓
M(OH)3 + OH- → [M(OH)4]-
- Để phân biệt Al3+ và Cr3+ dùng thuốc thử nhóm gồm dung dịch kiềm KOH hoặc NaOH dư có mặt chất oxi hóa là H2O2 để oxi hóa [Cr(OH)4]- thành ion cromat CrO42- có màu vàng:
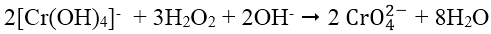
V. Nhận biết các cation Fe2+, Fe3+, Cu2+, Mg2+
1. Nhận biết cation Fe3+: dùng dung dịch thioxianua SCN-, hoặc dung dịch kiềm NaOH, KOH hoặc NH3.
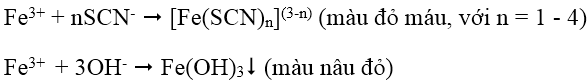
2. Nhận biết cation Fe2+: dùng dung dịch kiềm (OH- hoặc NH3) hoặc dùng hỗn hợp dung dịch thuốc tím trong môi trường axit (Fe2+ làm mất màu dung dịch thuốc tím):
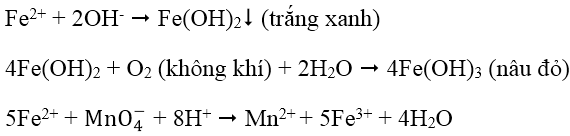
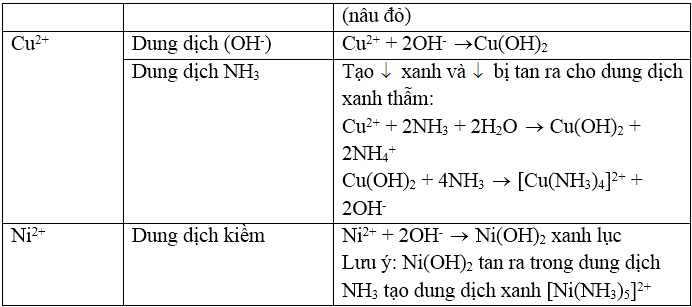
3. Nhận biết cation Cu2+: Dùng dung dịch NH3, đầu tiên tạo kết tủa Cu(OH)2 màu xanh lục sau đó kết tủa tan trong NH3 dư tạo thành ion phức màu xanh lam đậm:
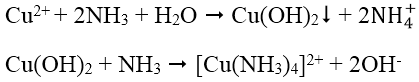
4. Nhận biết cation Mg2+: Dùng dung dịch kiềm KOH hoặc NaOH tạo kết tủa Mg(OH)2, Mg(OH)2 có thể tan trong dung dịch muối amoni (dung dịch axit yếu):
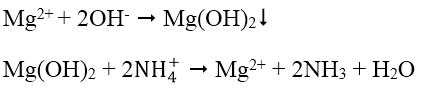
Do đó có thể dùng dung dịch NH4Cl để tách Mg(OH)2 ra khỏi hỗn hợp với Fe(OH)3, Fe(OH)2 và Al(OH)3. Mg2+ có thể nhận biết bằng dung dịch Na2HPO4 có mặt NH3 loãng:

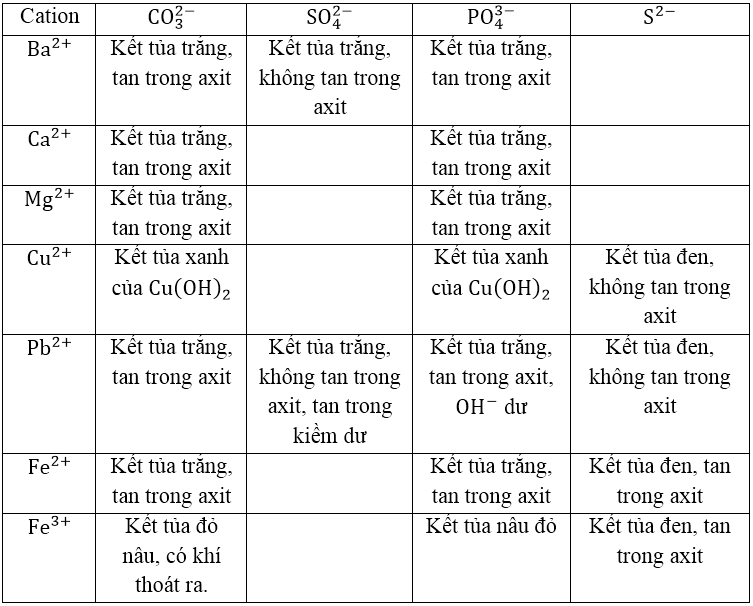
BẢNG TỔNG HỢP NHẬN BIẾT CATION
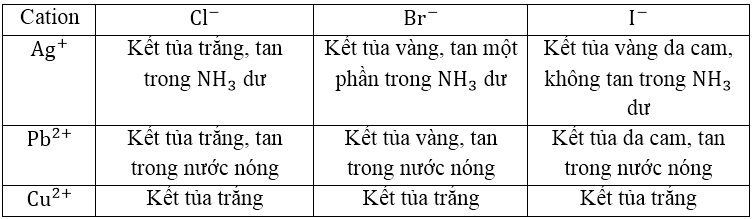
CATION TẠO KẾT TỦA VỚI HALOGENUA
CATION TẠO KẾT TỦA CACBONAT, PHOTPHAT, SUNFUA