Bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb và cách giải
Bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb và cách giải
Với Bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb và cách giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb từ đó đạt điểm cao trong bài thi môn Hoá 12.

A. Lý thuyết ngắn gọn
- Cr là kim loại có tính khử trung bình (yếu hơn Zn nhưng mạnh hơn Fe)
- Trong các phản ứng hóa học, Cr tạo nên các hợp chất trong đó Cr có số oxh từ +1 đến +6 (thường gặp +2 , +3 , +6 )
1. Tác dụng với phi kim : Ở nhiệt độ thường, Cr chỉ tác dụng với flo. Ở nhiệt độ cao, Cr tác dụng với oxi, clo, S,…
4Cr + 3O2 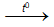 2Cr2O3 ; 2Cr + 3Cl2
2Cr2O3 ; 2Cr + 3Cl2 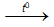 2CrCl3
2CrCl3
2Cr + 3S 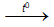 Cr2S3
Cr2S3
2. Tác dụng với nước :
Crom bền với nước và không khí do có màng oxit rất mỏng, bền bảo vệ. Chính vì vậy, người ta mạ crom lên sắt để bảo vệ sắt Và cùng crom để chế tạo thép không gỉ.
3. Tác dụng với axit :
a. Với axit HCl và H2SO4 loãng :
Vì có màng oxit bảo vệ, crom không tan ngay trong dung dịch loãng nguội của axit HCl và H2SO4 . Khi đun nóng màng oxit tan ra, crom tác dụng với axit giải phóng H2 và tạo muối crom (II) khi không có không khí.
Cr + 2HCl 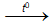 CrCl2 + H2 ; Cr + H2SO4
CrCl2 + H2 ; Cr + H2SO4 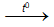 CrSO4 + H2
CrSO4 + H2
b. Với axit HNO3 và H2SO4 đặc, nóng : tạo muối crom (III)
Cr + 6HNO3 (đặc) 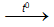 Cr(NO3)3 + 3NO2 + 3H2O
Cr(NO3)3 + 3NO2 + 3H2O
2Cr + 6H2SO4 (đặc) 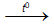 Cr2(SO4)3 + 3SO2 + 6H2O
Cr2(SO4)3 + 3SO2 + 6H2O
Cr bị thụ động hóa trong dd HNO3 đặc nguội và H2SO4 đặc nguội, giống Al và Fe.
4. Tác dụng với dung dịch muối : Crom khử ion kim loại yếu hơn ra khỏi dung dịch muối.
Cr + 2AgNO3 → Cr(NO3)2 + 2Ag
B. Phương pháp giải
Viết phương trình hóa học và tính theo phương trình hóa học.
C. Ví dụ minh họa
Ví dụ 1: Cho 5,2 gam Cr tác dụng hoàn toàn với dung dịch HCl đặc, nóng, dư thu được x mol H2. Giá trị của x là
A. 0,15
B. 0,20
C. 0,10
D. 0,25
Lời giải chi tiết
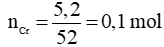
Phương trình hóa học:
Cr + 2HCl → CrCl2 + H2
Theo phương trình: 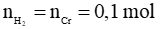
Vậy 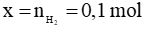
Chọn C.
Ví dụ 2: Hòa tan hết 1,08 gam hỗn hợp Cr và Fe trong dung dịch HCl loãng, nóng thu được 448 ml khí (đktc). Khối lượng crom có trong hỗn hợp là
A. 1,015 gam
B. 0,520 gam
C. 0,065 gam
D. 0,560 gam
Lời giải chi tiết
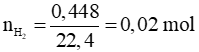
Gọi số mol của Cr và Fe lần lượt là x và y mol
→ 52x + 56y = 1,08 (*)
Phương trình hóa học:
Cr + 2HCl → CrCl2 + H2
x → x
Fe + 2HCl → FeCl2 + H2
y → y
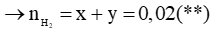
Từ (*) và (**) suy ra: x = 0,01; y = 0,01
→ mCr = 0,01.52 = 0,52 gam
Chọn B.
Ví dụ 3: Thể tích của dung dịch K2Cr2O7 0,1M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư là
A. 100 ml
B. 150 ml
C. 200 ml
D. 250 ml.
Lời giải chi tiết
Phương trình hóa học:
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Theo phương trình: 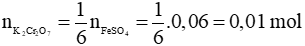
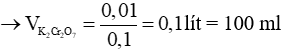
Chọn A.

D. Bài tập tự luyện
Câu 1: Cho 1,04 gam Cr phản ứng hết với dung dịch H2SO4 loãng, dư, đun nóng thu được V ml khí H2 (đktc). Giá trị của V là
A. 448.
B. 896.
C. 224.
D. 672.
Câu 2: Cho 3,035 gam hỗn hợp X gồm Al và Cr tác dụng hoàn toàn với dung dịch NaOH dư, thu được 1,512 lít khí H2 (đktc). Phần trăm về khối lượng của Cr trong hỗn hợp X là
A. 60%.
B. 40%.
C. 55%.
D. 50%.
Câu 3: Thể tích của dung dịch K2Cr2O7 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư là
A. 100 ml.
B. 150 ml.
C. 200 ml.
D. 250 ml.
Câu 4: Cho 0,8 mol KI tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được một đơn chất, số mol của đơn chất thu được là
A. 0,3.
B. 0,4.
C. 0,5.
D. 0,6.
Câu 5: Để oxi hóa hoàn toàn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi có mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng lần lượt là
A. 0,030 mol và 0,080 mol.
B. 0,015 mol và 0,040 mol.
C. 0,015 mol và 0,080 mol.
D. 0,030 mol và 0,030 mol.
Câu 6: Cho sơ đồ:
Để oxi hóa hoàn toàn 0,04 mol CrCl3 thành K2CrO4 thì thể tích Cl2 tối thiểu (đktc) cần dùng là
A. 0,672 lít
B. 1,344 lít
C. 0,560 lít
D. 0,896 lít
Câu 7: Cho 0,6 mol KI tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được một đơn chất. Số mol đơn chất là
A. 0,3 mol
B. 0,4 mol
C. 0,5 mol
D. 0,6 mol
Câu 8: Hòa tan hết m gam ZnSO4 vào nước được dung dịch X. Cho 140 ml dung dịch KOH 2M vào X, thu được 10,89 gam kết tủa. Giá trị của m là
A. 22,540
B. 17,710
C. 12,375
D. 20,125
Câu 9: Hòa tan hoàn toàn m gam ZnSO4 vào nước được dung dịch X. Nếu cho 110 ml dung dịch KOH 2M vào X thì thu được 3a gam kết tủa. Mặt khác, nếu cho 140 ml dung dịch KOH 2M vào X thì thu được 2a gam kết tủa. Giá trị của m là
A. 32,20
B. 24,15
C. 17,71
D. 16,10
Câu 10: Cho m gam hỗn hợp bột X gồm ba kim loại Zn, Cr, Sn có số mol bằng nhau tác dụng hết với lượng dư dung dịch HCl loãng, nóng thu được dung dịch Y và khí H2. Cô cạn dung dịch Y thu được 8,98 gam muối khan. Nếu cho m gam hỗn hợp X tác dụng hoàn toàn với O2 (dư) để tạo hỗn hợp 3 oxit thì thể tích khí O2 (đktc) phản ứng là
A. 2,016 lít
B. 0,672 lít
C. 1,344 lít
D. 1,008 lít
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
A |
A |
C |
B |
C |
B |
A |
D |
D |
D |

