Các dạng toán về sự lưỡng tính của Al(OH)3 và cách giải
Các dạng toán về sự lưỡng tính của Al(OH)3 và cách giải
Với Các dạng toán về sự lưỡng tính của Al(OH)3 và cách giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập toán về sự lưỡng tính của Al(OH)3 từ đó đạt điểm cao trong bài thi môn Hoá 12.

A. Lý thuyết ngắn gọn
Al(OH)3 là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh: Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh: Al(OH)3 + KOH → KAlO2 + 2H2O
Hay Al(OH)3 + KOH → K[Al(OH)4]
Phương trình ion thu gọn : Al(OH)3 + OH- → AlO2- + 2H2O
B. Các dạng bài
Dạng 1: Cho dung dịch OH- tác dụng với dung dịch Al3+
1. Phương pháp giải
Quá trình phản ứng
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- → AlO2- + 2H2O
Cách 1: Tính theo phương trình hóa học.
Cách 2: Xét tỉ lệ 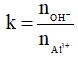
Nếu k ≤ 3 thì khi đó 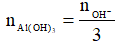
Nếu 3 < k < 4 thì khi đó 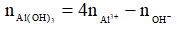
Cách 3: Ta có thể dùng sơ đồ phản ứng kết hợp với phương pháp bảo toàn nguyên tố, bảo toàn điện tích để giải nhanh.
2. Ví dụ minh họa
Ví dụ 1: Cho 100 ml dung dịch AlCl3 0,15M vào 250 ml dung dịch NaOH 0,2M, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 1,56
B. 0,78
C. 1,17
D. 1,30
Lời giải chi tiết
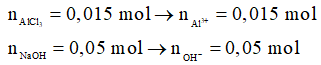
Phương trình hóa học:
Al3+ + 3OH- → Al(OH)3
0,015 → 0,045 → 0,015
Sau phản ứng, OH- dư: 0,05 – 0,045 = 0,005 mol
Al(OH)3 + OH- → AlO2- + 2H2O
0,005 ← 0,005
Sau phản ứng: 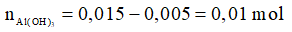
→ mkết tủa = 0,01.78 = 0,78 gam
Chọn B.
Ví dụ 2: Cho từ từ đến hết 100 ml dung dịch NaOH 1,5M vào 50 ml dung dịch AlCl3 1,5M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 12,4.
B. 7,8.
C. 15,6.
D. 3,9.
Lời giải chi tiết
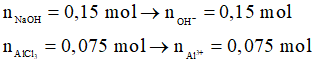
Xét tỉ lệ 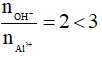
Khi đó 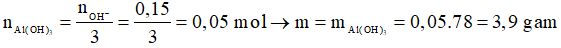
Chọn D.
Dạng 2: Cho từ từ dung dịch H+ vào dung dịch
1. Phương pháp giải
Cách 1: Tính theo phương trình hóa học nối tiếp
Khi cho muối aluminat tác dụng với dung dịch axit xảy ra phản ứng:
AlO2- + H+ + H2O → Al(OH)3
Nếu H+ dư thì xảy ra tiếp:
Al(OH)3 + 3H+ → Al3+ + 3H2O
Chú ý: Nếu trong dung dịch có OH- thì H+ sẽ phản ứng với OH- trước, sau đó mới phản ứng với AlO2-
Cách 2: Xét phương trình hóa học song song
AlO2- + H+ + H2O → Al(OH)3 (1)
AlO2- + 4H+ → Al3+ + 2H2O (2)
Nếu 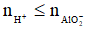 thì chỉ xảy ra (1), khi đó:
thì chỉ xảy ra (1), khi đó: 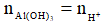
Nếu 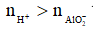 thì xảy ra cả (1) và (2), khi đó
thì xảy ra cả (1) và (2), khi đó 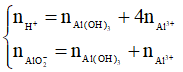
Cách 3: Dùng bảo toàn nguyên tố.
2. Ví dụ minh họa
Ví dụ 1: Cho 200 ml dung dịch HCl 2M vào 100 ml dung dịch gồm NaOH 0,6M và NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 7,80.
B. 3,90.
C. 3,12.
D. 1,56.
Lời giải chi tiết
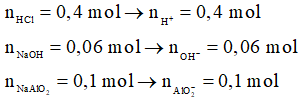
Phương trình hóa học:
OH- + H+ → H2O
0,06 → 0,06
AlO2- + H+ + H2O → Al(OH)3
0,1 → 0,1 → 0,1
Al(OH)3 + 3H+ → Al3 + 3H2O
0,08 ← 0,24
Ta có: 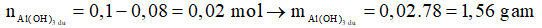
Chọn D.
Ví dụ 2: Cho 100 ml dung dịch HCl 0,5M vào 100 ml dung dịch NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 3,90
B. 7,80.
C. 5,85.
D. 4,68.
Lời giải chi tiết
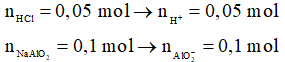
Ta thấy 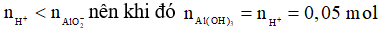
→ 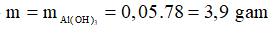
Chọn A.

C. Bài tập tự luyện
Câu 1: Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
A. 15,6 và 27,7
B. 23,4 và 35,9
C. 23,4 và 56,3
D. 15,6 và 55,4
Câu 2: Dẫn V lít khí CO2 (đktc) vào dung dịch NaAlO2 dư, thu được kết tủa X. Nung X đến khối lượng không đổi thu được 10,2 gam chất rắn Y. Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 6,72
Câu 3: Hòa tan hoàn toàn m gam hỗn hợp Na, Al (tỉ lệ mol tương ứng là 5:4), thu được dung dịch X. Cho từ từ dung dịch HCl 1M vào X, kết quả thí nghiệm được ghi ở bảng sau
Thể tích dung dịch HCl (ml) |
210 |
430 |
Khối lượng kết tủa (gam) |
a |
a – 1,56 |
Giá trị của m là
A. 6,69
B. 11,15
C. 9,80
D. 6,15
Câu 4: Cho 8,63 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước thu được dung dịch Y và 1,344 lít khí H2 (đktc). Cho 0,32 lít dung dịch HCl 0,75M vào dung dịch Y, thu được m gam kết tủa. Giá trị của m là
A. 5,46
B. 1,04.
C. 2,34.
D. 2,73.
Câu 5: Cho m gam hỗn hợp gồm Na, Na2O, K, K2O, Ba, BaO (trong đó oxi chiếm 9,638% khối lượng) tác dụng với một lượng dư nước, thu được 0,0672 lít khí H2 (đktc) và 20 ml dung dịch X. Cho X tác dụng với 20 ml dung dịch chứa hỗn hợp gồm H2SO4 0,2M và HCl 0,1M, thu được 40 ml dung dịch có pH = 13. Giá trị của m gần nhất với
A. 0,66
B. 0,68.
C. 0,72.
D. 0,54.
Câu 6: Cho 0,926 gam hỗn hợp gồm Na, Na2O, K, K2O, Ba, BaO (trong đó oxi chiếm 3,456%) tác dụng với một lượng dư nước, thu được 0,112 lít khí H2 (đktc) và 200 ml dung dịch X. Hấp thụ 0,224 lít CO2 (đktc) vào 200 ml X, thu được 0,394 gam kết tủa. Nếu cho 0,002 mol Al2(SO4)3 vào 200 ml dung dịch X thì thu được m gam kết tủa. Giá trị của m là
A. 1,088
B. 0,622
C. 0,466
D. 0,778
Câu 7: Hỗn hợp X gồm Al, Ba, Na và K. Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,0405 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,018 mol H2SO4 và 0,03 mol HCl vào Y, thu được 1,089 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 3,335 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng của kim loại Ba trong X là
A. 42,33%
B. 37,78%
C. 29,87%
D. 33,12%.
Câu 8: Hòa tan m gam hỗn hợp X gồm Ba, BaO, Al và Al2O3 vào nước dư, thu được 0,008 mol khí H2 và dung dịch Y. Chia Y làm hai phần bằng nhau. Nhỏ từ từ dung dịch HCl 0,1M vào phần một đến khi bắt đầu xuất hiện kết tủa thì hết 20 ml. Sục từ từ 0,0054 mol khí CO2 vào phần hai, thu được 0,4302 gam kết tủa và dung dịch Z chỉ chứa một chất tan. Giá trị của m là
A. 0,599
B. 1,198.
C. 0,536.
D. 1,070.
Câu 9: Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Na và BaO vào nước dư, thu được dung dịch Y và 0,085 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,03 mol H2SO4 và 0,1 mol HCl vào Y, thu được 3,11 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là
A. 2,79
B. 3,76
C. 6,50
D. 3,60
Câu 10: Hỗn hợp X gồm Al, K, K2O và BaO (trong đó oxi chiếm 10% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,0056 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,004 mol H2SO4 và 0,002 mol HCl vào Y, thu được 0,498 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 0,6182 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là
A. 0,9592
B. 0,5760
C. 0,5004
D. 0,9596
Câu 11: Cho 50 ml dung dịch KOH 1,5M vào dung dịch AlCl3 dư, thu được m gam Al(OH)3. Giá trị của m là
A. 1,95
B. 2,34
C. 4,68
D. 5,85
Câu 12: Cho từ từ V ml dung dịch NaOH 1M vào 100 ml dung dịch hỗn hợp gồm HCl 1M và AlCl3 0,5M thì thu được lượng kết tủa lớn nhất. Giá trị của V là
A. 100
B. 150
C. 200
D. 250
Câu 13: Thể tích dung dịch NaOH 0,25M cần cho vào 15 ml dung dịch Al2(SO4)3 0,5M để thu được lượng kết tủa lớn nhất là
A. 210 ml
B. 60 ml.
C. 180 ml.
D. 90 ml.
Câu 14: Cho từ từ 0,25 lít dung dịch NaOH 1,04M vào dung dịch chứa 0,04 H2SO4; 0,024 mol FeCl3 và 0,016 mol Al2(SO4)3, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 2,568
B. 4,128.
C. 1,560.
D. 5,064.
Câu 15: Cho 47,4 gam phèn chua vào nước thu được dung dịch X. Cho X vào 200 ml dung dịch Ba(OH)2 1M, thu được m gam kết tủa. Giá trị của m là
A. 7,8
B. 62,2
C. 54,4
D. 46,6
Câu 16: Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol H2SO4 và 0,1 mol Al2(SO4)3, thu được 7,8 gam kết tủa. Giá trị của V lớn nhất là
A.0,45.
B.0,25.
C.0,35.
D.0,50.
Câu 17: Cho một mẫu K vào 200 ml dung dịch Al2(SO4)3 nồng độ xM, sau phản ứng thu được kết tủa và 5,6 lít khí (ở đktc). Lọc kết tủa đem nung đến khối lượng không đổi, thu được 5,1 gam chất rắn. Giá trị của x là
A.0,375.
B.0,200.
C.0,050.
D.0,150.
Câu 18: Cho 300 ml dung dịch NaOH 0,1M phản ứng với 100 ml dung dịch Al2(SO4)3 0,1M. Sau khi phản ứng xảy ra hoàn toàn, thu được a gam kết tủa. Giá trị của a là
A. 2,34.
B. 1,17.
C. 1,56.
D. 0,78.
Câu 19: Cho 400 ml dung dịch E gồm AlCl3 x mol/l và Al2(SO4)3 y mol/l tác dụng với 612 ml dung dịch NaOH 1M, sau khi các phản ứng kết thúc thu được 8,424 gam kết tủa. Mặt khác, khi cho 400 ml E tác dụng với dung dịch BaCl2 dư thì thu được 33,552 gam kết tủa. Tỉ lệ x:y là
A. 3:4
B. 3:2.
C. 4:3.
D. 7:4.
Câu 20: Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa. Giá trị của V là
A. 300.
B. 75.
C. 200.
D. 150.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
A |
B |
B |
C |
A |
B |
C |
B |
B |
B |
Câu 11 |
Câu 12 |
Câu 13 |
Câu 14 |
Câu 15 |
Câu 16 |
Câu 17 |
Câu 18 |
Câu 19 |
Câu 20 |
A |
D |
C |
B |
D |
A |
A |
D |
D |
D |

