Bài tập về tính bazơ của amin và cách giải
Bài tập về tính bazơ của amin và cách giải
Với Bài tập về tính bazơ của amin và cách giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập về tính bazơ của amin từ đó đạt điểm cao trong bài thi môn Hoá 12.

I. Lý thuyết và phương pháp giải
1.Tính bazơ của amin
- Trong phân tử amin nguyên tử nitơ còn một cặp electron tự do vì vậy các amin có tính bazơ.
+ Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
+ Dung dịch anilin và các amin thơm có tính bazơ yếu nên không làm quỳ tím và phenolphtalein đổi màu.
+ Tác dụng với axit
Phương trình hóa học: CH3NH2 + HCl → CH3NH3Cl
-So sánh tính bazơ của các amin:
+ Lực bazơ giảm dần: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2.
+ Amin no bậc 2 có tính bazơ mạnh hơn amin no bậc 1: (NH2)2R > RNH2.
+ Amin càng có nhiều nhóm C6H5- thì càng làm giảm tính bazơ của amin.
2. Phản ứng của amin với dung dịch axit
-Với amin A, có a nhóm chức tác dụng dụng với axit HCl
R(NH2)a + aHCL → R(NH3CL)a
Số nhóm chức: 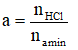
Áp dụng định luật bảo toàn khối lượng ta có:
-Với amin no, đơn chức, mạch hở: CnH2n+1NH2
Phương trình tổng quát:
CnH2n+1NH2 + HCl → CnH2n+1NH3Cl
=> nmuối = namin = nHCL
mHCl + mamin = mmuối
3. Phản ứng của amin với dung dịch muối của kim loại
Một số muối dễ tạo kết tủa hidroxit với dung dịch amin.
ALCL3 + 3CH3NH2 + 3H2O → AL(OH)3↓ + 3CH3NH3CL
FeCL3 + 3CH3NH2 + 3H2O → Fe(OH)3↓ + 3CH3NH3CL
II. Ví dụ minh họa
Ví dụ 1: Trong các chất dưới đây, chất nào có lực bazơ mạnh nhất?
A. NH3.
B. C6H5CH2NH2.
C. C6H5NH2.
D. (CH3)2NH.
Hướng dẫn giải:
C6H5NH2; C6H5CH2NH2 đều có chứa gốc hút e làm giảm tính bazơ
(CH3)2NH có chứa 2 gốc đẩy e => làm tăng tính bazơ
Vậy nên (CH3)2NH là amin có lực bazơ mạnh nhất.
Đáp án cần chọn là: D
Ví dụ 2: Cho 6,2 gam metylamin (CH3NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
A. 7,65 gam.
B. 13,5 gam.
C. 8,10 gam.
D. 0,85 gam.
Hướng dẫn giải:
Amin đơn chức phản ứng với HCl theo tỉ lệ 1 : 1 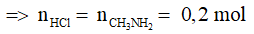
Bảo toàn khối lượng: mmuối = 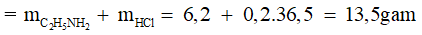
Đáp án cần chọn là: B
III. Bài tập vận dụng
Câu 1: Cho anilin tác dụng vừa đủ với dung dịch HCl thu được 38,85 gam muối. Khối lượng anilin đã phản ứng là
A. 18,6 gam.
B. 9,3 gam.
C. 37,2 gam.
D. 27,9 gam.
Hướng dẫn giải:
Phương trình: C6H5NH2 + HCL → C6H5NH3CL
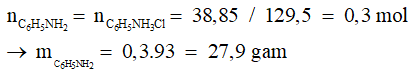
Đáp án cần chọn là: D
Câu 2: Cho 15 gam hỗn hợp gồm hai amin đơn chức tác dụng vừa đủ với V ml dung dịch HCl 0,75M, thu được dung dịch chứa 23,76 gam hỗn hợp muối. Giá trị của V là
A. 720. B. 480. C. 329. D. 320.
Hướng dẫn giải:
Đặt công thức của 2 amin đơn chức là RNH2
RNH2 + HCl → RNH3Cl
Bảo toàn khối lượng ta có:
mHCl = mmuối - mRNH2 = 23,76 - 15 = 8,76 (g)
=> nHCl = 8,76:36,5 = 0,24 (mol)
=> VHCl = n : CM = 0,24 : 0,75 = 0,32 (lít) = 320 (ml)
Đáp án cần chọn là: D
Câu 3: Cho 7,2 gam etylamin vào dung dịch HNO3 loãng, dư, sau phản ứng kết thúc thu được m gam muối. Giá trị của m là
A. 17,28. B. 12,88. C. 13,04. D. 17,12.
Hướng dẫn giải:
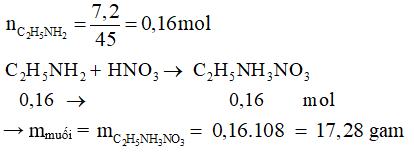
Đáp án cần chọn là: A
Câu 4: Cho etyl amin tác dụng vừa đủ với dung dịch HCl thu được 16,3 gam muối. Khối lượng etyl amin đã phản ứng là
A. 4,5 gam.
B. 9,0gam.
C. 6,1gam.
D. 12,2gam.
Hướng dẫn giải:
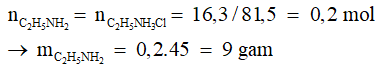
Đáp án cần chọn là: B
Câu 5: Nhận định nào sau đây đúng?
A. Amin tác dụng với muối cho axit.
B. Tính bazơ của amin đều yếu hơn NH3.
C. Các amin đều có tính bazơ.
D. Amin là hợp chất hữu cơ có tính lưỡng tính.
Hướng dẫn giải:
A. Sai, amin không có phản ứng với muối
B. Sai, tính bazơ của amin có chất mạnh hơn, có chất yếu hơn NH3
C. Đúng
D. Sai, amin chỉ có tính bazơ, không có tính axit
Đáp án cần chọn là: C
Câu 6: Tính bazơ của metylamin mạnh hơn anilin vì:
A. Nhóm metyl làm tăng mật độ electron của nguyên tử nitơ, nhóm phenyl làm giảm mật độ electron của nguyên tử nitơ.
B. Nhóm metyl làm tăng mật độ electron của nguyên tử nitơ.
C. Nhóm metyl làm giảm mật độ electron của nguyên tử nitơ, nhóm phenyl làm tăng mật độ electron của nguyên tử nitơ.
D. Phân tử khối của metylamin nhỏ hơn.
Hướng dẫn giải:
Tính bazơ của amin do cặp e chưa liên kết của nguyên tử nitơ. Mật độ e trên nguyên tử nitơ càng tăng thì tính bazơ càng mạnh và ngược lại. Nhóm metyl là nhóm đẩy e nên làm tăng mật độ e của nguyên tử nitơ, còn nhóm phenyl là nhóm hút e nên làm giảm mật độ e của nguyên tử nitơ.
Đáp án cần chọn là: A
Câu 7: Dung dịch chất nào sau đây làm quỳ tính chuyển sang màu xanh?
A. Anilin.
B. Etylamin.
C. amoni clorua.
D. p-nitroanilin.
Hướng dẫn giải:
Anilin không làm đổi màu quỳ.
Etylamin có tính bazơ mạnh hơn amoniac → làm quỳ tím chuyển màu xanh
Amoni clorua (NH4Cl) là muối của bazơ yếu và axit mạnh → làm quỳ chuyển màu đỏ
p-nitroanilin không làm đổi màu quỳ
Đáp án cần chọn là: B
Câu 8: Dung dịch chất nào sau đây làm quỳ tím không chuyển màu?
A. Anilin.
B. Etylamin.
C. amoni clorua.
D. metylamin
Hướng dẫn giải:
Anilin không làm đổi màu quỳ.
Etylamin có tính bazơ mạnh hơn amoniac → làm quỳ tím chuyển màu xanh
Amoni clorua (NH4Cl) là muối của bazơ yếu và axit mạnh → làm quỳ chuyển màu đỏ
Metylamin có tính bazơ mạnh hơn amoniac nên làm quỳ tím chuyển màu xanh
Đáp án cần chọn là: A
Câu 9: Metylamin (CH3NH2) phản ứng được với dung dịch
A. NaOH.
B. HCl.
C. Na2CO3.
D. NaCl
Hướng dẫn giải:
Metylamin có tính bazơ nên phản ứng được với dung dịch HCl
CH3NH2 + HCL → CH3NH3CL
Đáp án cần chọn là: B
Câu 10: Chất phản ứng với dung dịch FeCl3 cho kết tủa là:
A. CH3NH2.
B. CH3COOCH3.
C. CH3OH.
D. CH3COOH.
Hướng dẫn giải:
CH3NH2 phản ứng với dung dịch FeCl3 thu được kết tủa hiđroxit
3CH3NH2 + FeCL3 + 3H2O → Fe(OH)3 + 3CH3NH3CL
Đáp án cần chọn là: A
Câu 11: Mùi tanh của cá gây ra bởi hỗn hợp các amin và một số tạp chất khác. Để khử mùi tanh của cá, trước khi nấu nên
A. ngâm cá thật lâu với nước muối để các amin tan đi
B. rửa cá bằng chanh
C. ngâm cá thật lâu với nước muối để các amin tan đi. rửa cá bằng nước Clo để sát trùng
D. rửa cá bằng dung dịch nước vôi
Hướng dẫn giải:
Trong chanh có axit citric mà amin có tính bazơ nên phản ứng với axit.
RNH2 + H+→ RNH3+ (muối, dễ rửa trôi)
Đáp án cần chọn là: B
Câu 12: Cho 4,5 gam etylamin (C2H5NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
A. 7,65 gam.
B. 8,15 gam.
C. 8,10 gam
D. 0,85 gam.
Hướng dẫn giải:
Amin đơn chức phản ứng với HCl theo tỉ lệ 1 : 1 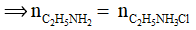 = 0,1 mol
= 0,1 mol
Bảo toàn khối lượng: mmuối= 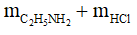 = 4,5 + 0,1.36,5 = 8,15 gam
= 4,5 + 0,1.36,5 = 8,15 gam
Đáp án cần chọn là: B
Câu 13: Hỗn hợp (X) gồm hai amin đơn chức. Cho 1,52 gam X tác dụng vừa đủ với 200 ml dung dịch HCl thu được 2,98 gam muối. Tổng số mol hai amin và nồng độ mol/l của dung dịch HCl là:
A. 0,04 mol và 0,3M.
B. 0,02 mol và 0,1M.
C. 0,06 mol và 0,3M.
D. 0,04 mol và 0,2M.
Hướng dẫn giải:
mHCl + mamin = mmuối
=> mHCl = 2,98 - 1,52 = 1,46 (g)
nHCl = 0,04 (mol)
CM(HCl) = n/V = 0,04 : 0,2 = 0,2 M
namin = nHCl = 0,04 (mol)
Đáp án cần chọn là: D
Câu 14: Amin bậc nhất, đơn chức X tác dụng vừa đủ với lượng HCl có trong 120 ml dung dịch HCl 0,1M thu được 0,81 gam muối. X là
A. metanamin.
B. etanamin.
C. propanamin.
D. benzenamin.
Hướng dẫn giải:
RNH2 + HCl → RNH3Cl
0,012 0,012 mol
Mmuối = 0,81 / 0,012 = 67,5 => Mamin = 67,5 – 36,5 = 31
=> amin là CH3NH2
Đáp án cần chọn là: A
Câu 15: Cho 15 gam hỗn hợp X gồm các amin: anilin, metylamin, đimetylamin, đietylmetylamin tác dụng vừa đủ với 50 ml dung dịch HCl 1M. Khối lượng sản phẩm thu được có giá trị là
A. 16,825 gam.
B. 20,18 gam.
C. 21,123 gam.
D. 15,925 gam.
Lời giải:
Sử dụng bảo toàn khối lượng: mmuối = mamin + mHCl = 15 + 0,05.36,5 = 16,825 gam
Đáp án cần chọn là: A

