Lý thuyết Điều chế kim loại hay, chi tiết nhất - Hoá học lớp 12
Lý thuyết Điều chế kim loại hay, chi tiết nhất
Tài liệu Lý thuyết Điều chế kim loại hay, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về Điều chế kim loại từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

I. Nguyên tắc điều chế kim loại
Khử ion kim loại thành nguyên tử.
Mn+ + ne → M
II. Phương pháp điều chế kim loại
1. Phương pháp thuỷ luyện
Nguyên tắc: Dùng những dung dịch thích hợp như: H2SO4, NaOH, NaCN, … để hoà tan kim loại hoặc các hợp chất của kim loại và tách ra khỏi phần không tan có ở trong quặng. Sau đó khử những ion kim loại này trong dung dịch bằng những kim loại có tính khử mạnh như Fe, Zn, …
Phạm vi áp dụng: Thường sử dụng để điều chế các kim loại có tính khử yếu.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Fe + Cu2+ → Fe2+ + Cu↓
2. Phương pháp nhiệt luyện
Nguyên tắc: Khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt động.
Phạm vi áp dụng: Sản xuất các kim loại có tính khử trung bình (Zn, FE, Sn, Pb, …) trong công nghiệp.
Ví dụ:
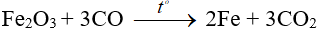
3. Phương pháp điện phân
a. Điện phân hợp chất nóng chảy
Nguyên tắc: Khử các ion kim loại bằng dòng điện bằng cách điện phân nóng chảy hợp chất của kim loại.
Phạm vi áp dụng: Điều chế các kim loại hoạt động hoá học mạnh như K, Na, Ca, Mg, Al.
Ví dụ: Điện phân MgCl2 nóng chảy để điều chế Mg.
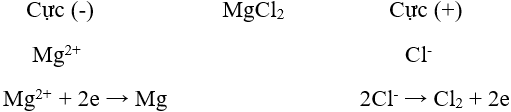
Phương trình điện phân:
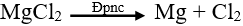
b. Điện phân dung dịch
Nguyên tắc: Điện phân dung dịch muối của kim loại.
Phạm vi áp dụng: Điều chế các kim loại có độ hoạt động hoá học trung bình hoặc yếu.
Ví dụ: Điện phân dung dịch CuCl2 để điều chế kim loại Cu.
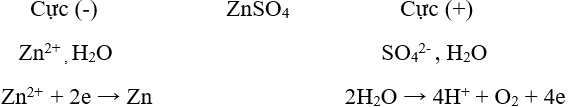
Phương trình điện phân:
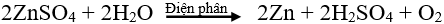
III. Định luật faraday
Tính lượng chất thu được ở các điện cực
Dựa vào công thức Farađây: 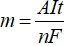
m: Khối lượng chất thu được ở điện cực (g).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giấy).
F: Hằng số Farađây (F = 96.500).

