Lý thuyết về Kim loại và hợp kim hay, chi tiết nhất - Hoá học lớp 12
Lý thuyết về Kim loại và hợp kim hay, chi tiết nhất
Tài liệu Lý thuyết về Kim loại và hợp kim hay, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về Kim loại và hợp kim từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

A. KIM LOẠI
I. Vị trí, cấu tạo
1. Vị trí
- Nhóm IA (trừ H), nhóm IIA: các kim loại này là những nguyên tố s
- Nhóm IIIA (trừ B), một phần của các nhóm IVA, VA, VIA: các kim loại này là những nguyên tố p
- Các nhóm B (từ IB đến VIIIB): các kim loại chuyển tiếp, chúng là những nguyên tố d
- Họ lantan và actini (xếp riêng thành hai hàng ở cuối bảng): các kim loại thuộc hai họ này là những nguyên tố f
2. Cấu tạo
- Cấu tạo nguyên tử kim loại
+ Hầu hết các nguyên tử kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng
Ví dụ: Na: [Ne]3s1 Mg: [Ne]3s2 Al: [Ne]3s23p1
+ Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim.
Ví dụ:
| 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl |
| 0,157 | 0,136 | 0,125 | 0,117 | 0,110 | 0,104 | 0,099 |
- Cấu tạo mạng tinh thể kim loại
Có ba kiểu mạng tinh thể kim loại đặc trưng là lập phương tâm khối, lập phương tâm diện và lục phương
- Liên kết kim loại
Là liên kết hóa học hình thành bởi lực hút tĩnh điện giữa ion dương kim loại nằm ở các nút mạng tinh thể và các electron tự do di chuyển trong toàn bộ mạng lưới tinh thể kim loại.
II. Tính chất vật lý của kim loại
1. Tính chất chung
Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg), có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
2. Một số tính chất vật lí riêng
a. Tỉ khối: của các kim loại rất khác nhau nhưng thường dao động từ 0,5 (Li) đến 22,6 (Os). Thường thì:
+ d < 5: kim loại nhẹ (K, Na, Mg, Al).
+ d > 5: kim loại nặng (Zn, Fe...).
b. Nhiệt độ nóng chảy: biến đổi từ -39oC (Hg) đến 3410oC (W). Thường thì:
+ t < 1000oC: kim loại dễ nóng chảy.
+ t > 1500oC: kim loại khó nóng chảy (kim loại chịu nhiệt).
c. Tính cứng: Biến đổi từ mềm đến rất cứng.
Tỷ khối, nhiệt độ nóng chảy và tính cứng của kim loại phụ thuộc vào nhiều yếu tố như kiểu mạng tinh thể; mật độ e; khối lượng mol của kim loại...
Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
III. Tính chất hóa học chung của kim loại
Tính chất đặc trưng của kim loại là tính khử (nguyên tử kim loại dễ bị oxi hóa thành ion dương): M → Mn+ + ne
1. Tác dụng với phi kim
Hầu hết các kim loại khử được phi kim điển hình thành ion âm
Ví dụ:
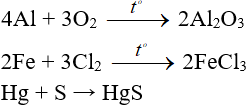
2. Tác dụng với axit
- Đối với dung dịch HCl, H2SO4 loãng:
M + nH+ → Mn+ + n/2 H2
(M đứng trước hiđro trong dãy thế điện cực chuẩn)
Ví dụ: Mg + 2HCl → MgCl2 + H2
- Đối với H2SO4 đặc, HNO3 (axit có tính oxi hóa mạnh):
+ Kim loại thể hiện nhiều số oxi hóa khác nhau khi phản ứng với H2SO4 đặc, HNO3 sẽ đạt số oxi hóa cao nhất.
+ Hầu hết các kim loại phản ứng được với HNO3 và H2SO4 đặc (trừ Pt, Au)
Lưu ý: Fe, Al, Cr bị thụ động hóa trong H2SO4 và HNO3 đặc nguội.
Khi đó S+6 trong H2SO4 bị khử thành S+4 (SO2); S0 hoặc S-2 (H2S)
Trong HNO3 đặc N+5 bị khử thành N+4 (NO2)
Với HNO3 loãng N+5 bị khử thành N+2 (NO); N+1 (N2O); N0 (N2); N-3 (NH4+)
+ Các kim loại có tính khử càng mạnh thường cho sản phẩm khử có số oxi hóa càng thấp. Các kim loại như Na, K... sẽ gây nổ khi tiếp xúc với các dung dịch axit
Ví dụ:
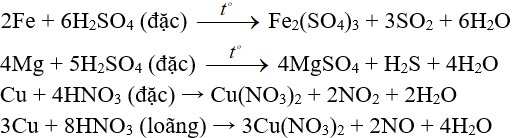
3. Tác dụng với dung dịch muối
- Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
- Với các kim loại không tan trong nước, kim loại hoạt động đẩy được kim loại kém hoạt động ra khỏi dung dịch muối của chúng theo quy tắc α.
Fe + CuSO4 → FeSO4 + Cu
Chú ý:
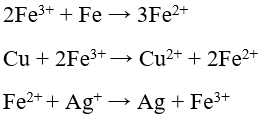
4. Tác dụng với dung dịch kiềm
Các kim loại mà hiđroxit của chúng có tính lưỡng tính như Al, Zn, Be, Sn, Pb... tác dụng được với dung dịch kiềm (đặc).
2Al + 6H2O + 2NaOH → 2Na[Al(OH)4] + 3H2
5. Tác dụng với oxit kim loại
Các kim loại mạnh khử được các oxit kim loại yếu hơn ở nhiệt độ cao thành kim loại
Ví dụ:
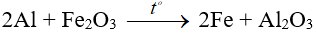
6. Tác dụng với nước
- Các kim loại có tính khử mạnh: kim loại nhóm IA và IIA (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
- Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…). Các kim loại còn lại không khử được H2O.
Ví dụ: Na + H2O → NaOH + 1/2 H2
IV. Điều chế
Nguyên tắc điều chế: Khử ion kim loại thành kim loại
Mn+ + ne → M
* Một số phương pháp điều chế
1. Phương pháp nhiệt luyện
- Nguyên tắc: dùng chất khử CO, C, Al, H2 khử oxit kim loại ở nhiệt độ cao.
- Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al.
Ví dụ:
PbO + C → Pb + CO
Fe2O3 + 3CO → 2Fe + 3CO2
2. Phương pháp thủy luyện
- Nguyên tắc: Dùng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-...) hòa tan nguyên liệu sau đó lấy kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi dung dịch của nó.
- Phạm vi sử dụng: thường dùng trong phòng thí nghiệm để điều chế các kim loại sau Mg (thường là kim loại yếu).
Ví dụ:
Vàng lẫn trong đất đá có thể hòa tan dần trong dung dịch NaCN cùng với oxi của không khí, được dung dịch muối phức của vàng:
4Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH
Sau đó, ion Au3+ trong phức được khử bằng kim loại Zn:
Zn + 2Na[Au(CN)2] → Na2[Zn(CN)4] + 2Au
3. Phương pháp điện phân
- Điện phân nóng chảy
+ Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
+ Phạm vi sử dụng: có thể dùng để điều chế tất cả các kim loại nhưng thường dùng với kim loại mạnh: K, Na, Mg, Ca, Ba và Al.
- Điện phân dung dịch
+ Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
+ Phạm vi sử dụng: Dùng điều chế các kim loại yếu.
B. HỢP KIM
I. Khái niệm
Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác
Ví dụ: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác.
Đuyra là hợp kim của nhôm với đồng, mangan, magie, silic.
II. Tính chất của hợp kim
a. Tính chất vật lý
Tính chất vật lí và tính chất cơ học của hợp kim khác nhiều so với tính chất của các đơn chất:
- Có tính dẫn điện, dẫn nhiệt, tính dẻo và ánh kim do trong hợp kim có các electron tự do
- Tính dẫn điện, dẫn nhiệt của hợp kim giảm so với kim loại thành phần do mật độ electron tự do trong hợp kim giảm đi rõ rệt
- Có độ cứng cao hơn so với các kim loại thành phần do có sự thay đổi về cấu tạo mạng tinh thể, thay đổi về thành phần của ion trong mạng tinh thể
- Có rất nhiều hợp kim khác nhau được chế tạo có hóa tính, cơ tính và lí tính ưu thế như không gỉ, độ cứng cao, chịu nhiệt tốt, chịu ma sát tốt...
Ví dụ:
- Hơp kim không bị ăn mòn: Fe–Cr–Mn (thép inoc)...
- Hợp kim siêu cứng: W–Co, Co–Cr–W–Fe,...
- Hợp kim có nhiệt độ nóng chảy thấp: Sn – Pb (thiếc hàn nóng chảy ở 210oC),...
- Hợp kim nhẹ, cứng và bền: Al–Si, Al–Cu–Mn–Mg
b. Tính chất hóa học
Có tính chất hóa học tương tự của các đơn chất tham gia tạo thành hợp kim
Ví dụ: Hợp kim Cu-Zn
- Tác dụng với dung dịch NaOH: Chỉ có Zn phản ứng
Zn + 2NaOH → Na2ZnO2 + H2↑
- Tác dụng với dung dịch H2SO4 đặc, nóng: Cả 2 đều phản ứng
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O
III. Ứng dụng của hợp kim
- Do có tính chất hóa học, vật lí, cơ học rất quý nên hợp kim được sử dụng rộng rãi trong các ngành kinh tế quốc dân
- Có những hợp kim trơ với axit, bazơ và các hóa chất khác dùng chế tạo các máy móc, thiết bị dùng trong nhà máy sản xuất hóa chất
- Có hợp kim chịu nhiệt cao, chịu ma sát mạnh dùng làm ống xả trong động cơ phản lực
- Có hợp kim có nhiệt độ nóng chảy rất thấp dùng chế tạo giàn ống dẫn nước chữa cháy tự động...
- Những hợp kim nhẹ, bền chịu được nhiệt độ cao và áp suất cao dùng để chế tạo tên lửa, tàu vũ trụ, máy bay, ô tô, …
- Những hợp kim có tính bền hoá học và cơ học cao dùng để chế tạo các thiết bị trong ngành dầu mỏ và công nghiệp hoá chất.
- Những hợp kim không gỉ dùng để chế tạo các dụng cụ y tế, dụng cụ làm bếp, …
- Hợp kim của vàng với Ag, Cu (vàng tây) đẹp và cứng dùng để chế tạo đồ trang sức và trước đây ở một số nước còn dùng để đúc tiền.

