Lý thuyết về các hợp chất quan trọng của kim loại kiềm thổ hay, chi tiết nhất - Hoá học lớp 12
Lý thuyết về các hợp chất quan trọng của kim loại kiềm thổ hay, chi tiết nhất
Tài liệu Lý thuyết về các hợp chất quan trọng của kim loại kiềm thổ hay, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về các hợp chất quan trọng của kim loại kiềm thổ từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

I. Canxi oxit - Vôi sống (CaO)
- CaO là chất rắn màu trắng.
- Là oxit bazơ, tác dụng mãnh liệt với nước tạo thành bazơ mạnh.
- Tác dụng với nhiều axit và oxit axit
CaO + 2HCl → CaCl2 + H2O
CaO + CO2 → CaCO3
- Điều chế:
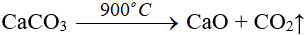
II. Canxi hiđroxit (Ca(OH)2)
1. Tính chất vật lý
- Là chất rắn, tan ít trong nước (1 lít nước ở 20oC hòa tan được 0,02 mol Ca(OH)2)
+ Be(OH)2; Mg(OH)2 rất ít tan trong nước.
+ Ca(OH)2 tương đối ít tan (0,12g/100g H2O).
+ Các hiđroxit còn lại tan nhiều trong nước.
- Độ bền nhiệt của hiđroxit tăng từ Be → Ba: Mg(OH)2 mất nước ở 150oC; Ba(OH)2 mất nước ở 1000oC tạo thành oxit.
- Tính bazơ: Be(OH)2 là bazơ rất yếu, Mg(OH)2 là bazơ trung bình, Ca(OH)2; Ba(OH)2; Sr(OH)2 là bazơ mạnh.
2. Tính chất hóa học
- Tác dụng với axit và oxit axit tạo muối tương ứng.
Ca(OH)2 + 2HCl → CaCl2 + H2O
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + CO2 → Ca(HCO3)2 (2)
- Tác dụng với muối:
Ca(OH)2 (dung dịch) + MgCl2 → CaCl2 + Mg(OH)2↓
3. Ứng dụng: Hợp chất hidroxit kim loại kiềm thổ Ca(OH)2 ứng dụng rộng rãi hơn cả: trộn vữa xây nhà, khử chua đất trồng, sản xuất cloruavôi dùng để tẩy trắng và khử trùng.
4. Điều chế:
III. Canxi cacbonat (CaCO3)
- Là chất rắn màu trắng, không tan trong nước nhưng tan trong amoniclorua:
CaCO3 + 2NH4Cl → CaCl2 + 2NH3↑ + H2O + CO2↑
- Tác dụng với nhiều axit hữu cơ và vô cơ.
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- Nhiệt phân: bị phân hủy ở nhiệt độ cao
CaCO3 → CaO + CO2
- Phản ứng đặc biệt:
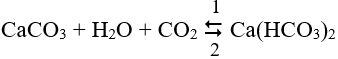
+ Chiều thuận (1) xảy ra ở nhiệt độ thấp, giải thích sự xâm thực của nước mưa với đá vôi.
+ Chiều nghịch (2) xảy ra ở nhiệt độ cao, giải thích sự hình thành thạch nhũ trong hang động, cặn trong ấm nước, ...
IV. Ca(HCO3)2: Canxi hidro cacbonat
- Tan trong nước:
Ca(HCO3)2 → Ca2+ + 2HCO3-
- Thể hiện tính lưỡng tính: tác dụng cả bazo mạnh và axit mạnh
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Nhiệt phân: Bị phân hủy khi đun nóng nhẹ
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Phản ứng trao đổi với CO32- và PO43-
Ca2+ + CO32- → CaCO3↓
3Ca2+ + 2PO43- → Ca3(PO4)2↓
V. Canxi sunphat (CaSO4)
- Tính chất:
+ Là chất rắn màu trắng tan ít trong nước (ở 25oC tan 0,15g/100g H2O).
+ CaSO4: không tan trong nước, không tác dụng với nước, chỉ phân hủy ở nhiệt độ rất cao
2CaSO4 → 2CaO + 2SO2 + O2 (960oC)
- Ứng dụng
+ Thạch cao nung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì giãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương...
+ Thạch cao sống dùng để sản xuất xi măng.
VI. Nước cứng
1. Khái niệm
- Nước có nhiều ion Ca2+, Mg2+ là nước cứng.
- Nước không chứa hoặc chứa ít các ion trên gọi là nước mềm.
2. Phân loại
Căn cứ vào thành phần các anion gốc axit có trong nước cứng, người ta chia nước cứng ra 3 loại:
+ Nước cứng tạm thời chứa các ion Ca2+, Mg2+, HCO3-.
Ca(HCO3)2 → Ca2+ + 2HCO3-
+ Nước cứng vĩnh cửu chứa các ion Ca2+, Mg2+, Cl-, SO42-. Gọi là vĩnh cữu vì khi đun nóng muối đó sẽ không phân hủy.
+ Nước cứng toàn phần là nước có cả tính tạm thời và vĩnh cửu.
Nước tự nhiên thường có cả tính cứng tạm thời và vĩnh cửu.
3. Tác hại của nước cứng
- Ảnh hưởng đến cuộc sống thường ngày:
+ Giặt áo quần bằng xà phòng (natri stearat C17H35COONa) trong nước cứng sẽ tạo ra muối không tan là canxi stearat (C17H35COO)2Ca, chất này bán trên vải sợi, làm cho quần áo mau mục nát.
2C17H35COONa + MCl2 → (C17H35COO)2M↓ + 2NaCl
+ Nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa.
+ Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị do phản ứng của các ion và các chất trong thực phẩm.
- Ảnh hưởng đến sản xuất
+ Khi đun nóng, ở đáy nồi hay ống dẫn nước nóng sẽ gây ra lớp cặn đá kém dẫn nhiệt làm hao tổn chất đốt, gây nổ nồi hơi và tắt nghẽn ống dẫn nước nóng (không an toàn) ...
+ Làm hỏng nhiều dung dịch cần pha chế.
Do đó việc làm mềm nước cứng trước khi dùng có ý nghĩa rất quan trọng.
4. Phương pháp làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là giảm nồng độ các cation Ca2+, Mg2+ trong nước cứng.
Phương pháp hóa học:
+ Đối với nước cứng tạm thời, đun nóng hoặc dùng Ca(OH)2 rồi lọc kết tủa:
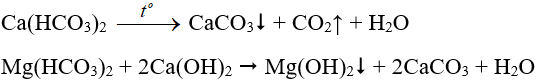
Cả hai loại nước cứng đều có thể dùng dung dịch Na2CO3:
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
+ Phương pháp trao đổi ion: cho nước cứng qua chất trao đổi ion là các hạt zeolit thì số mol ion Na+ của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho các ion Ca2+ và Mg2+ bị giữ lại trong mạng tinh thể silicat.

