Lý thuyết về các hợp chất quan trọng của nhôm hay, chi tiết - Hoá học lớp 12
Lý thuyết về các hợp chất quan trọng của nhôm hay, chi tiết
Tài liệu Lý thuyết về các hợp chất quan trọng của nhôm hay, chi tiết Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về các hợp chất quan trọng của nhôm từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

I. Nhôm oxit: Al2O3
1. Tính chất vật lý
+ Màu trắng, bền với nhiệt, không nóng chảy.
+ Không tác dụng với nước, không tan trong nước.
2. Tính chất hóa học
+ Là oxit lưỡng tính: phản ứng với kiềm nóng chảy và dung dịch axit:
Al2O3 + 2NaOH + 3H2O → Na[(Al(OH)4]
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Vì rất bền nên Al2O3 rất khó bị khử thành kim loại: Khử Al2O3 bằng C không cho Al mà thu được Al4C3:
Al2O3 + 9C → Al4C3 + 6CO
+ Al2O3 không tác dụng với H2, CO ở bất kì nhiệt độ nào.
3. Ứng dụng
+ Điều chế đá quý nhân tạo
+ Tinh thể Al2O3 còn được dùng để chế tạo các chi tiết trong các ngành kĩ thuật chính xác như chân kính đồng hồ, thiết bị phát tia laze,...
+ Bột Al2O3 có độ cứng cao (emeri) được dùng làm vật liệu mài.
+ Phần chủ yếu nhôm oxit được dùng để điều chế nhôm.
+ Ngoài ra, Al2O3 còn được dùng làm vật liệu chịu lửa: chén nung, ống nung và lớp lót trong các lò điện. Nhôm oxit tinh khiết còn được dùng làm ximăng tram răng.
4. Điều chế: Trong công nghiệp, Al2O3 được điều chế bằng cách nung Al(OH)3 ở nhiệt độ cao 1200 – 1400oC:
2Al(OH)3 → Al2O3 + 3H2O
II. Nhôm hydroxit: Al(OH)3
1. Tính chất vật lý
+ Là hợp chất màu trắng, kết tủa keo, không tan trong nước, không bền nhiệt.
2. Tính chất hóa học
+ Dễ bị nhiệt phân thành nhôm oxit:
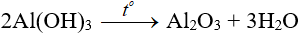
+ Là hợp chất lưỡng tính, tan trong axit và bazơ:
Al(OH)3 + 3H+ → Al3+ + 3H2O
Al(OH)3 + OH- → [(Al(OH)4]-
Ví dụ:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
3. Điều chế
Cho muối Al3+ phản ứng với dung dịch NH3 hoặc muối Na2CO3
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Hoặc từ muối NaAlO2:
2NaAlO2 + CO2 + 3H2O → 2Al(OH)3↓ + Na2CO3
NaAlO2 + CH3COOH + H2O → Al(OH)3↓ + CH3COONa
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
III. Nhôm sunfat và phèn chua
- Nhôm sunfat Al2SO4 là chất bột màu trắng, bị phân hủy nhiệt trên 770oC. Nhôm sunfat kết hợp với kim loại kiềm tạo thành loại muối gọi là phèn nhôm, mà quan trọng nhất là phèn chua K2SO4.Al2SO4.24H2O.
- Phèn chua có dạng tinh thể, không màu, có vị hơi chua và chát.
- Phèn chua được dùng nhiều trong công nghiệp giấy, nhuộm, thuộc da và làm trong nước. Những công dụng này đều xuất phát từ sự thủy phân khá mạnh trong nước của muối nhôm tạo thành nhôm hiđroxit:
KAl(SO4)2.12H2O → K+ + Al3+ + 2SO42- + 12H2O
Al3+ + 3H2O ↔ Al(OH)3↓ + 3H+

